Curso: Farmácia
Semestre: 2010/1
Horário: Segundas (15:00-19:00)
Disciplina: FIS07046 – Física Aplicada à Farmácia
Turma: 01
Local: IC-1 – Sala 25
Data: 05/04/2010
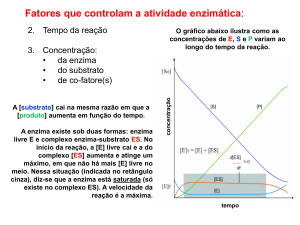
Cinética enzimática: Equação de Lineweaver-Burk
K 1
1
1
=
+ m
v0 vmax vmax [ S ]
v0
[S]
vmax
Km
Velocidade inicial da reação catalisada por enzima;
Concentração de substrato
Velocidade máxima inicial da reação catalisada por enzima;
Constante de Michaelis (valor de [S] no qual v0 = ½ vmax;
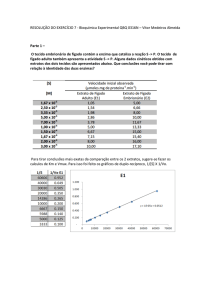
Problema:
A enzima isocitrato liase presente em Escherichia coli, que cresce aerobicamente em
acetato como única fonte de carbono, catalisa a clivagem de Ls-isocitrato a glioxalato e
succinato:
isocitrato → glioxalato + succinato
A atividade da enzima pode ser medida acompanhando-se a produção de glioxalato em pH
6,8 e 30oC. Obtiveram-se os seguintes dados quando a velocidade inicial da reação,
catalisada por uma concentração fixa de isocitrato liase, foi medida dentro de um intervalo
de concentrações de isocitrato:
Concentração de Ls-isocitrato (µM)
18
24
30
40
100
Velocidade inicial (mµ mol/min)
4,08
4,41
5,32
5,63
6,90
Calcular os valores de Km e vmax para a reação catalisada por enzima sob essas condições de
análise.
1