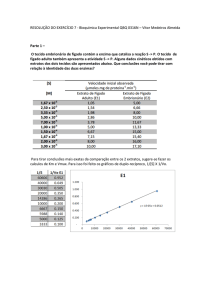
Quimotripsina
COMPLEMENTARIDADE ENTRE
DIIDROFOLATO REDUTASE ES SEUS SUBSTRATOS
Amarelo: tetraidrofolato
Vermelho: NADP+
“BASTÃO-ASE”
DGM contribuido pelas interações entra e enzima e o estado de
transição
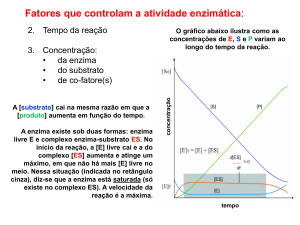
Cinêtica Enzimática Michaelis-Menten
k1
kcat
E + S ES E + P
k-1
V = kcat[ES]
Assumir que: d[ES]/dt = 0
k1[E][S] – k-1[ES] – kcat[ES] = 0
[E]tot = [E] + [ES]
Vmax = kcat x [E]totKM = k-1/k1
Vo = Vmax[S] = kcatx[E]totx[S]
Km+[S]
Km+[S]
Diagrama
Lineweaver-Burk
(Duplo-reciprocal)
INIBIÇÃO COMPETITIVO:
substrato e inibidor competem para o mesmo sítio
Km
kcat
Vo = Vmax[S]/(aKm + [S])
a = 1 + [I]/KI
Vo = Vmax[S]/(Km + a’[S])
Quando [S]>>Km, Vo = Vmax/a’
a’ = 1 + [I]/K’I
INIBIÇÃO NÃO-COMPETITIVO:
substrato e inibidor competem para
sítios diferentes;
inibidor somente liga ao complexo ES
Vo = Vmax[S]/(aKm + a’[S])
Diagrama Lineweaver-Burk para inibição competitiva
a = 1 + [I]/KI
Diagrama Lineweaver-Burk para inibição não-competitiva
Diagrama Lineweaver-Burk para inibição mista
ativa
inativa
EH+ E + H+
pKa = 3,5
inativa
ativa
inativa
EH22+ EH+ + H+ E + 2H+
pKa = 6,0
pKa = 9,0
Quimotripsina
Quimotripsina
vermelha: ser195, asp 102, his57
Quimotripsina
vermelha: ser195, asp 102, his57
Sítio ativo de quimotripsina
HEXOQUINASE
Sem glicose
Com glicose
Inibição
“Feedback”
Alosteria: curva sigmoidal de uma enzima homotrópica:
o substrato age como uma moduladora positiva
Alosteria: curvas sigmais de uma enzima em que
moduladoras positivas e negativas modificam K0.5
sem modificar Vmax.
Alosteria: curvas sigmoidais de uma enzima em que
moduladoras positivas e negativas modificam Vmax
Sem modificar K0.5 (menos comum).
Estrutura da mioglobina (153 aminoácidos, MW = 16700 Da)
Estrutura básica das
Porfirinas
4 anels de pirrole
conectados por
pontes de =C-
HEME =
Prorporfirina IX
HEME
His próximal
P + L PL
Ka = [PL]/[P][L] = 1/Kd
q = [PL]/{[PL]+[P]}
P + L PL
Ka = [PL]/[P][L] = 1/Kd
q = [PL]/{[PL]+[P]}
Ka = constante de associação, Kd = constante de dissociação = 1/Ka
Fração de sítios ocupados = q
q = [PL]/{[PL]+[P]}
q = Ka[P][L]/{Ka[P][L]+[P]}
q = Ka[L]/{Ka[L]+1}
q = [L]/{[L]+1/Ka}
q = [L]/{[L]+Kd]}
equação tipo x = y/(y+z) descreve uma hipérbola
Quando [L]=Kd=1/Ka,
q = 0,5 (50% dos sítios ocupados)
Curva de ligação de oxigênio a mioglobina
P50 = 0,26 kPa
q= fração dos sítios
ocupados com ligantes
q= [L]/{[L]+Kd]}
q= [02]/{[02]+ [02] 50}
q=p02/{p02+P50}
Ligação de oxigênio a heme
Ligação de monôxido de carbono a heme
Aminoácidos chaves de mioglobina que interagem com heme e O2
His distal
His proximal
Conservado em
todas as globinas
Conservado nas
três estruturas
Interações entre subunidades em hemoglobina
Contatos
a1-b1
mudam
pouco
quando O2
liga
Contatos a1-b2
Contatos a1-b2 no estado T
INTERAÇÕES IÔNICAS NO ESTADO T da Hb
Ligação de oxigênio a hemoglobina
Curva hiperbólica de
Ligação de baixa afinidade
Curva sigmoidal de
Ligação cooperativa
Curva hiperbólica de
Ligação de baixa afinidade
Dois modelos moleculares para explicar ligação cooperativa
T
R
Modelo MWC
Monod, Wyman Changeux
(“simultânea”)
Modelo “sequencial”
Efeito Bohr (Christian, pai e médico; não Niels, filho e físico)
Hb + O2 HbO2
Sangue
no pulmão
HHb+ + O2 HbO2 + H+
Logo nos tecidos internos
onde [H+] é alto, H+ liga a Hb
e causa a dissociação de O2.
Sangue
nos tecidos
internos
H+ e O2 ligam em sítios
diferentes:
-O2 liga no Fe do grupo heme
-H+ liga em vários grupos de
aminoácidos que estabilizam
o estado T (baixa afinidade
para O2)
ie: His146(+) ..... Asp94(-)
CO2 + H2N----(a-amino da cadeia)
H+ + -O2C-NH---terminal “carbamino”
Contribui para o efeito Bohr
[BPG] alta em hemácias
HbO2 + BPG HbBPG + O2
HbO2 + BPG HbBPG + O2
No nível de mar, a diferença entre
pO2 nos pulmões e nos tecidos permite
o sangue soltar ~40% da sua
capacidade de O2 nos tecidos.
Em altitudes altas, o forneciemnto de
O2 diminuiria para 30% de capacidade
sanguina....
Para compensar, a [BPG]aumenta e a
afinidade da Hb para O2 cai, resultando
no aumento de fornecimeno de O2 para
os tecidos até ~40% de sua capacidade.
O estado T da Hb tem um sítio para BPG (cargas positivos em azul)
O estado R da Hb perdeu seu sítio para BPG
Hemácias normais
Variação de formas de hemácias em anemia falsiforme
Anemia falsiforme: uma doença molecular
Glu6 Val na cadeia beta
Glu6 Val na cadeia beta
resulta num superfície
hidrofóbico que promove
associação entre moléculas
para formar filamentos e fibras