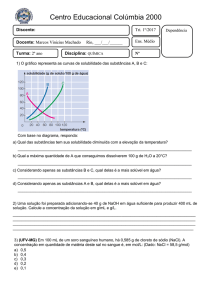
Química Analítica I
Equilíbrio iônico e ácidos e bases
Profª Simone Noremberg Kunz
2
Conceitos de ácidos e bases
Arrhenius:
• ácidos: liberam apenas H+ (H3O+) como cátion;
• bases (ÁLCALIS): liberam apenas OH- como ânion;
ácido + base sal + água
• problema: definição limitada exclusivamente às soluções
aquosas.
Conceitos de ácidos e bases
Brønsted-Lowry:
• ácidos: doadores de H+;
• bases: recebedores H+ (não precisam ter OH-);
Substâncias Anfóteras: podem ter comportamento ácido ou
básico, dependendo da situação.
Pares conjugados (ácido-base):
HA(aq) + H2O(ℓ) ⇄ H3O+(aq) + A-(aq)
ácido + base ⇄ ácido + base
Conceitos de ácidos e bases
Lewis:
• ácidos: receptores de par de elétrons;
• bases: doadores de par de elétrons;
ácido + base sal + água
• obs.: ácidos e bases de Lewis não precisam conter prótons
(definição mais geral que as de Arrhenius e BrønstedLowry).
Equilíbrio iônico da água
• um caso muito particular de equilíbrio químico é o equilíbrio
iônico da água;
• a água sofre autoionização, mas, como é um eletrólito muito
fraco, estabelece o equilíbrio abaixo:
2 H2O(ℓ) ⇄ H3O+(aq) + OH-(aq)
ou simplesmente:
H2O(ℓ) ⇄ H+(aq) + OH-(aq)
H20 (l)
H+ (aq)
OH- (aq)
Equilíbrio iônico da água
• A constante de equilíbrio é expressa da seguinte forma:
Kw = [H+].[OH-]
• Em que:
• Kw: produto iônico da água (w vem de water, água em inglês);
• [H+], [OH-]: concentrações molares dos íons envolvidos.
• Como qualquer constante de equilíbrio, seu valor varia apenas com a
temperatura.
K eq [H 3O ][OH ]
K w [H 3O ][OH ] 1,0 10-14 (a 25º C)
Produto iônico da água
H 2O(l ) H 2O(l )
H 3O
( aq)
• A 25°C, em água pura, temos:
[H+] = [OH-] = 10-7 mol/L
• Assim sendo:
Kw = [H+].[OH-] = 10-14
OH
( aq)
Produto iônico da água
•
Tipos de soluções (a 25°C)
a) Água pura (solução neutra):
[H+] = [OH-] = 10-7 mol/L
b) Solução ácida:
[H+] > 10-7 mol/L
[OH-] < 10-7 mol/L
c) Solução básica (alcalina):
[H+] < 10-7 mol/L
[OH-] > 10-7 mol/L
9
Equilíbrio iônico da água (Kw)
pH e pOH
Água pura ou solução neutra: [H+] = [OH-] pH = 7
Solução ácida: [H+] > [OH-] pH < 7
Solução básica: [H+] < [OH-] pH > 7
10
Lei de diluição de Ostwald
Grau de ionização de uma substância química
n(ionizados ) [ H ]
n(dissolvidos )
[ H ] .M Para monoácidos
[H ]
%
x100
K= α2 . M
O grau de
ionização
aumenta...
...quando a
solução é
diluída.
11
Lei de diluição de Ostwald
Uma solução aquosa 0,045 mol/L de ácido acético,
CH3COOH, apresenta o ácido 2% dissociado em H+ e CH3COO-.
Qual será a concentração de cada um desses íons na solução ?
Um monoácido fraco tem constante de ionização igual a
10-8, em temperatura ambiente. Esse ácido, numa solução 1 M,
terá qual grau de ionização?
12
1. Considere as seguintes amostras:
1. Água pura
2. Água de cal
3. Água acidulada
Da comparação de pH das amostras resulta:
a) pH1 = pH2 > pH3
b) pH1 > pH2 = pH3
c) pH1 > pH2 > pH3
d) pH2 > pH1 > pH3
e) pH2 < pH1 < pH3
2. Ao analisar um determinado suco de tomate, um técnico
determinou que sua concentração hidrogeônica é igual a 0,001 M.
Assim, qual será o pH desse suco?
13
3. Uma solução aquosa , a 25°C tem pH = 5,0. Nessa solução, qual
a concentração molar de íons OH-?
4. Qual o pH de uma solução de hidróxido de sódio 0,1 M?
5. Qual o pH de uma solução de hidróxido de potássio que
apresenta 0,56 g dessa base dissolvidos em 1 L de solução?
6. Qual o pH de uma solução se:
a)[OH-]= 0,01 mol/L
b)[OH-]= 1,8 x 10-9 mol/L
c) [H+]= 3,6 x 10-4 mol/L
14
7. Calcule o pH de uma solução de a) HBr 1,0 x 10 -3 M;
b) KOH 1,0 x 10-2 M
8. Qual a concentração de HClO4 em uma solução onde o pH medido foi de 1,092?
9. Uma solução foi preparada pela diluição de 5 mL de uma solução de ácido clorídrico
4 M em 250 mL. Qual o pH da solução?
10. Uma solução de hidróxido de sódio foi preparada pela dissolução de 6 g do
reagente em 100 mL. 10 mL dessa solução foram diluídos à 1000 mL. Qual o pH da
solução final?
11. Um técnico adicionou 10 ml de ácido nítrico concentrado (d=1,34 g/mL, C=63%)
em um balão volumétrico com água destilada e completou o volume à 200 mL. Qual o
pH da solução?