Funções Inorgânicas
Aula 1 2° ano
Professor: Bruno
Funções Químicas
Função Química é o conjunto de substâncias
com propriedades químicas semelhantes,
denominadas PROPRIEDADES FUNCIONAIS.
As principais funções inorgânicas são: ácidos,
bases, sais e óxidos.
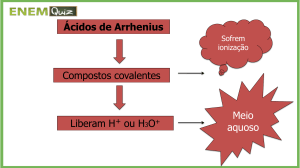
Teoria Ácido-Base de Arrhenius
Svante August Arrhenius (1859-1927),
químico e físico sueco, desenvolveu a teoria
da dissociação iônica. Segundo essa teoria,
o íon de hidrogênio H+, que na presença de
água forma o cátion hidrônio (H3O+), é
responsável pelas propriedades ácidas;
enquanto o ânion hidroxila (OH-), pelas
propriedades básicas.
HCl(aq) H+(aq) + Cl-(aq)
NaOH(aq) Na+(aq) + OH-(aq)
Os ácidos são substâncias moleculares,
sendo assim, o processo da liberação de
íons H+ ocorre por ionização. Ou seja, há
rompimento de ligações covalentes com
formação de íons.
As bases são, geralmente, substâncias
iônicas; portanto, o processo de liberação
de íons OH- ocorre por dissociação
iônica.
Representação eletrônica de Lewis
do íon hidrônio
Classificação dos ácidos
monoácidos: na ionização libera apenas 1H+
. Exemplo: HCN, HCl, HNO3, etc.
diácidos: na ionização libera 2H+ . Exemplo:
H2SO4, H2CO3, etc.
triácidos: libera 3H+: H3PO4, H3BO3, etc
tetrácidos: libera 4H+: H4P2O7, H4SiO4, etc
Os ácidos com 2 ou mais hidrogênios
ionizáveis são denominados poliácidos.
•
•
Hidrácidos: não contêm oxigênio: HCl, HBr,
H2S, etc;
Oxiácidos: contêm oxigênio: HNO3, H2SO4,
e H3PO4, etc.
Nomenclatura dos ácidos
Hidrácidos
Ácido (nome do elemento) + ídrico
Exemplos:
HCl – ácido clorídrico
HBr –
HI –
HF –
H2S HCN
Oxiácidos:
Ácido (nome do elemento) + ico
Adotando como padrão os cinco ácidos
abaixo:
HClO3 – Ácido clórico
H2SO4 – Ácido sulfúrico
HNO3 – Ácido nítrico
H3PO4 – Ácido fosfórico
H2CO3 – Ácido carbônico
Variando o n° de oxigênio desses ácidos,
obteremos outros cujos nomes são
formados pela união de sufixos e prefixos: