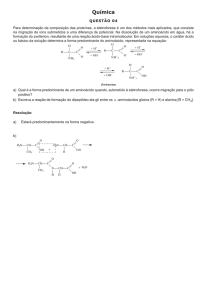
Equilíbrios iônicos
Para ácidos e bases fracos...
Quais são
eles
mesmo???
Quanto maior o valor do K,
mais forte é o ácido/base!!!!
E o que ocorre
com ácidos e
bases fortes??
Lei da diluição de Ostwald
Para treinar...
1) O ácido acético, em solução aquosa 0,02 molar e a 25°C, está
3% dissociado. Quanto vale sua constante de dissociação
nessas condições?
2) Assinale a alternativa que NÃO é correta a respeito do que
acontece quando se dilui uma solução de hidróxido de
amônio, mantendo-se a temperatura constante:
a) A constante de dissociação da base diminui
b) O grau de ionização da base aumenta
c) A massa de ácido necessária para a neutralização total da
base é a mesma antes ou depois da diluição
d) A concentração molar dos cátions amônio diminui
Auto-ionização da água
É SEMPRE, SEMPRE SEMPRE esse valor
a essa temperatura!!!
Auto-ionização da água
• Portanto:
se [H+] = 10-7, então [OH-] =
se [H+] = 10-5, então [OH-] =
se [H+] = 10-11, então [OH-] =
Por definição, se
[H+]
[OH-]
[OH-]
[H+]
Meio neutro
Meio ácido
[H+]
[OH-]
Meio básico
Escalas de pH e pOH
pH + pOH =
Em soluções ácidas, pH
Em soluções neutras, pH
Em soluções básicas, pH
Para treinar
[H+]
10-3
10-8
[OH-]
10-5
pH
4
pOH
Solução
1
ácida
6
7
neutra
Qual é o pH de uma solução aquosa 0,01 molar de NaOH?
Dentre os líquidos citados, o único que tem caráter ácido é:
a) Refrigerante
b) Lágrima
c) Sangue
d) Saliva
e) Leite de magnésia (Mg(OH)2)
Indicadores ácido-base
Fenolftaleína
Indicador universal
Indicadores ácido-base
Efeito do íon comum
• Basta lembrar do princípio de Le Chatelier. Mas também
devemos levar a auto-ionização da água em consideração!!!