Centro Educacional Colúmbia 2000
Discente:
Tri. 1º/2017
Docente: Marcos Vinicius Machado
Turma: 2º ano
Rio, ___/___/______
Disciplina: QUÍMICA
Dependência
Ens. Médio
Nº
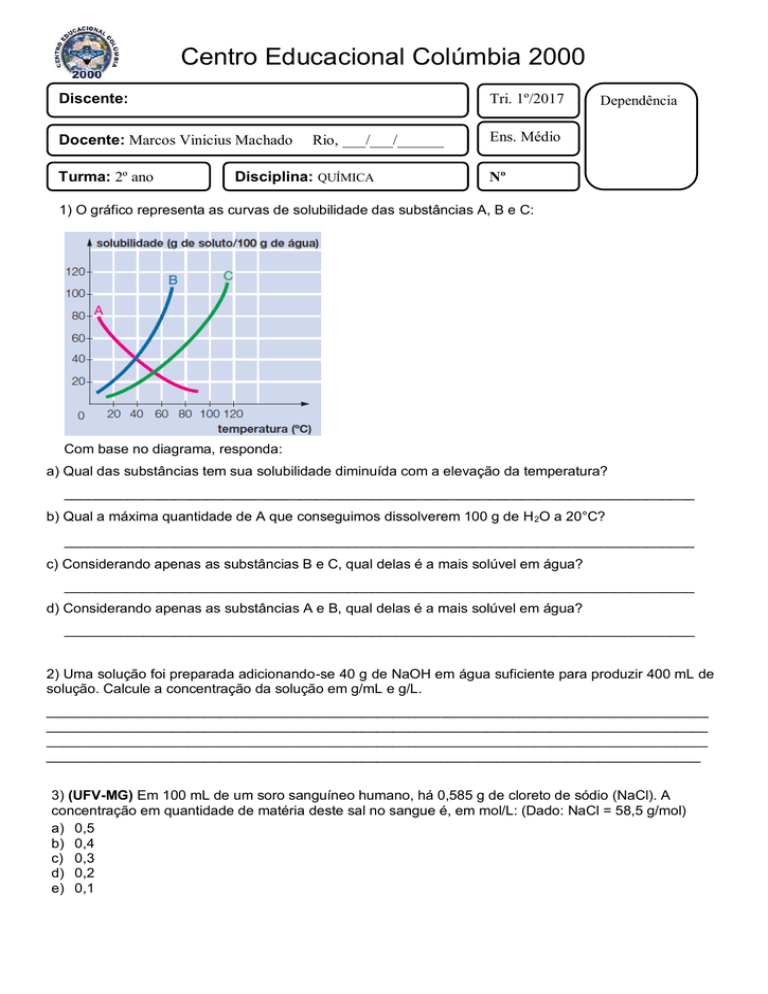
1) O gráfico representa as curvas de solubilidade das substâncias A, B e C:
Com base no diagrama, responda:
a) Qual das substâncias tem sua solubilidade diminuída com a elevação da temperatura?
________________________________________________________________________________
b) Qual a máxima quantidade de A que conseguimos dissolverem 100 g de H 2O a 20°C?
________________________________________________________________________________
c) Considerando apenas as substâncias B e C, qual delas é a mais solúvel em água?
________________________________________________________________________________
d) Considerando apenas as substâncias A e B, qual delas é a mais solúvel em água?
________________________________________________________________________________
2) Uma solução foi preparada adicionando-se 40 g de NaOH em água suficiente para produzir 400 mL de
solução. Calcule a concentração da solução em g/mL e g/L.
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
___________________________________________________________________________________
3) (UFV-MG) Em 100 mL de um soro sanguíneo humano, há 0,585 g de cloreto de sódio (NaCl). A
concentração em quantidade de matéria deste sal no sangue é, em mol/L: (Dado: NaCl = 58,5 g/mol)
a) 0,5
b) 0,4
c) 0,3
d) 0,2
e) 0,1
4) (UFCE) Qual é a molaridade de uma solução aquosa de etanol (C2H6O) de concentração igual a 4,6
g/L? (massa molar do etanol = 46 g mol–1)
a) 4,6
b) 1,0
c) 0,50
d) 0,20
e) 0,10
5) (UFPI) A uma amostra de 100 mL de NaOH de concentração 20 g/L foi adicionada água suficiente para
completar 500 mL. A concentração, em g/L, dessa nova solução é igual a:
a) 2
b) 3
c) 4
d) 5
e) 8
6) (UERJ) Diluição é uma operação muito empregada no nosso dia-a-dia, quando, por exemplo,
preparamos um refresco a partir de um suco concentrado. Considere 100 mL de determinado suco em que
a concentração do soluto seja de 0,4 mol/L. O volume de água, em mL, que deverá ser acrescentado
para que a concentração do soluto caia para 0,04 mol/L, será de:
a) 1000
b) 900
c) 500
d) 400
e) N.D.A
7) (PUC-MG) Sendo o ΔH de formação do óxido de cobre II igual a –37,6 kcal/mol e o ΔH de formação do
óxido de cobre I igual a –40,4 kcal/mol, o ΔH da reação:
Cu2O(s) + 1/2 O2(g) → 2 CuO(s)
será:
a) –34,8 kcal.
b) –115,6 kcal
c) –5,6 kcal.
d) +115,6 kcal.
e) +34,8 kcal.
8) (UNI-RIO) Os romanos utilizavam CaO como argamassa nas construções rochosas. O CaO era
misturado com água, produzindo Ca(OH)2, que reagia lentamente com o CO2‚ atmosférico, dando
calcário:
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
A partir dos dados da tabela anterior, a variação de entalpia da reação, em kJ/mol, será igual a:
a)138,2
b) - 69,1
c)-2828,3
d)+ 69,1
e)-220,8
9) (Ufac) O número de oxidação do átomo de nitrogênionos compostos: N2O5; NO; HNO3 e NaNO2 é,
respectivamente:
10) Quais são os números de oxidação do cloro nas substâncias Cl 2, NaCl, KClO e HClO4?
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
11) (Fuvest-SP) Na reação: H2S + I2 →S + 2 HI as variações dos números de oxidação do enxofre e do
iodo são, respectivamente:
a) +2 para zero e zero para +1.
b) zero para +2 e +1 para zero.
c) zero para –2 e –1 para zero.
d) zero para –1 e –1 para zero.
e) –2 para zero e zero para –1.
12) (UFV-MG) No processo de obtenção do aço, ocorre a reação representada por:
Fe2O3 + CO → CO2 + Fe
I - Qual elemento sofre redução?
II - Qual elemento sofre oxidação?
III - Qual substância é o agente redutor?
IV - Qual substância é o agente oxidante?
13) Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
a) A velocidade da reação direta é igual à velocidade da reação inversa.
b) Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
c) As características macroscópicas do sistema (desde que fechado) não mais se alteram.
d) Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
e) Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser
iguais.
14) Escreva a expressão da constante de equilíbrio das seguintes reações:
a) H2(g) + I2(g)
b) 3C2H2(g)
2HI(g)
C6H6(g)
c) N2(g) + 3H2(g)
2NH3(g)
15 – Num recipiente fechado estão em equilíbrio:
N2(g) + O2(g)
2NO(g)
A uma temperatura de 20ºC as pressões parciais são as seguintes: N 2 = 0,4 atm; O2 = 0,2 atm; NO = 0,4
atm. Nessas condições calcule, calcule o valor de Kp.
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
____________________________________________________________________________________
16) São processos endotérmico e exotérmico, respectivamente:
a) fusão e ebulição
b) solidificação e liquefação
c) condensação e sublimação;
d) sublimação e fusão
e) vaporização e solidificação
17) Relacione a coluna abaixo com base no “Produto iônico da água (Kw)”: (Valor: 1,0 pt)
(1) Solução Neutra
( ) [H+] < [OH-]
(2) Solução Ácida
( ) [H+] = [OH-]
(3) Solução Básica
( ) [H+] > [OH-]
Marque a ordem correta:
a) 2,1,3
b) 2,3,1
c) 1,2,3
d) 3,1,2
e) 3,2,1
18) Observe os líquidos da tabela a seguir:
Líquido
Leite
Água do mar
Coca-cola
Café preparado
Lágrima
Água de lavadeira
[H+]
1,0 . 10-7
1,0 . 10-8
1,0 . 10-3
1,0 . 10-5
1,0 . 10-7
1,0 . 10-12
Tem caráter NEUTRO apenas:
a)
b)
c)
d)
e)
a água de lavadeira.
o leite e a lágrima.
o café preparado e a Coca-cola.
a água do mar e a água de lavadeira.
a Coca-cola.
[OH-]
1,0 . 10-7
1,0 . 10-6
1,0 . 10-11
1,0 . 10-9
1,0 . 10-7
1,0 . 10-2
19) Na pilha eletroquímica sempre ocorre:
a) oxidação do cátodo.
b) movimento de elétrons no interior da solução eletrolítica.
c) reação com diminuição de calor.
d) passagem de elétrons, no circuito externo, do ânodo para o cátodo.
e) reação de neutralização.
20) Numa reação de oxirredução:
a) O agente redutor sofre redução.
b) A substância que perde o elétron é o agente redutor
c) O número de oxidação do agente oxidante aumenta.
d) O número de oxidação do agente redutor diminui.
e) Substância que perde elétron é o agente oxidante.
“O VERDADEIRO SÁBIO É UM ETERNO APRENDIZ!”












