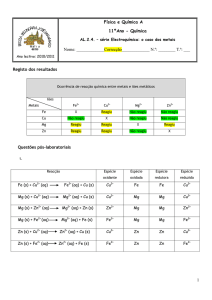
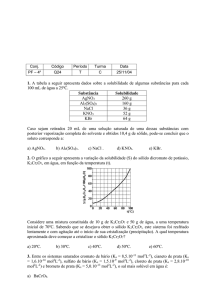
Professora Sonia
Exercícios Sobre Potenciais elétricos e Pilhas - Eletroquímica
01. (U. F. Uberlândia – MG) São dadas as seguintes semi-reações, com respectivos potenciais
de eletrodos:
Mg → Mg2+ + 2eNi → Ni2+ + 2eCu → Cu2+ + 2eAg → Ag+ + 2e-
Eo = + 2,34 volts
Eo = + 0,25 volts
Eo = - 0,35 volts
Eo = - 0,80 volts
Considere agora as seguintes reações:
I – Mg + Ni2+ → Mg2+ + Ni
II – Ni + Cu2+ → Ni2+ + Cu
III – 2Ag+ + Mg → Mg2+ + 2Ag
IV – Ni2+ + 2Ag → Ni + 2Ag+
A análise das equações I, II, III e IV nos permite concluir que:
a) somente II e III são espontâneas.
b) somente III e IV são espontâneas.
c) somente I e II são espontâneas.
d) somente I, II, III são espontâneas.
e) I, II, III e IV são espontâneas.
02. (Fuvest) Moedas feitas com ligas de cobre se oxidam parcialmente pela reação do
ambiente. Para "limpar" estas moedas pode-se utilizar o arranjo esquematizado a seguir. Ao
se fechar o circuito, a semi-reação que ocorre na moeda é:
a) Cu → Cu2+ + 2 ed) Cu + Cu2+ → 2 Cu+
b) Cu → Cu+ + ee) Cu2+ + 2 OH- → Cu(OH)2
c) Cu2+ + 2 e- → Cu
03. (Fuvest) A figura a seguir está representando um ciclo de transformações químicas do
cobre.
www.quimicaparaovestibular.com.br
[email protected]
1
Professora Sonia
Semi-reação
Zn2+ + 2e- → Zn
Cu2+ + 2e- → Cu
Ag+ + e- → Ag
NO3- + 4H+ + 3e- → NO + 2H2O
Cl2 + 2e- → 2Cl-
E°/V
- 0,76
+ 0,34
+ 0,80
+ 0,96
+ 1,40
Nesse ciclo, X, Y e Z correspondem, respectivamente, a:
a) HNO3, NO3- e Ag.
b) NO, NO3- e Zn.
c) Cl2, Cl- e Ag.
d) NO, NO3- e Ag.
e) HNO3, NO3- e Zn.
04. (Fuvest) Para recuperar prata de soluções aquosas contendo íons Ag+, costuma-se
adicionar zinco metálico às soluções, pois a transformação 2Ag++ Zn° → 2Ag° + Zn2+ é
espontânea. Pode-se concluir então que:
a) o potencial de redução do Ag+/Ag° é maior do que o do Zn2+/Zn°.
b) ocorre transferência de elétrons do Ag+ para Zn°.
c) O Zn° atua como oxidante e o Ag+ como redutor.
d) o Zn° é menos redutor do que Ag°.
e) ocorre a eletrólise do Ag+ e do Zn°.
05. (Pucmg) Uma pilha foi elaborada a partir das associações das meias pilhas: Fe2+/Fe e
Al3+/Al. Eo(Fe2+/Fe) = - 0,44 V; Eo(Al3+/Al) = - 1,66 V. Qual das montagens a seguir representa
CORRETAMENTE a pilha funcionando?
06. (Pucrs) Um método para proteger ou retardar a corrosão do ferro em cascos de navios
consiste em ligar, a essa estrutura, blocos de outros metais. Para investigar os metais que
funcionam como ânodo de sacrifício para o ferro, placas limpas e polidas desse metal foram
enroladas com fitas de cobre, chumbo e magnésio e mergulhadas em três tubos de ensaio
(como o ilustrado a seguir) contendo solução aquosa composta por cloreto de sódio
(simulando a água do mar) e por ferricianeto de potássio, K3[Fe(CN)6] (como indicador de
corrosão do ferro), o qual forma um composto de coloração azul com os íons de ferro.
www.quimicaparaovestibular.com.br
[email protected]
2
Professora Sonia
Eo Fe2+/Fe = - 0,44 V
Eo Mg2+/Mg = - 2,37 V
Eo Pb2+/Pb = - 0,13 V
Eo Cu2+/Cu = + 0,34 V
Considerando as informações apresentadas, conclui-se que, após um período de tempo, o
surgimento da coloração azul será observada apenas no(s) tubo(s):
a) 1
b) 2
c) 3
d) 1 e 2
e) 1 e 3
07. (Uel) Quatro lâminas de alumínio são colocadas em contato com soluções aquosas de:
Mg(NO3)2, Pb(NO3)2, AgNO3 e Zn(NO3)2. Após certo tempo constata-se que a massa do
alumínio permanece inalterada apenas na primeira solução. Com este resultado, é possível
afirmar que, dentre os seguintes metais, o mais redutor é
a) Al b) Pb c) Ag d) Mg e) Zn
08. (Uel) Considere a seguinte tabela de potenciais padrão de redução:
Al3+ + 3e- Al
Eo (volts) = - 1,66
Zn2+ + 2e- Zn
Eo (volts) = - 0,76
Co2+ + 2e- Co
Eo (volts) = - 0,28
Eo (volts) = + 0,34
Cu2+ + 2e- Cu
Ag+ + e- Ag
Eo (volts) = + 0,80
Desses metais, o MAIS redutor é
a) Al
b) Zn
c) Co
d) Cu
e) Ag
09. (Uel)
Amílcar de Castro, em sua obra, utilizou o ferro sem qualquer pintura ou proteção contra
corrosão, para que pudesse ser observada a ação do tempo sobre a mesma. Com base nos
conhecimentos sobre o tema, e correto afirmar:
a) O ferro presente na obra sofreu um processo de redução pelo ganho de elétrons.
b) O processo de deterioração e desacelerado pela ação da água proveniente da chuva.
c) A proteção do ferro (Fe3+ + 3e- → Fe, Eo= - 0,04 V) presente na obra poderia ser realizada
pela conexão desta com uma placa de cobre (Cu+ + e- → Cu, Eo= + 0,52 V).
d) O oxigênio atmosférico é fundamental no processo de corrosão do ferro.
e) Sob as mesmas condições, a corrosão é mais rápida em uma peça de ferro maciço do que
em uma de limalha, de mesma massa.
www.quimicaparaovestibular.com.br
[email protected]
3
Professora Sonia
10. (Unirio) Dispondo de soluções aquosas de CuSO4, MgCl2 e Pb(NO3)2 e também de placas
dos metais cobre, magnésio e chumbo, um estudante fez algumas experiências colocando as
placas metálicas em recipientes contendo essas soluções. Com os resultados, ele montou a
seguinte tabela:
Com base nas suas observações, o estudante chegou à conclusão de que a ordem decrescente
de reatividade entre esses metais é:
a) Mg > Pb > Cu
b) Mg > Cu > Pb
c) Cu > Pb > Mg
d) Cu > Mg > Pb
e) Pb > Cu > Mg
11. (Fuvest) Ferro zincado é ferro que contém pequena quantidade de zinco metálico.
A partir dos potenciais padrão de redução, listados a seguir, explique os seguintes fatos
observados no cotidiano:
a) Rebites de ferro em esquadrias de alumínio causam a corrosão do alumínio.
b) Pregos de ferro zincado são resistentes à ferrugem.
Redução
Fe
2+
+ 2e → Fe
2+
+ 2e − → Fe
Zn
−
A3 + + 3e − → A
Eo (volt)
- 0,440
- 0,763
- 1,663
12. (Fuvest) Panelas de alumínio são muito utilizadas no cozimento de alimentos. Os
potenciais de redução (Eo) indicam ser possível a reação deste metal com água. A não
ocorrência dessa reação é atribuída a presença de uma camada aderente e protetora de óxido
de alumínio formada na reação do metal com o oxigênio do ar.
a) Escreva a equação balanceada que representa a formação da camada protetora.
b) Com os dados de Eo, explique como foi feita a previsão de que o alumínio pode reagir com
água.
Dados:
www.quimicaparaovestibular.com.br
[email protected]
4
Professora Sonia
13. (Fuvest) Uma liga metálica, ao ser mergulhada em ácido clorídrico, pode permanecer
inalterada, sofrer dissolução parcial ou dissolução total. Qual das situações acima será
observada com a liga de cobre e zinco (latão)? Justifique utilizando as informações relativas
às semi-reações medidas em
Eo(Volt):
Eo = + 1,36
I. Cl2 + 2e- → 2Cl2+
o
II. Cu + 2e → Cu E = + 0,34
III. 2H+ + 2e- → H2 Eo = 0,00
IV. Zn2+ + 2e- → Zn Eo = - 0,76
14. (Fuvest) Semi-Reação
Fe2+ + 2 e- → Fe
(E° = - 0,41 V)
2+
Cu + 2 e → Cu
(E° = + 0,34 V)
O2 + 2H2O + 4 e-→ 4OH(E° = + 0,40)
A estátua da Liberdade está no porto de Nova Iorque e, portanto em ambiente marinho. Ela
consiste em uma estrutura de ferro sobre a qual estão rebitadas placas de cobre que dão
forma à figura.
a) Qual o efeito do ambiente marinho sobre as placas de cobre? Explique utilizando equações
químicas.
b) Por que não foi uma boa idéia ter cobre em contato com ferro? Justifique.
15. (Ufg)
Observando a tira, responda:
a) Após inúmeras chuvas, os cavaleiros ingleses terão dificuldade para abrir seus elmos de
ferro. Utilizando equações químicas, explique por quê.
b) Suponha a seguinte situação: o elmo de um dos cavaleiros, o suserano, é adornado com
rebites de ouro, enquanto o do outro, seu vassalo, com rebites de zinco. Curiosamente, após
inúmeras chuvas, um dos elmos emperra mais que o outro. Explique o porquê.
Potencial Padrão de Eletrodo
E = - 0,76 V
Zn2+ + 2e- Zn
2+
Fe + 2e Fe
E = - 0,44 V
3+
Au + 3e Au
E = + 1,50 V
16. (Ufmg) O ouro apresenta dois números de oxidação positivos comuns, 1+ e 3+. As forças
eletromotrizes de redução dessas espécies a ouro elementar são:
Au+(aq) + e- → Au(s)
Au3+(aq) + 3e- → Au(s)
∆E = 1,69 V
∆E = 1,50 V
Considere, ainda, as seguintes forças eletromotrizes de redução:
www.quimicaparaovestibular.com.br
[email protected]
5
Professora Sonia
2e-
2Cl-(aq)
Cl2(g) +
→
∆E = 1,36 V
F2(g) + 2e- → 2F-(aq)
∆E = 2,87 V
O2(g) + 4H+(aq) + 4e- → 2H2O(l)
∆E = 1,23 V
+
O3 + 2H (aq) + 2e- → O2(g) + H2O(l) ∆E = 2,08 V
1- JUSTIFIQUE, utilizando equações e cálculos eletroquímicos, o fato de o ouro metálico não
se oxidar a Au+ nem a Au3+ quando exposto ao ar.
2- INDIQUE, entre as espécies citadas no enunciado, uma que seja capaz de oxidar o ouro
metálico e Au+. JUSTIFIQUE sua resposta.
17. (Unesp) Encanamentos de ferro mergulhados em água sofrem corrosão, devido
principalmente à reação: Fe(s) + 2H+(aq) → Fe2+(aq) + H2(g).
Para proteger encanamentos nessas condições, costuma-se ligá-los a barras de outros metais,
que são corroídos ao invés dos canos de ferro. Conhecendo os potenciais padrões de redução
Eo= + 0,34 V
Cu2+ + 2e- Cu(s)
Fe2+ + 2e- Fe(s)
Eo= - 0,44 V
Eo= - 2,37 V
Mg2+ + 2e- Mg(s)
2H+ + 2e- H2(g)
Eo= 0,0 V
e dispondo-se de barras de magnésio e cobre, propõe-se:
a) Qual metal deve ser utilizado para proteger o encanamento? Justifique.
b) Escreva as reações que ocorrem na associação do cano de ferro com a barra metálica
escolhida, indicando o agente oxidante e o agente redutor.
18. (Unesp) Quando se coloca um pedaço de zinco metálico numa solução aquosa diluída de
cloreto de cobre (II), de cor azul, observa-se que a intensidade da cor da solução vai
diminuindo até se tornar incolor. Ao mesmo tempo, observa-se a deposição de cobre metálico
sobre o zinco metálico. Ao término da reação, constata-se que uma parte do zinco foi
consumida.
a) Explique o fenômeno observado. Escreva a equação química correspondente.
b) O que acontecerá quando um pedaço de cobre metálico for colocado em uma solução
aquosa de cloreto de zinco (II)? Justifique a resposta.
19. (Unesp) Mergulha-se uma lâmina limpa de níquel em uma solução azul de sulfato de
cobre. Observa-se que a lâmina fica recoberta por um depósito escuro e que, passado algum
tempo, a solução se torna verde. Explique o que ocorreu:
a) na lâmina de níquel;
b) na solução.
20. (Unesp) Mergulha-se uma placa limpa de zinco em uma solução azul de sulfato de cobre.
Observa-se que a placa fica coberta por um depósito escuro e que, passado algum tempo, a
solução se torna mais clara. Removido o depósito, contata-se que a placa se apresenta
corroída.
Explique o que ocorreu:
a) na placa de zinco;
b) na solução.
www.quimicaparaovestibular.com.br
[email protected]
6
Professora Sonia
21. (Unesp) A corrosão de ferro metálico envolve a formação envolve a formação de íons Fe2+.
Para evitá-la, chapas de ferro são recobertas por uma camada de outro metal. Em latas de
alimentos a camada é de estanho metálico e em canos d'água, de zinco metálico.
Explique por que:
a) a camada de zinco evita a corrosão de canos d'água;
b) quando a camada de estanho é danificada, expondo a camada do ferro, a corrosão
acontece mais rapidamente do que quando a referida camada está ausente.
Dados: Potenciais padrões de redução a 25 °C.
Zn2+ + 2e- → Zn(s) Eo = - 0,763 V
Fe2+ + 2e- → Fe(s) Eo = - 0,409 V
Sn2+ + 2e- → Sn(s) Eo = - 0,136 V
respostas
01. D
02. C
03. E
04. A
05. A
06. D
07. D
08. A
09. D
10. A
11. a) Porque o potencial de oxidação do alumínio é maior que o do ferro.
b) Porque o zinco oxida-se protegendo o ferro da corrosão.
12. a) 4 Al(s) + 3O2(g) → 2Al2O3(s) [camada protetora].
b) A reação ocorre espontaneamente no sentido do valor positivo do ∆Eo, logo o alumínio
reage com a água.
13. O latão (Cu/Zn) sofre dissolução parcial, pois somente o zinco reduz o H+ a H2.
14. a) Após a montagem da estátua havia um bom contato elétrico entre as placas de cobre e
a estrutura de ferro, através de rebites metálicos. Assim o ferro agiria como ânodo de
sacrifício neutralizando de forma parcial a ação do ambiente marinho sobre as placas de
cobre.
I) cátodo:
+ 0,40 V (redução)
O2 + 2H2O + 4e- → 4OHII) ânodo:
2Cu → 2Cu2+ + 4e- 0,34 V (oxidação)
Somando-se (I) e (II), temos:
O2 + 2H2O + 2Cu → 2 Cu2+ + 2OH+ 0,06 V
A ação do ambiente marinho sobre as placas de cobre é neutralizada com o estabelecimento
da pilha eletroquímica Cu2+/Cuo//Feo/Fe2+ onde o ferro age como ânodo de sacrifício:
(I) cátodo: Cu2+ + 2 e- → Cuo
+ 0,34 V
(II) ânodo: Fe → Fe2+ + 2 e+ 0,41 V
Somando-se (I) e (II), temos:
Cu2+ + Feo → Fe2+ + Cuo
+ 0,75 V
Com o passar dos anos, o contato elétrico entre as placas de cobre e a estrutura de ferro,
através dos rebites, foi diminuindo devido à corrosão dos rebites e o efeito da proteção
catódica criado pela pilha acima se reduziu.
15. a) Porque o ferro oxida, reagindo com o oxigênio do ar, em ambiente úmido.
4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s)
www.quimicaparaovestibular.com.br
[email protected]
7
Professora Sonia
b) O elmo que emperra mais é o do suserano, já que o potencial padrão do ouro é de + 1,50 V;
assim, o ferro oxida preferencialmente. Como o PPE do zinco é de - 0,76 V, ele oxidará,
preferencialmente, em relação ao ferro.
16. 1) O oxigênio tem maior tendência para se oxidar que o ouro (E real do ouro é maior).
2) O F2 é capaz de oxidar o ouro, pois tem maior E real.
17. a) O magnésio, por possuir potencial de oxidação maior que o do ferro.
b) Fe2+ + Mgo → Feo + Mg2+
Oxidante: Fe2+.
Redutor: Mgo.
18. a) Zno(s) + Cu2+(aq) → Zn2+(aq) + Cuo(s).
A cor azul é conseqüência da presença dos íons Cu2+(aq) que são consumidos tornando a
solução incolor.
b) Não ocorrerá reação química.
19. a) Ni desloca o Cuo da solução de CuSO4:
Nio + Cu2+ → Ni2+ + Cuo
o
b) Ni + Cu2+ (azul) → Ni2+ (verde) + Cuo.
20. a) O depósito escuro se dá pela formação de cobre metálico, pois o zinco possui maior
potencial de oxidação e fará com que o íon cobre sofra redução:
b) Como os íons Cu2+ sofrem redução haverá a diminuição destes íons e aumentando o
número de íons Zn2+ incolor, tornando a solução mais clara.
21. a) no cano a proteção é eletroquímica (zinco se oxida e não o ferro).
b) o estanho tem maior potencial de redução, na lata a proteção de estanho evita contato com
O2 do ar.
www.quimicaparaovestibular.com.br
[email protected]
8