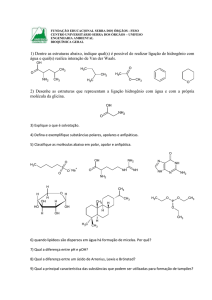
Conj.
PF – 4o
Código
Q24
Período
T
Turma
C
Data
25/11/04
1. A tabela a seguir apresenta dados sobre a solubilidade de algumas substâncias para cada
100 mL de água a 25ºC.
Substância
Solubilidade
AgNO3
260 g
Al2(SO4)3
160 g
NaCl
36 g
KNO3
52 g
KBr
64 g
Caso sejam retirados 20 mL de uma solução saturada de uma dessas substâncias com
posterior vaporização completa do solvente e obtidos 10,4 g de sólido, pode-se concluir que o
soluto corresponde a:
a) AgNO3.
b) Al2(SO4)3.
c) NaCl .
d) KNO3.
e) KBr.
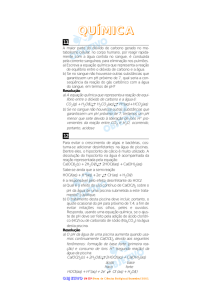
2. O gráfico a seguir apresenta a variação da solubilidade (S) do sólido dicromato de potássio,
K2Cr2O7, em água, em função da temperatura (t).
Considere uma mistura constituída de 10 g de K2Cr2O7 e 50 g de água, a uma temperatura
inicial de 70ºC. Sabendo que se desejava obter o sólido K2Cr2O7, este sistema foi resfriado
lentamente e com agitação até o início de sua cristalização (precipitação). A qual temperatura
aproximada deve começar a cristalizar o sólido K2Cr2O7?
a) 20ºC.
b) 30ºC.
c) 40ºC.
d) 50ºC.
e) 60ºC.
3. Entre os sistemas saturados cromato de bário (Ks = 8,5.10-11 mol2L-2), cianeto de prata (Ks
= 1,6.10-14 mol2L-2), sulfato de bário (Ks = 1,5.10-9 mol2L-2), cloreto de prata (Ks = 2,8.10-10
mol2L-2) e brometo de prata (Ks = 5,0.10-13 mol2L-2), o sal mais solúvel em água é:
a) BaCrO4.
b)
c)
d)
e)
AgCN.
BaSO4.
AgCl.
AgBr.
4. O “éter sulfúrico” é obtido industrialmente pela desidratação do etanol, em presença de
H2SO4 . A mesma reação, ocorrendo em temperaturas mais elevadas, produz o alceno
correspondente. O éter e o alceno têm, respectivamente, as fórmulas:
a) H3C – CH2 – O – CH2 – CH3
b) H3C – O – CH3
e
C2H6
c) H3C – C – CH3
e
CH4
e
C2H4
||
O
d) H3C – C = O
e
C2H2
H
e) H3C – C = O
e
C6H6
OH
5. Dentre as fórmulas a seguir, a alternativa que apresenta um álcool terciário é:
a) CH3 – CH2 – CHO
b) (CH3)3C – CH2OH
c) (CH3)3COH
d) CH3 – CH2 – CH2OH
e) CH3 – CH(OH) – CH3
6. Da nitração
HNO3 (conc.) + H2SO4 (conc.) a 30 ºC
de um certo derivado do benzeno equacionada por
A
A
+ NO2+
NO2
fazem-se as seguintes afirmações :
I.
o grupo A é ortoparadirigente
II.
o grupo A é metadirigente
III.
ocorre reação de substituição eletrófila
IV.
ocorre reação de adição nucleófila
V.
ocorre reação de eliminação
São corretas as afirmações:
a) I e IV
b) II e III
c) II e IV
d) I e III
e) II e V
7. A reação que se processa no ânodo, na eletrólise de uma solução aquosa de cloreto de
sódio( NaCl), é :
a) Na+ + e- Na
b) 2H2O + 2e- H2 + 2OHc) 2H+ + 2e- H2
d) 2Cl- Cl2 + 2ee) 2Cl- + 2H2O H2 + Cl2 + 2OH8. Em relação à eletrólise de uma solução aquosa concentrada de CuCl2 , qual a afirmativa
errada ?
a) Há deposição de cobre metálico no eletrodo negativo.
b) Há formação de cloro gasoso no eletrodo positivo.
c) Os íons Cu2+ são reduzidos.
d) Os íons Cl- são oxidados.
e) A reação que se passa na eletrólise pode ser representada pela equação
Cu + Cl2 Cu2+ + 2Cl-.
9. Os números de oxidação(nox) do fósforo nas espécies PCl3 , PCl5 e H3PO4
respectivamente :
a)+3, +5, +5
b)+3, +3, +5
c)-3, +5, +5
d)-3, +5, -6
e)+3, +3, -6
valem,
10. As + HNO3 + H2O H3AsO4 + NO
Após o balanceamento da equação acima, a soma dos menores coeficientes inteiros vale:
a)15
b)16
c)17
d)18
e)19
Dados para as questões 7 e 8 :
2H+(aq) + 2e- H2(g)
Cátodo
Redução
2H2O(l) + 2e- H2(g) + 2OH-(aq)
2OH-(aq) 2e- + 1/2O2(g) + H2O(l)
Ânodo
Oxidação
H2O(l) 2e- + 1/2O2(g) + 2H+(aq)
H2O
(1A ), (2A ),Al , etc. ou
H+
3+
Zn2+ , Cu2+, Ag+ , Au3+, etc.
FACILIDADE DE DESCARGA
CO32- , SO42- , NO3- , etc.
H2O
ou
OH-
Cl- , Br-, I- , etc.