
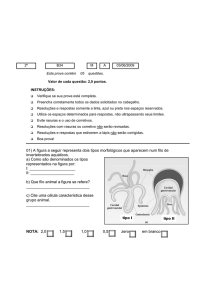
Q – 21
4°
Esta prova contém
T
5
C
03/11/10
questões.
INSTRUÇÕES:
Verifique se sua prova está completa.
Preencha corretamente todos os dados solicitados no cabeçalho.
Resoluções e respostas somente a tinta, azul ou preta.
Utilize os espaços determinados para respostas, não ultrapassando seus limites.
Evite rasuras e o uso de corretivos.
Resoluções com rasuras ou corretivo não serão revisadas.
Resoluções e respostas que estiverem a lápis não serão corrigidas.
Cada questão vale 2,0 (dois) pontos. Boa prova!
01) (FUVEST) Panelas de alumínio são muito utilizadas no cozimento de alimentos. Os potenciais de
redução (Eo) indicam ser possível a reação deste metal com água. A não ocorrência dessa reação é
atribuída a presença de uma camada aderente e protetora de óxido de alumínio formada na reação do
metal com o oxigênio do ar.
a) Escreva a equação balanceada que representa a formação da camada protetora. 1,0 (um) ponto.
b) Com os dados de Eo, explique como foi feita a previsão de que o alumínio pode reagir com água.
Dados:
A3+(aq) + 3eˉ A(s)
E° = -1,66V
2H2O + 2eˉ H2 + 2OHˉ
E° = -0,83V
02) (UNIFESP) A uma solução aquosa contendo KI suficiente para tornar o meio condutor, foram
adicionadas algumas gotas do indicador fenolftaleína. A solução resultante foi eletrolisada com
eletrodos inertes, no dispositivo esquematizado a seguir.
a) equacione as semi-reações que ocorrem no cátodo e no ânodo, bem como a equação global do
processo, representando a formação do KOH.
b) identifique os pólos de cada eletrodo e indique em qual deles ocorre o processo de oxidação e em
qual ocorre o processo de redução.
03) (UFPE) O desenvolvimento de novas baterias recarregáveis é importante para a
miniaturização de equipamentos portáteis (celulares) e médicos (marca-passos). A escolha
dos materiais ativos destas baterias envolve inúmeras variáveis, como, diferença de
potencial gerada, toxicidade, custo etc. Considere o esquema de uma pilha apresentado a
seguir e os dados de potenciais padrão de eletrodos (Eo), a seguir:
Semi-reação
Ag+(aq) + e‾→ Ag(s)
E°( (V) = +0,80
2+
Cu (aq) + 2e‾ → Cu(s)
E°(V) = +0,34
2H+(aq) + 2e‾ → H2(g)
E°(V) = 0,00
Pb2+(aq) + 2e‾ → Pb(s)
E°(V) = - 0,13
Sn2+(aq) + 2e‾ → Sn(s)
E°(V) = - 0,14
Zn2+(aq) + 2e‾ → Zn(s)
E¡(V) = - 0,76
3+
A (aq) + 3e‾ → A(s)
E°(V) = - 1,66
Mg2+(aq) + 2e‾→ Mg(s)
E°(V) = - 2,36
Considere as afirmações abaixo e assinale (V) para verdadeiro ou (F) para falso:
( ) quando M = Zn(s), o alumínio se reduzirá
( ) quando M = Ag(s), o voltímetro marcará o valor 0,86V
( ) quando M = Mg(s), ocorrerá um fluxo de elétrons do eletrodo de Mg para o de A
( ) quando M = Pb(s), o eletrodo de Pb será consumido
04) (VUNESP) A corrosão de ferro metálico envolve a formação de íons Fe2+. Para evitá-la, chapas de
ferro são recobertas por uma camada de outro metal. Em latas de alimentos a camada é de estanho
metálico e em canos d'água, de zinco metálico.
Dados: Potenciais padrões de redução a 25°C.
Zn2+ + 2e‾ →Zn(s) E°= – 0,763V
Fe2+ + 2e‾ →Fe(s) E°= – 0,409V
Sn2+ + 2e‾ →Sn(s) E°= – 0,136V
Explique por que:
a) a camada de zinco evita a corrosão de canos d'água;
b) quando a camada de estanho é danificada, expondo a camada do ferro, a corrosão acontece mais
rapidamente do que quando a referida camada está ausente.
05) Escreva as semi-reações e a reação global da eletrólise ígnea do KBr(s).
Boa Prova!!!
Prof. Fernandes






![01) [2,0 pontos] Mostre que o quociente de um número racional não](http://s1.studylibpt.com/store/data/001238402_1-36affce4aec8b9f2f813dc4839ba1610-300x300.png)

![01. (UNICAMP) “Tuvalu [no Oceano Pacífico] é o primeiro país](http://s1.studylibpt.com/store/data/001300997_1-d557355d4029a54f8cffa0cd9b845106-300x300.png)


![01) [2,0 pontos] Um químico preparou uma solução de ácido](http://s1.studylibpt.com/store/data/003419929_1-555a5987aa44b9cde6a8c3035ffb0662-300x300.png)