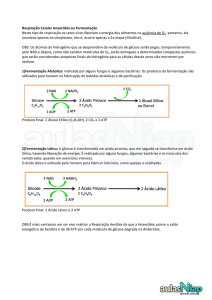
Influência da fonte de carbono e da
temperatura sobre a fermentação
lática desenvolvida por cultura mista
de bactérias láticas1
Rosicler BALDUINO2, Antonio Sérgio de
OLIVEIRA2, Maria Celia de Oliveira HAULY2,*
RESUMO
Bactérias ácido láticas vêm sendo aplicadas em
produtos cárneos como culturas iniciadoras. A
finalidade das culturas iniciadoras em produtos
cárneos é reduzir o pH no início da
fermentação O que contribui na inibição de
microrganismos indesejáveis, melhorar as
propriedades sensoriais, reduzir o tempo de
maturação e reduzir nitratos e nitritos. A
composição do meio, assim como as condições
de cultivo, são importantes para o bom
desenvolvimento da cultura iniciadora, sendo
necessário conhecer a influência da fonte de
carbono e da temperatura no processo
fermentativo. O objetivo deste trabalho foi
estudar os efeitos da temperatura e de
diferentes concentrações de glicose e lactose
sobre a fermentação lática desenvolvida em
caldo MRS (Man-Rogosa-Sharpe) pela cultura
mista constituída de L. curvatus, L. plantarum,
P. acidilactici e E. faecium. O caldo MRS foi
suplementado com glicose e lactose, e as
temperaturas de fermentação foram de 28ºC,
37ºC e 46ºC. Os ensaios foram delineados por
desenho fatorial incompleto de 33. Através da
Superfície de Resposta, o modelo matemático
mostrou que o caldo MRS suplementado de
glicose 4,5% (m/v) e lactose 0,5% (m/v) e
temperatura de incubação de 46ºC foram as
condições mais adequadas para obtenção de
ácido lático. A fermentação lática desenvolvida
pela cultura mista, durante 48 horas nestas
condições, forneceu em média 4,78% de ácido
lático sendo a viabilidade celular de
1x1015UFC/mL.
Palavras-chave: bactérias ácido láticas, fonte
de carbono, temperatura, cultura iniciadora,
produto cárneo.
SUMMARY
Influence of the carbon source and
temperature on the lactic acid fermentation
developed by starter cultures. Lactic acid
bacteria has been used in meat products as
starter culture. The purpose of the starter
culture in meat products is to reduce the pH in
the begining of fermentation in order to inhibit
undesirable microorganisms, to improve
sensorial properties, to reduce the time of
maturation and to reduce nitrates and nitrites.
The composition of the medium as well as the
culture conditions are essential for good
growth of the starter culture, being of
fundamental importance to know the influence
of the carbon source and the temperature in the
fermentative process. This work evaluated the
influence of temperature and different
concentrations of glicose and lactose on the
lactic fermentation in MRS (Man-RogosaSharpe) broth by a starter culture mixture
containing L. curvatus, L. plantarum, P.
acidilactici and E. faecium. This mixture
shows potential application as starter culture in
meat products. The MRS medium was
supplemented with glicose and lactose and the
various treatments submitted to temperatures
of 28ºC, 37ºC and 46ºC, according to Surface
Response Methodology through an incomplete
fatorial of 33 experimental design. The
evaluated response was the lactic acid
produced, determined by HPLC. Mathematical
models have showed that 4.5% glicose, 0.5%
lactose and 46ºC were the best conditions for
lactic acid production. The lactic acid
fermentation, carried out by the mixed culture
in 48 hours under these conditions, produced,
in average, 4.78% of lactic acid and cellular
viability of 1x1015CFU/mL.
Keywords: lactic acid bacteria, carbon source,
temperature, starter culture, meat product.
1 – INTRODUÇÃO
As bactérias ácido láticas têm sido empregadas na indústria de
produtos cárneos como culturas iniciadoras para acelerar o
processo de maturação, visto que dominam o processo
fermentativo fornecendo produtos com boa qualidade sanitária
e características sensoriais adequadas [7]. As culturas
iniciadoras podem produzir ácido lático logo no início da
fermentação, o que diminui o valor de pH que pode inibir
microrganismos indesejáveis como Salmonella spp., Yersínia
enterocolítica, Escherichia coli enteropatogênica e
Campylobacter jejuni, além de conferir o sabor ácido
característico de produtos fermentados [14]. O ácido lático é
muitas vezes utilizado como aditivo, nas formas de lactato de
sódio ou potássio, sendo um agente acidulante e flavorizante
[4]. Além disso, as bactérias ácido láticas, dependendo das
condições de cultivo e da espécie, podem produzir substâncias
antimicrobianas, como bacteriocinas [5, 8, 11], conferindo aos
produtos maturados e frescais, melhor qualidade sanitária.
Conforme descrito por TONI et al. [17] e ANJOS &
RIBEIRO [1], a utilização de nitratos e nitritos em produtos
cárneos para manter a cor vermelha e inibir o
desenvolvimento de Clostridium botulinum pode levar à
formação de nitrosaminas que são substâncias carcinogênicas.
As bactérias ácido láticas podem atuar na redução destas
substâncias até nitrogênio elementar [7], diminuindo assim a
formação das nitrosaminas.
As cepas utilizadas, as condições de cultivo e a formulação do
meio interferem no desenvolvimento da fermentação lática [2,
3, 12, 13]. Carboidratos fermentescíveis são por vezes
adicionados à carne para diminuir rapidamente o valor de pH,
sendo necessário conhecer a influência destes na fermentação
desenvolvida pelas bactérias ácido láticas. Para o cultivo de
Lactobacillus, normalmente se utiliza glicose ou sacarose
como fontes de carbono. Entretanto, a lactose é igualmente
adicionada como agente ligante da água para melhorar o
processo de maturação e a textura de produtos cárneos
fermentados [9, 16, 18]. O objetivo deste trabalho foi avaliar
os efeitos das concentrações de glicose e lactose e das
temperaturas de fermentação na produção de ácido lático pela
cultura mista de L. curvatus, L. plantarum, P. acidilactici e E.
faecium.
2 – MATERIAIS E MÉTODOS
2.1 – Materiais
2.1.1 - Microrganismos
Os microrganismos Lactobacillus plantarum e Pediococcus
acidilactici foram obtidos da Fundação Tropical de Pesquisa e
Tecnologia "André Tosello", Campinas – SP.
Lactobacillus curvatus foi isolado de silagem de milho por
OLIVEIRA [10].
Enterococcus faecium foi isolado de embutido cárneo
fermentado (salame) pela técnica de esgotamento em estrias
em ágar MRS. O perfil bioquímico e idenficação a nível de
espécie foi realizado pela Fundação Tropical de Pesquisa e
Tecnologia "André Tosello", Campinas – SP.
2.1.2 - Meios de cultivo
●
As culturas foram mantidas em leite em pó reconstituído
em água na concentração de 11% (m/v).
caldo MRS (Man-Rogosa-Sharpe) foi suplementado
com diferentes concentrações de glicose e lactose,
conforme indicado pelo delineamento estatístico da
Metodologia da Superfície de Resposta.
2.2 – Métodos
2.2.1 - Processo fermentativo
Os microrganismos foram ativados por meio de repiques
sucessivos realizados a cada 24 horas em leite em pó
reconstituído em água. As culturas de bactérias láticas L.
curvatus, L. plantarum, P. acidilactici e E. faecium foram
associadas na proporção de 1:1:1:1. O inóculo de 10% (v/v)
foi transferido para o caldo MRS suplementado com glicose e
lactose e incubado às temperaturas de 28ºC, 37oC e 46ºC por
48 horas, sem agitação. O valor de pH inicial do meio foi
ajustado para 6,2 com NaOH 1N. Após o desenvolvimento do
processo fermentativo, o caldo fermentado foi centrifugado a
2000xg durante 10 minutos e submetido à determinação de
ácido lático.
2.2.2 - Viabilidade celular
A viabilidade celular foi determinada através da técnica de
semeadura em profundidade [6], utilizando-se ágar MRS. As
placas foram mantidas em estufa a 37ºC durante 48 horas.
2.2.3 - Dosagem de ácido lático
O ácido lático foi extraído do caldo fermentado utilizando-se
BaCl2.2H2O 9,88%, NaOH 0,66N e ZnSO4.7H2O, conforme
SILVA [15]. O padrão utilizado para curva de referência foi o
lactato de lítio 1% (m/v), extraído nas mesmas condições.
Para determinação do ácido lático por Cromatografia Líquida
de Alta Eficiência (CLAE) utilizou-se uma coluna Aminex
HPX - 87H (300mm x 7,8mm ∅ ), específica para análise de
ácidos orgânicos e pré-coluna contendo a mesma resina de
●
exclusão iônica. A fase móvel constituída de H2SO4 5x103mol
L-1 foi mantida sob o fluxo de 0,6mL min-1. A temperatura
do sistema foi mantida a 35ºC e a pressão foi de 52mmHg. Para injeção no
cromatógrafo, o extrato obtido conforme SILVA [15] foi filtrado em
membrana Millipore 0,45µm. O volume de injeção foi de 20µL. O
comprimento de onda de 210nm foi utilizado para o detector
UV-Vis. O padrão interno constituía-se de uma mistura de
ácidos orgânicos, como ácido oxálico, acético, cítrico, málico,
succínico e fórmico. Padrões de ácido lático nas
concentrações de 2,08x10-2mol L-1; 4,17x10-2mol L-1;
6,25x10-2mol L-1 foram utilizados na curva de referência para
cálculo da concentração das amostras.
2.2.4 - Metodologia da Superfície de Resposta.
Para melhorar a produção de ácido lático pela cultura lática
mista através da Metodologia da Superfície de Resposta,
foram investigadas a temperatura de fermentação e duas
fontes de carbono, glicose e lactose. As 3 variáveis
independentes, temperatura, glicose e lactose, representados
por X1, X2 e X3, respectivamente, foram avaliadas em três
níveis eqüidistantes de variação, através do desenho fatorial
incompleto de 33. A resposta avaliada foi a produção de ácido
lático, variável dependente. A Tabela 1 mostra as variáveis
independentes e os níveis de variação.
3 – RESULTADOS E DISCUSSÃO
A Tabela 2 mostra o delineamento estatístico utilizado e a
produção de ácido lático pela cultura lática mista cultivada
nas diferentes condições. O melhor resultado experimental,
3,55% de ácido lático foi obtido no tratamento nº 6:
temperatura de 46ºC; 2,5% (m/v) de glicose e 0,5% (m/v) de
lactose. A condição menos adequada para produção de ácido
lático foi obtida no tratamento nº 9: temperatura de 37ºC,
0,5% (m/v) de glicose e 0,5% (m/v) de lactose. Os resultados
estão de acordo com SAMOYLENKO et al. [13], que afirmou
que a composição do meio de cultivo com relação à natureza
química da fonte de carbono, bem como a concentração e a
temperatura de fermentação, são importantes para a produção
de ácido lático.
A Tabela 3 mostra os coeficientes de regressão para as
respostas polinomiais ajustadas para a produção de ácido
lático. Os resultados mostram que o intercepto foi
significativo, ao nível de 0,01%, demonstrando que o ponto
central foi escolhido adequadamente. O parâmetro estimado
(0,34125000), relativo ao efeito linear da glicose, mostrou-se
significativo ao nível de 0,01%, indicando a relevância desta
variável na obtenção de ácido lático. Sugere-se utilizar o valor
mais próximo do limite superior para a glicose, indicado na
Tabela 1.
O parâmetro estimado para BC (Tabela 3) foi significativo ao
nível de 0,02%. Portanto, sugere-se utilizar a mistura glicose e
lactose como fontes de carbono para produção de ácido lático
pela cultura lática mista. Na prática, a utilização de lactose
pode diminuir o custo da fermentação, uma vez que pode ser
utilizado o soro de leite, resíduo da indústria de laticínios, que
contém lactose. Entretanto, a Tabela 3 mostra que o
parâmetro estimado, pelo modelo, para glicose e lactose (BC)
foi negativo. Portanto, sugere-se usar lactose em baixa
concentração, ou seja, a mais próxima possível do limite
inferior, indicado na Tabela 1, em associação à glicose para
boa produção de ácido lático. O uso da lactose em produtos
cárneos maturados pode ser vantajoso, visto que auxilia na
textura e serve como substrato para fermentação desenvolvida
pelas culturas iniciadoras [9], além de diminuir os custos, já
que faz parte da composição do soro de leite que é um resíduo
agroindustrial.
O parâmetro estimado para AB (Tabela 3) foi significativo ao
nível de 3,8% indicando que o uso da temperatura no valor
mais próximo do limite superior mostrado na Tabela 1,
associada a mais alta concentração de glicose, poderá
melhorar a produção de ácido lático.
A análise de variância dos resultados da fermentação lática
desenvolvida pela cultura lática mista está indicada na Tabela
4. Para a resposta avaliada, ácido lático em %, observa-se que
a regressão não foi significativa a nível de 5%. A falta de
ajuste também não foi significativa, o que permite a utilização
do modelo matemático, equação de regressão fornecida pela
Metodologia da Superfície de Resposta.
O modelo matemático indica que para melhor produção de
ácido lático pela cultura lática mista, a fermentação deve ser
realizada utilizando-se valores máximos para temperatura e
concentração de glicose e o mínimo de lactose ou seja, 46ºC;
glicose 4,5% (m/v) e lactose 0,5% (m/v). A fermentação lática
desenvolvida nestas condições produziu, em média, 4,78% de
ácido lático, indicando que o modelo foi adequado.
A viabilidade celular é um parâmetro importante quando se
pretende utilizar a cultura lática como cultura iniciadora. Nas
condições indicadas pelo modelo matemático, obteve-se
1x1015UFC/mL demonstrando o potencial de aplicação da
cultura lática mista como cultura iniciadora.
A Figura 1 mostra o mapa da Superfície de Resposta obtido
pela equação do modelo ajustado, fixando-se a variável X3 no
nível –1, correspondente a lactose 0,5% (m/v). Observa-se na
Figura 1 que alto teor de ácido lático (> 4,8%), pode ser
obtido utilizando-se glicose (X2) e temperatura (X1) nos
níveis máximos, ou seja, glicose 4,5% (m/v) e 46 ºC.
4 – CONCLUSÃO
●
O modelo matemático obtido pela Metodologia da
Superfície de Resposta indicou que a temperatura de
46ºC, glicose 4,5% (m/v) e lactose 0,5% (m/v) são as
condições mais adequadas para produção de ácido lático
pela cultura lática mista em caldo MRS, durante 48
horas. A fermentação realizada nestas condições
produziu 4,78% de ácido lático mostrando que o modelo
foi adequado para estimar a produção de ácido lático. A
viabilidade celular,sob estas condições, foi de
1x1015UFC/mL.
5 – REFERÊNCIAS BIBLIOGRÁFICAS
[1] ANJOS, A. C.; RIBEIRO, P. O Nitrito em Carnes
Curadas: Vantagens, Desvantagens e Recursos Tecnológicos
para Reduzir os Níveis de Nitrosaminas no Bacon. Higiene
Alimentar, v. 8, n. 29, p. 8-13, fev. 1994.
[2] CHAGAS, S. S.; TERRA, N. N.; VALENTE, C. R.;
COSTA, C. M. Influência dos Microelementos Manganês e
Magnésio na Estimulação da Fermentação Cárnea. Revista
Nacional da Carne, n. 251, p. 44-47, jan., 1998.
[3] COVENTRY, J.; HICKEY, M. W. Growth Characteristics
of Meat Starter Cultures. Meat Science, v. 30, p. 41-48, 1991.
[4] DAVIDSON, P. M.; JUNEJA, V. K. Antimicrobial
Agents. In: BRANEN, A. L.; DAVIDSON, P. M.;
SALMINEN, S. Food Additives. New York: Marcel Dekker,
1989. Cap. 4, p. 83-137.
[5] HURST, A.; HOOVER, D. G. Nisin. In: DAVIDSON, P.
M.; BRANEN, A. L. Antimicrobials in Foods. 2. ed. New
York: Marcel Dekker, 1993. Cap. 10, p. 369-394.
[6] LANARA (Laboratório Nacional de Referência Animal).
Métodos Analíticos Oficiais para Controle de Produtos de
Origem Animal e seus Ingredientes. Brasília:Mistério da
Agricultura ,1981. v. 1, Métodos Microbiológicos.
[7] LIEPE, H-U. Starter Cultures in Meat Production. In:
REHM, H. J.; REED, G. Biotechnology. Flórida:
Verlagchemie, 1983. v. 5. Cap. 8, p. 399-420.
[8] MARTINIS, E. C. P.; FRANCO, B. D. G. M. Inhibition of
Foodborne Pathogens by Bacteriocin-Producing Leuconostoc
sp and Lactobacillus sake Isolated from "Lingüiça Frescal".
Revista de Microbiologia, v. 28, p. 284-287, 1997.
[9] OBST, M.; HEHN, R.; VOGEL, R. F.; HAMMES, W. P.
Lactose Metabolism in Lactobacillus curvatus and
Lactobacillus sake. FEMS Microbiology Letters, v. 97, p.
209-214, 1992.
[10] OLIVEIRA, A. S. Desenvolvimento de Inoculante para
Fermentação Lática de Silagens: utilização de resíduos
agroindustriais. Londrina, 1995.127p. Tese (Doutorado em
Ciências de Alimentos) - Departamento de Tecnologia de
Alimentos e Medicamentos, Universidade Estadual de
Londrina (UEL).
[11] PINTO, M. F.; PONSANO, E. H. G.; CASTROGOMEZ, R. J. Antibiose Relacionada a Cultivo de
Lactobacillus acidophilus. 2. Otimização de alguns
parâmetros de cultivo em Meio à Base de Soro de Queijo e
Extrato Aquoso de Soja. Arquivos de Biologia e Tecnologia,
v. 39, n. 2, p. 259-270, jun.1996.
[12] RACCACH, M. Some Aspects of Meat Fermentation.
Food Microbiology, v. 9, p. 55-65, 1992.
[13] SAMOYLENKO, V. A.; YAKSHINA, T. V.;
OLEYNIKOV, R. R.; KOSTENKO, Yu. G.; SPICYNA, D.
N.; SOLODOVNIKOVA, G. I.; KUZNETSOVA, G. A.
Development of Pilot-Scale Production of Dry Bacterial
Starter Cultures for Intensive Manufacture of High Quality
Meat Products. Process Biochemistry, v. 32, n. 3, p. 191-194,
1997.
[14] SMULDERS, F. J. M.; BARENDSEN, P; VAN
LOGTESTIJN, J. G.; MOSSEL, D. A. A.; van der MAREL,
G. M. Review: Lactic Acid: Considerations in Favour of its
Acceptance as a Meat Decontaminant. Journal of Food
Technology, v. 21, p. 419-436, 1986.
[15] SILVA, D. J. Determinação do pH,da acidez titulável e
do ácido lático da silagem. In: SILVA, D.J.ANÁLISE DE
ALIMENTOS (Métodos Químicos e Biológicos). Viçosa:
Universidade Federal de Viçosa/Imprensa Universitária, 1981.
Cap. 14, p. 110-114.
[16] TERRA, N. N. Princípios de Fermentação de Produtos
Cárneos (Culturas "Starter"). Revista Nacional da Carne, n.
19, p. 35-37, jan., 1993.
[17] TONI, C. H. De; TONI Jr., C. De; SANT’ANNA, E. S.;
OGLIARI, P. J. Uso de Bactérias Láticas e seus Efeitos nas
Variações do pH de Nitrito Durante a Maturação do Salame
Tipo Italiano. Boletim da Sociedade Brasileira de Ciência e
Tecnologia de Alimentos, v. 28, n. 1, p. 1-9, jan/jun. 1994.
[18] VOGEL, R. F.; POHLE, B. S.; TICHACZEK, P. S.;
HAMMES, W. P.; The Competitive Advantage of
Lactobacillus curvatus LTH1174 in Sausage Fermentations is
Caused by Formation of Curvacina A. Systematic Applied
Microbiology, v. 16, p. 457-462, 1993.
6 – AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e
Tecnológico-CNPq e à Coordenadoria de Pesquisa e PósGraduação da Universidade Estadual de Londrina-CPG/UEL,
pelo apoio financeiro.
1
Recebido para publicação em 05/01/99. Aceito para
publicação em 09/11/99.
2 UEL - Depto. de Bioquímica. Cx. Postal 6001, CEP 86051970, PR. E-mail: [email protected]
* A quem a correspondência deve ser enviada.