Titulações Ácido-Base
Titulações de Neutralização
Reacções de neutralização
Métodos quantitativos
Doseamentos
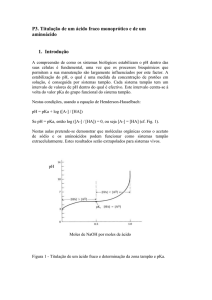
Medição de pH e uso de indicadores
Soluções tampão
No ponto de meia titulação ⇒ pH = pKa e
consoante o pKa aumenta ou diminui …..
Excesso de OH−
Ca ≈ [A−] ≈ [Na+]
Quando o ácido é mais
fraco ou mais diluído,
O ponto de inflexão
fica menos nítido.
Curvas calculadas referentes à
titulação de 50 mL de HA 0,020 M
com NaOH 0,100 M.
Curvas calculadas referentes à titulação
de 50,00 mL de HA (pKa =5) com NaOH
cuja concentração é 5 vezes maior que
a concentração do HA.
Determinar o p.e. com um eléctrodo de pH
Medindo o pH da solução durante a titulação podemos construir a curva
de titulação experimental e calcular o p.e. pelo ponto de inflexão da curva
Quando se pretende maior precisão usam-se derivadas para
encontrar o p.e.
O p.e.é o volume onde o declive (1ª derivada, dpH/dV)
da curva de titulação é maior
O p.e. é o volume onde a 2ª derivada (d(dpH/dV)/dV) é zero
Ácidos e bases polipróticos
Exemplo:
Considerar o caso de um ácido diprótico H2A, com constantes
de acidez Ka1 e Ka2
H 2A
HA− + H+
HA−
A2− + H+
Balanço de massas:
Ca = [H2A] + [HA−] + [A2−]
Balanço de cargas:
[H+] = [OH−] + [HA−] + 2 [A2−]
Kw
Têm-se 5 equações e 5 incógnitas
Titulação do ácido H2A com NaOH
20 mL de ácido
H2A (0.100 M)
Ka1=1,0x10-3
Ka2=1,0x10-7
Anfólito
Caso do ácido fosfórico (H3A): se a concentração do não for
muito baixa e os pKan forem suficientemente diferentes:
pKa1= 2.15
pKa2 = 7.15
pKa3 = 12.40
pH2 ≈ ½ ( pKa2 + pKa3 )
= 9.80
pH1 ≈ ½ ( pKa1 + pKa2 )
= 4.63
Espécies em cada zona …e
comparar com ácido H2A
Especiação do ácido fosfórico (H3PO4) em função do pH
Ca = [H3A] + [H2A] + [HA−] + [A2−]
pKa1
pKa2
pKa3
Método visual com indicadores químicos
Os indicadores ácido-base compostos orgânicos cuja cor depende
do pH da solução em que se encontram dissolvidos.
Os indicadores comportam-se como ácidos ou bases fracas e o
equilíbrio entre a forma ácida (Hlnd) e a forma básica (Ind−):
HInd Ind− + H+
Cor da forma ácida
Cor da forma básica
Fenolftaleína
HInd
KInd
Ka do indicador
+ H3O+
Ind−
+
H3O+
Não considerando coeficientes de
actividade – K’Ind
Constante aparente do indicador
Tomando logarítmos:
Se pH = pKInd
→ Ponto teórico de viragem do indicador
→
Predomina a cor de HInd
→
Predomina a cor de Ind−
A zona de viragem do
indicador deve:
1) estar contida na zona de
variação brusca do pH.
2) conter o pH no ponto de
equivalência.
Ind−
HInd
Ponto final e ponto de equivalência
Curvas de titulação de soluções 0.10 M de ácidos com uma base forte
Zona de
viragem
Zona de
viragem
Soluções tampão
Há zonas da curva em que o pH
varia pouco numa zona apreciável
de volume de titulante adicionado
Solução tampão:
Solução que resiste a variações
de pH quando se lhe adiciona
pequenas quantidades de ácido
ou bases fortes ou quando se
dilui com o solvente.
HA + H2O A− + H3O+
Exemplo: Solução 0,200 M em ácido acético e igualmente 0,200 M
em acetato de sódio à qual se adiciona:
a) 1.00 mL de NaOH 0.200 M a 100.0 mL de solução inicial
b) 1.00 mL de HCl 0.20 M a 100 mL de solução inicial
a) Nos 100 mL existem 0,0200 moles de ácido e 0.0200 moles de base
conjugada. Adicionaram-se 1.00 mL NaOH 0.200 M
⇒
0.000200 moles
Ca = (0.0200 – 0.0002)/Vt = 0.0198 moles / 101.0 mL
Cb = (0.0200 + 0.0002)/Vt = 0.0202 moles / 101.0 mL
= 1.7×
×10−5 × (0.0198/0.0202) = 1.66 × 10−5 M
pH = 4.778
b) 1,00 mL de HCl 0,20 M a 100 mL de solução inicial
Nos 100.0 mL existem 0.0200 moles de ácido e 0.0200 moles de base
conjugada. Adicionaram-se 1.00 mL HCl 0.200 M
⇒
0.000200 moles
Ca = (0.0200 + 0.0002)/Vt = 0.0202 moles / 101.0 mL
Cb = (0.0200 – 0.0002)/Vt = 0.0198 moles / 101.0 mL
= 1.7×
×10−5 × (0.0202/0.0198) = 1.73 × 10−5 M
pH = 4.760
O pH variou apenas de: 4.778 – 4.760 = 0.018 unidades
O que aconteceria nas mesmas condições com 100.0 mL de água
destilada aos quais se adicionasse 1,00 mL de NaOH ou HCl 0,200 M ?
A adição de 1.00 mL de NaOH a 100.0 mL de água conduzia a:
[OH−] = (1.00×0.200)/101 = 1.98×10−3 M
⇒ pOH = 2.703 ⇒ pH = 11.30
A adição de 1.00 mL de HCl a 100.0 mL de água conduzia a:
[H+] = (1.00×0.200)/101 = 1.98×10−3 M
⇒ pH = 2.703
A variação de pH será de 4.3 unidades
Numa mistura de ácido fraco e base conjugada:
HA + H2O A− + H3O+
Se se adicionar H3O+ …..
Se se adicionar
OH−
…..
Formam-se mais moléculas de HA,
que não contribuem para o pH
Formam-se mais iões A−, e o pH
também não varia muito
As soluções tampão têm grande interesse em múltiplas áreas
(sempre que seja necessário um controle de pH)
Formas de preparar tampões
Ex. um tampão fosfato a pH 7.15
⇒
o ácido fosfórico é um ácido triprótico e existem comercialmente:
H3PO4
pKa1 = 2.15
NaH2PO4
pKa2 = 7.15
Na2HPO4
pKa3 = 12.4
Na3PO4
Poder tampão de um sistema → π:
Capacidade para resistir a variações de pH por adição de ácidos
ou bases fortes
dCa e dCb são, respectivamente, o número de moles de ácido forte
e de base forte necessários para provocar uma variação de pH igual
a d pH em 1 litro de solução.
Poder tampão ou capacidade tampão:
Nº de moles de um ácido ou base forte
que provocam uma variação de 1.00
unidades de pH em 1.00 L da solução
tampão
Nas soluções tampão de misturas de ácido ou base fracos, pode
mostrar-se que, se for válida a eq. de Henderson,
pode calcular-se o poder tampão:
Sendo C = Ca + Cb
Nas soluções tampão de misturas de ácido ou base fracos, pode
ainda mostrar-se que:
o poder tampão π é máximo quando o ácido e a base
conjugados estiverem em concentrações iguais.
Ca = Cb
π calculado a partir do
declive da curva de
titulação do ácido acético
O poder tampão π é máximo quando Ca = Cb
O poder tampão π é razoável enquanto se está no intervalo:
Ca : Cb = 10 : 1
ou
Ca : Cb = 1 : 10
Exemplos de tampões
gama de pH
Ácido ftálico + ftalato de potássio
2.2 – 4.2
Ácido cítrico + citrato de sódio
2.5 – 7.0
Ácido acético + acetato de sódio
3.8 – 5.8
NaH2PO4 + Na2HPO4
6.2 – 8.2
Ácido carbónico – bicarbonato
5.3 – 7.3
Amónia + cloreto de amónio
8.2 – 10.2
Borato + hidróxido de sódio
9.2 – 11.2
Proteínas
6 - 8
Reacções de oxidação - redução
Exemplo:
Zn(s) + Cu2+ (aq) Zn2+ (aq) + Cu (s)
⇒
Comparação com reacções ácido – base … (pares conjugados)