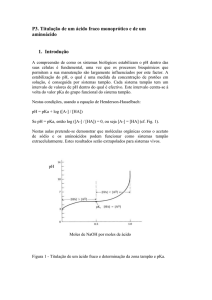
Guia de estudos: volumetria parte 1
1-) Defina volumetria e compare seu fundamento ao da gravimetria. O que é um padrão
primário?
2-) Qual o princípio de funcionamento de um indicador? Como o mesmo deve ser escolhido?
Diferencie ponto de equivalência de ponto de viragem, explique o que é erro de titulação.
3-) Uma solução de ácido clorídrico é padronizada por meio de titulação de 0,4541 g de um
padrão primário de tris-hidroximetil-amino-metano. Se foram necessários 35,37 mL desta
solução para a obtenção da viragem, qual é a molaridade do ácido preparado?
4-) Uma massa de 0,492 g de KH2PO4 é titulada com solução de NaOH 0,112 M, consumindo
25,6 mL. Demonstre a equação balanceada e calcule o % de pureza da amostra.
5-) Calcule o pH após a adição de 0 – 10,0 – 25,0 – 50,0 – 60,0 mL de titulante durante a
tirulação de 50,0 mL de NH3 0,10 M com HCl 0,100 M.
6-) Uma alíquota de 100,0 mL de uma mistura contendo HCl e H3PO4 é titulada com NaOH
0,200 M. o vermelho de metila é empregado como indicador, sendo o ponto final detectado
após adição de 25,0 mL; o segundo ponto é observado em 35,0 mL, empregando como
indicador o azul de bromotimol. Quais são as concentrações dos ácidos citados na amostra?
7-) Calcule o pH esperado para uma solução a 0,200M de ácido acético em água a temperatura
ambiente.
8-) Calcule a molaridade das espécies desconhecidas para as seguintes situações:
a-) 50,00 mL de HCl, após consumir 12,25 mL de NaOH 0,0505 M;
b-) 50,00 mL de CH3COOH, após consumir 14,23 mL de KOH 0,1002 M;
c-) 50,00 mL de ácido ftálico, após consumir 10,38 ml de NaOH 0,1075 M para obtenção do
segundo ponto de equivalência.
9-) Qual volume de KOH 0,0200 M deve ser adicionado sobre 500,00 mL de ácido acético
0,0200 M para que o pH varie de 4,00 para 5,00? Desconsidere possíveis efeitos de diluição,
força iônica, entre outros.
10-) Determine as espécies presentes e suas respectivas concentrações em solução nas
situações abaixo, observadas durante a titulação de 500,00 mL de ácido acético 0,0200 M com
KOH 1,000 M, desconsidere os efeitos de diluição:
a-) no ponto inicial da titulação;
b-) no ponto no qual pH = pKa do ácido acético;
c-) no ponto final da titulação;
d-) em 5,00 mL após o ponto final.