17
CAPÍTULO 3 – SISTEMA TAMPÃO
Introdução:
As reações químicas no organismo estão sujeitas a certas limitações como
faixas estreitas de pH e temperatura, devido à necessidade de se preservar o ambiente
fisiológico. Assim, quaisquer alterações de pH, por exemplo, poderiam causar o
comprometimento do funcionamento celular, uma vez que inúmeras estruturas
poderiam perder suas funções. Podemos citar como exemplo as enzimas, que são
proteínas altamente específicas que aceleram as reações químicas no organismo. As
enzimas são ativas em intervalos estreitos de pH. Assim, qualquer alteração de pH
afetará o funcionamento enzimático.
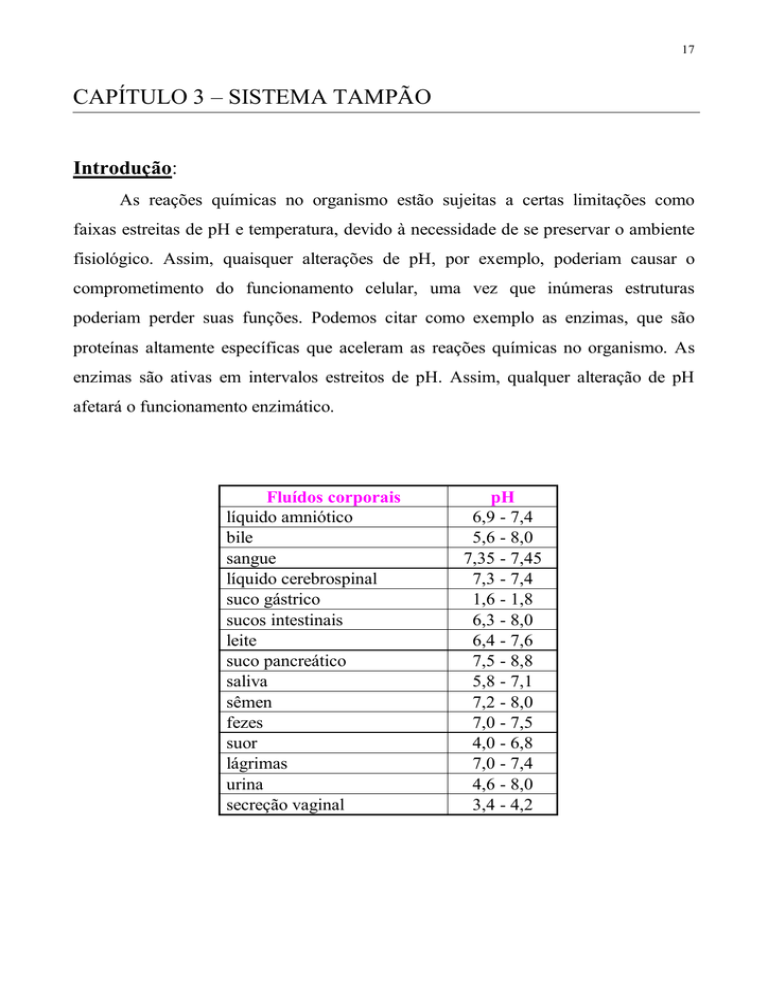
Fluídos corporais
líquido amniótico
bile
sangue
líquido cerebrospinal
suco gástrico
sucos intestinais
leite
suco pancreático
saliva
sêmen
fezes
suor
lágrimas
urina
secreção vaginal
pH
6,9 - 7,4
5,6 - 8,0
7,35 - 7,45
7,3 - 7,4
1,6 - 1,8
6,3 - 8,0
6,4 - 7,6
7,5 - 8,8
5,8 - 7,1
7,2 - 8,0
7,0 - 7,5
4,0 - 6,8
7,0 - 7,4
4,6 - 8,0
3,4 - 4,2
18
Mas como o organismo encontra uma maneira de se defender contra variações
de pH?
- Ele se defende através de um conjunto de substâncias denominadas tampões,
capazes de “compensar” qualquer alteração de pH, que possam haver.
Definição de tampão: Tampão é uma solução cujo pH varia muito pouco quando a
ela são adicionados ácidos ou bases.
De que é formado um tampão?
Os tampões são formados por um ácido fraco e sua base conjugada.
Recordação de conceitos de ácidos e bases segundo Bronsted Lowry:
Segundo Brosted Lowry:
- Ácidos são substâncias capazes de doar prótons
- Bases são substâncias capazes de receber prótons
assim,
(ácido clorídrico)
HCl
(ácido acético)
HAc
H+ + Cl-
H+ + Ac-
Deste modo HCl e HAc são ácidos pois podem doar prótons, enquanto Cl- e Ac- são as
bases conjugadas dos ácidos, pois podem receber prótons (H+), convertendo-se
novamente em HCl e HAc.
19
Força de um ácido e sua dissociação:
Um ácido forte é aquele que se dissocia quase totalmente em soluções diluídas. Ex;
HCl
H+ + Cl-
Um ácido fraco é aquele que se dissocia muito pouco em soluções diluídas. Ex:
HAc H+ + Ac-
Como dissemos anteriormente, o sistema tampão é constituído por um ácido fraco e
sua base conjugada.
Imaginemos uma balança em que um dos pratos apresenta a forma não dissociada do
ácido e o outro prato, a forma dissociada.
Para entendermos como funciona um tampão, vejamos inicialmente por que um ácido
forte não pode ser tampão.
Por que um ácido forte não pode funcionar como tampão?
O que ocorre ao adicionarmos H+ (base forte)?
Assim, uma vez que o ácido forte está praticamente todo dissociado, ao
acrescentarmos íons H+, faremos cada vez mais o lado da balança que tem H+ ficar
mais pesado. Nunca conseguiremos fazer o lado onde há HCl pesar o suficiente para
equilibrar a balança, se acrescentarmos H+.
20
O que ocorre ao adicionarmos OH- ?
Caso acrescentemos OH-, estes reagirão com o H+ formando água (H2O) que não está
na balança. Assim, teremos menos reagentes do lado onde há H+. A balança pesará um
pouco menos deste lado, mas como o ácido é forte e está praticamente todo
dissociado, não haverá como formar mais H+ para compensar aqueles que reagiram
com os íons OH-. Desta forma não conseguiremos equilibrar a balança.
21
Por que um ácido fraco pode ser um tampão?
O que ocorre ao adicionarmos ácido forte (H+) a uma solução de ácido fraco:
Ao adicionarmos um ácido forte a uma solução de ácido fraco, que está
hipoteticamente representada por uma balança equilibrada, os íons H+ serão
adicionados no lado direito (isto é, no lado onde há H+ e A-), fazendo com que este
lado pese mais.
Como existe um equilíbrio (ver as flechas), ao pesar mais o lado direito da balança
(que apresenta as formas dissociadas do ácido), o equilíbrio se deslocará para a
esquerda numa tentativa de tornar a “equilibrar” a balança imaginária.
Deste modo, H+ se associará a A-, para formar novamente HA e reequilibrar a
balança.
O que ocorre se adicionarmos base forte (OH-) a uma solução de ácido fraco:
Ao adicionarmos uma base forte a um ácido fraco, os íons H+ provenientes da
dissociação do ácido reagirão com os íons OH- da base que está sendo adicionada,
formando água (H2O), que não está na balança imaginária.
Como alguns íons H+ foram consumidos nesta reação, o lado da balança que apresenta
este íon diminui de “peso”(lado direito).
Para que este desfalque seja compensado, o equilíbrio da reação é deslocado para o
sentido de formação de mais H+ e mais A-.
Desta forma a balança imaginária é novamente equilibrada.
22
Mas será que os tampões resistem a quaisquer quantidades de H+ ou de OHadicionadas a eles?
Não, a eficiência de um tampão está relacionada com o pH e também com as
quantidades de ácido e base conjugadas existentes.
Isto é, um tampão apresentará sua maior capacidade em tamponar, quando houver
exatamente 50% da forma não dissociada e 50% da forma dissociada.
Assim:
HAc
H+ + Ac-
Mas até que ponto um tampão é capaz de exibir capacidade tamponante?
Na realidade, os tampões apresentam capacidade tamponante em intervalos de pH
iguais aos valores do logaritmo negativo (-log) da constante de dissociação do ácido
fraco (pKa do ácido), mais ou menos uma unidade de pH.
Assim, se a constante de dissociação de um ácido fraco, como ácido acético é 4,74,
um tampão acetato terá capacidade tamponante em intervalos de pH entre 3,74 e 5,74.
Equação de Henderson-Hasselbalch:
pH= pKa + log [base] / [ácido]
Nesta equação podemos perceber que quando a relação entre a base conjugada e o
ácido, for de 10 para 1, teremos logaritmo de 10 na base 10, que é igual a 1.
23
pH= pKa + log 10 / 1
Portanto:
pH = pKa + 1
Já, quando a relação entre a base conjugada e o ácido for de 1 para 10, teremos
logaritmo de 0,1 na base 10, que é igual a -1.
pH= pKa + log 1/10
Portanto:
pH = pKa -1
Se aplicarmos isto para o ácido acético teremos:
pH = pKa 1
Portanto:
pH= 4,74 1
24
Exercícios teóricos propostos
1. Defina solução tampão e dê um exemplo.
2. O que você entende por capacidade de tamponamento?
3. Qual o pH de uma solução de tampão lactato, preparada com 0,05M de ácido lático
e 0,05M de lactato de sódio? O valor de Ka do ácido lático é 1,4 x 10-4.
4. Qual é o pH de uma solução tampão preparada com NH3 0,10M e NH4+? O valor
de Kbé 1,8 x 10-5.
5. Qual o pH de uma solução tampão que é 0,15M na piridina e 0,10M no brometo de
piridínio. O valor de Kb é 1,4 x 10-9.
6. Qual o pH de uma solução tampão que é 0,20M no ácido propiônico e 0,10M no
propionato de sódio? O valor de Ka é
1,3 x10-5.
7. Quais são os componentes de um tampão?
8. Como funciona um tampão?
9. Quais dos seguintes sistemas poderia funcionar como um tampão?
a) HCl + NaCl
b) H2SO4 + NaHSO4
c) NaOH + HCl
d) H2CO3 + K2CO3
10. Calcule a relação base/ácido em uma solução de ácido fraco e sua base conjugada
cujo pH é 7,5. O pKa do ácido com o qual esta solução foi preparada é 4,76. Esta
solução poderá ser usada como tampão? Por quê?
11. Temos uma enzima cujo pH ótimo de ação é 7,5. Qual das seguintes substâncias
você usaria na preparação de um tampão para ser usado nas experiências que
envolvessem esta enzima?
25
a) ácido bórico Ka= 5,9 x 10-10
b) ácido propiônico Ka= 1,3 x10-5
c) ácido acético Ka= 1,7 x10-5
d) Tris Ka=1,4 x10-4
e) ácido pirúvico pKa= 3,85
12.O sangue humano tem pH invariavelmente próximo a 7,4. Calcule a relação
[CO2]/[HCO3-] presente numa amostra de sangue que apresenta este pH. Dado pKa=
6,38.
26
Dissociação da água
A água é um eletrólito fraco, apresenta-se pouco dissociada. Podemos representar a
dissociação da água como:
H2 O
H+ + OH-
Podemos comprovar que a ionização da água realmente ocorre, medindo a sua
condutividade elétrica. Verificamos que a condutividade da água é extremamente
pequena, provando assim que a água é realmente um eletrólito fraco, o qual pouco se
dissocia, formando íons.
Na realidade, podemos considerar que para cada
555.000.000 moléculas de água, apenas 1 se dissocia.
Assim, podemos escrever a condição de equilíbrio para esta dissociação da seguinte
maneira:
K= [H+] [OH-]
[H2O]
Como a concentração de íons formados é muito pequena podemos considerar que a
concentração de H2O não ionizada é praticamente constante (cerca de 56M, a 25C).
Rearranjando os termos da equação teremos:
K . [H2O] = [H+] [OH-]
27
Se [H2O] é constante, o produto iônico da água [H+] [OH-] será igual a uma constante
(Kw = constante de dissociação da água ou produto iônico da água)
Kw = [H+] [OH-]
onde o valor de Kw será 1,0 x 10-14, a 25C.
Como qualquer outra constante de equilíbrio, Kw varia com a temperatura. Por
exemplo, a 37C o valor de Kw é 2,5 x 10-14.
Outros valores de Kw são descritos na tabela abaixo:
0°C
Temperatura
Valores de Kw
25°C
0,115 x 10- 1,008 x 10-14
4°C
100°C
3,02 x 10-14
51,32 x 10-14
14
Soluções ácidas, básicas ou neutras
uma solução ácida é aquela onde a concentração de íons H+ é maior que a de íons
OH-. Assim, [H+] [OH-]
uma solução básica é aquela onde a concentração de OH- é maior que a de H+.
Assim, [OH-] [H+]
uma solução neutra é aquela em que temos concentrações iguais de íons H+ e OH-.
Assim, [H+] = [OH-] ou seja 1,0 x 10-7M.
OBS: Como [H+] x [OH-] é igual a uma constante (Kw), quando uma delas aumenta a
outra tem que diminuir.
28
Exercícios de cálculo das concentrações de íons H+ e OH- em soluções de ácidos
fortes ou bases fortes:
1. Calcular as concentrações de íons H+ e OH-, a 25C, no HNO3 0,15M.
2. Calcular as concentrações de íons H+ e OH-, a 25C, no NaOH 0,010M
3. Uma solução que tem concentração de íons hidróxido igual a 1,0 x 10-5M, a 25C.
A solução é ácida, básica ou neutra?
4. Um xampu tem [OH-]= 1,5 x 10-9M, a 25C. Calcule a [H+] neste xampu. Ele é
ácido, básico ou neutro?
5. Qual a [OH-] e [H+] presente nas seguintes soluções?
6. HCl 1,25M
7. NaOH 0,25M
8. Ca(OH)2 0,035M
9. HNO3 0,50M
10. Calcule a [H+] e [OH-] presentes numa solução de Ca(OH)2 0,010M.
11. Uma amostra de suco de laranja tem [H+]=2,9 x 10-4M. Ela é ácida, básica ou
neutra?
O pH de uma solução
Dependendo da concentração de íons hidrônio (H+), teremos uma solução com caráter
ácido, básico ou neutro.
Como os valores podem muitas vezes ser muito pequenos, e para contornarmos o uso
de expressões exponenciais, Sörensen convenientemente expressou-os por meio do
uso de logaritmo. Assim, pH é o logaritmo negativo da concentração de íons H +.
Assim,
29
pH= -log [H+]
onde:
p= potencial
pH= potencial hidrogeniônico
Pode-se calcular o pH de uma solução, conhecendo-se a [OH-], através das seguintes
fórmulas:
pOH= -log [OH-] e pH + pOH=14
No caso do pOH, temos o potencial hidroxiliônico.
Abaixo encontram-se uma escala dos valores de pH e pOH e uma tabela que resume
exemplos de várias soluções conhecidas e seus respectivos pH:
6,5
ácido
|
7,5
7,0
básico ou alcalino
NEUTRO
Cabe ressaltar que para o sangue, considera-se neutralidade, valores compreendidos
entre 7,34 e 7,44. Temos ACIDOSE quando os valores forem inferiores a 7,34 e,
ALCALOSE, quando os valores forem superiores a 7,44.
30
Valores de pH de fluídos corporais e soluções de interesse:
substâncias
Suco gástrico
pH
1,0 – 3,0
Líquido amniótico
6,9 – 7,4
Sangue
7,34 – 7,44
Saliva
5,8 - 7.1
Lágrima
7,0 – 7,4
Urina
4,8 – 8,0
refrigerantes
2,0 – 3,0
Suco de limão
2,0 – 2,5
Suco de Laranja
3,0 – 4,0
Cerveja
4,0 – 5,0
Água de abastecimento
5,0 – 8,0
Vinagre
2,4 – 3,4
Leite
6,4 – 7,6
Água com gás
3,9
Exercícios teóricos de cálculo de pH e pOH de soluções:
1. Uma amostra de suco de laranja tem concentração de íons H+ igual a 2,9 x 10-4M.
Qual seu pH? A solução é ácida, básica ou neutra? Por quê?
2. Calcular o pH de uma solução sabendo-se que
[OH -]=1,0x10-4M.
3. O pH do sangue arterial humano é 7,4. Calcule a [H+].
4. (OBS: antilog = 10-pH)
5. Calcule a [H+] de uma amostra de refrigerante que apresente pH 3,6.
31
6. Qual o pH de uma amostra de suco gástrico que apresente [H+]= 0.045M?
7. Qual das seguintes soluções aquosas é ácida?
8. solução A com pH 7,0
9. solução B com pH 14
10. solução C com pH 3,0
11. solução D com [H+]= 1 x 10-10M
12. Há alguns anos atrás, a CETESB constatou em São Paulo, uma chuva ácida com
pH 5,0. Qual a concentração de íons H+ numa amostra desta chuva?
13. Qual o pOH de soluções que apresentem a seguintes concentrações de íons H+:
a) 1,1 x 10-2M
b) 3,6 x 10-4M
c) 5,0 x 10-10M
d) 1,9 x 10-14M
14. Calcule o pOH de uma solução cuja [H+] é igual a 2,5 x 10-4M.
15. Qual a concentração de íons hidrogênio em uma solução neutra?
================
Exercícios práticos sobre tampões
1. Prepare 200 ml de uma solução de ácido acético 0,2M.
2. Prepare 200 ml de uma solução de acetato de sódio 0,2M.
3. Retire uma amostra de 4,8 ml da solução de ácido acético 0,2M e transfira-a para
um béquer. Transfira-a também para o mesmo béquer, uma alíquota de 45,2 ml da
solução de acetato de sódio 0,2M. Nomeie como solução A. Determine o pH desta
solução e por meio da equação de Henderson-Hasselbalch determine a relação
32
base/ácido. Esta solução recém preparada é um tampão? Ka do ácido acético 1,8 x
10-4.
4. Repita a experiência número 3, entretanto misture 25,5 ml de solução 0,2M de
ácido acético com 24,5 ml de solução 0,2M acetato de sódio. Nomeie como
solução B. Determine o pH e por meio da equação de Henderson-Hasselbalch
determine a relação base/ácido. Esta solução recém preparada é um tampão?
5. Repita a experiência número 3, entretanto misture 41 ml de ácido acético e 9,0 ml
de acetato de sódio. Nomeie como solução C. Determine o pH e por meio da
equação de Henderson-Hasselbalch determine a relação base/ácido. Esta solução
recém preparada é um tampão?
6. Transfira o béquer que contém a solução A para o pHmetro e meça novamente o
pH. Com esta solução ainda no pHmetro, adicione gota a gota, NaOH 1M.
Observe se ocorre mudança no pH. Adicione cerca de 5 ml de NaOH 1M e anote
as variações de pH que possam vir a ocorrer.
7. Repita esta operação com as soluções B e C.
8. Transfira para um béquer 50 ml de ácido acético 0,2M. Acrescente NaOH 1M,
gota a gota e anote as variações de pH que venham a ocorrer.
9. Correlacione os resultados observados nas experiências acima, com os teóricos.
33
RASCUNHO












