Indicadores e Titulação
Erika Souza Vieira
Bioquímica I
2006
INDICADORES
São substâncias, inicialmente de origem vegetal
ou artificial (atualmente), que possuem a
propriedade de adquirir colorações diferentes
quando em meio ácido ou meio básico.
Indicadores
Fenolftaleína
Tornassol
Azul de bromotimol
Alaranjado de metila
Meio ácido
Incolor
Vermelho
Amarelo
Vermelho
Meio básico
Rosa
Azul
Azul
Amarelo
pH
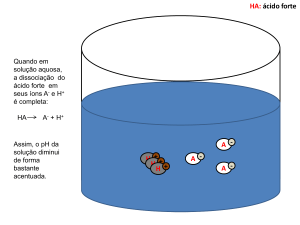
A acidez das soluções é medida em função da
quantidade de íons H3O+ livres.
Esta quantidade é expressa em uma escala de
pH. A letra “p” é uma função matemática que
significa “- log”. Sendo assim, o pH é
determinado pelo negativo do logaritmo da
concentração de íons hidrônio em solução:
pH = - log [H+]
Esta escala vai
de 0 à 14
pH
O pH não é expresso apenas por número
inteiros.
Alguns exemplos de medida
De pH.
Material
Suco gástrico
Refrigerante
Leite de vaca
Água destilada
Sangue humano
Solução de Bicarbonato de sódio
Leite de magnésia
Solução de hidróxido de sódio
pH
1,0 – 3,0
2,5 – 3,5
6,3 – 6,6
7,0
7,3 – 7,5
8,4
10,5
13-14
Neutralização
Ao adicionarmos um ácido a uma base
ocorre uma reação química, ou seja, os
átomos se reagrupam formando novas
substâncias. Em função de o ácido conter H+
e da base conter OH-, água é um produto que
será formado neste tipo de reação:
NaOH + HCl→H2O + NaCl
A reorganização dos átomos formando água
e sal é chamado de neutralização.
Neutralização
Os sais gerados podem ter as seguintes
origens:
Ácido forte com base forte: apresentam
comportamento neutro, pois os íons formados são
ácidos conjugados fracos e bases conjugadas fracas,
não alterando o equilíbrio de íons hidrônio e hidroxila
do meio.
Ácido fraco e base forte: apresentam
comportamento básico, pois o ácido fraco origina uma
base forte, a qual irá capturar um íon H+ da água,
deixando íons OH- livres em solução.
Neutralização
Os sais gerados podem ter as seguintes
origens:
Ácido forte e base fraca: apresentam
comportamento ácido, pois a base fraca
origina um ácido forte, o qual captura íons
hidroxila da água, deixando íons H+ em
solução.
Ácido fraco com base fraca: neste caso,
tanto o ácido quanto a base geram bases e
ácidos conjugados fortes. A hidrólise de
ambos leva a neutralização.
Esquema de Aparelhagem
Bureta
Garra
Suporte Universal
Erlenmeyer
IMPORTANTE: A Titulação pode ser usada para determinar: acidez
do leite; teor do ácido acético do vinagre; teores de certos minerais
(Cálcio, por exemplo); a real concentração de uma solução e ainda
para padronizar uma solução.