Universidade Federal do Rio de Janeiro
Centro de Ciências da Saúde
Instituto de Bioquímica Médica
Curso: Enfermagem e Obstetrícia
P H E SOLUÇÕES TAMPÃO
PH
pH =
1
= - log [H+]
log[H+]
Determina as concentrações de H+ e OH- em qualquer solução aquosa
Afeta a estrutura e a atividade das biomoléculas
Absorção Medicamentos
Diagnóstico clínico (pH do sangue e urina)
E SCALA
DE P H
E SCALA
DE P H
BASES: [H+]
Aceptores de prótons. Tendem a incorporar
prótons em suas moléculas numa solução
aquosa
ÁCIDOS: ↑ [H+]
Doadores de prótons. Tendem a perder prótons
numa solução aquosa
Bicarbonato de sódio
Á CIDOS
E BASES
Ácidos ou bases fortes:
Completamente ionizados quando diluídos em solução aquosa
Ácido clorídrico, ácido sulfúrico, ácido nítrico, NaOH, KOH
Ácidos ou bases fracas:
Não estão completamente ionizados quando diluídos em água
Comuns em sistemas biológicos
Papel importante no metabolismo e regulação
PAR ÁCIDO - BASE CONJUGADO
Doador de prótons e seu aceptor correspondente
CH3COOH
ácido acético
H+ + CH3COO-
ânion acetato
Quanto mais forte o ácido, maior a tendência em perder prótons
HA
H + + A-
Constante de equilíbrio:
Keq =
[H+] [A-]
[HA]
= Ka
A tendência do ácido em perder um próton e formar a sua base conjugada é definida por
uma constante de equilíbrio.
E QUAÇÃO DE H ENDERSON H ASSELBACH
pKa é o pH no qual metade do fármaco está ionizado [A-]
A BSORÇÃO DE
MEDICAMENTOS
Fármacos são ácidos ou bases fracas
presentes nas soluções tanto sob a
forma ionizada (BH+ ou A-) quanto nãoionizada (B ou HA)
Essa forma variam de acordo com o pH
BH+
B + H+
HA
A- + H +
A BSORÇÃO DE
MEDICAMENTOS E P H
Ionizada (BH+ ou A-):
Solubilidade em água é alta
Lipossolubilidade baixa - sendo incapaz de atravessar as
membranas
Não-ionizada (B ou HA):
Solubilidade em água é baixa
Lipossolúveis e podem se difundir através da membrana
C OMO SERÁ ABSORÇÃO DA
ASPIRINA NO P H = PKA ??
3 = 3 + log [A- ]
[HA]
log [A- ] = 0
[HA]
[A- ] = 1
[HA]
[A- ] = [HA]
log [A- ] = log 1
[HA]
E COMO SERÁ A ABSORÇÃO
DA ASPIRINA EM PH BÁSICO ??
8 = 3 + log [A- ]
[HA]
[A- ] = 100.000
[HA]
1
log [A- ] = 5
[HA]
[A- ]
log [A- ] = log 100.000
[HA]
= 100.000 vezes maior que [HA]
E M QUAL P H A ASPIRINA
SERÁ MELHOR ABSORVIDA ??
1 = 3 + log [A- ]
[HA]
[A- ] =
[HA]
1
100
log [A- ] = -2
[HA]
log [A- ] = log 0,01
[HA]
[HA] = 100 vezes maior que [A-]
Estômago (ácido)
A BSORÇÃO DE
MEDICAMENTOS E P H
[H+] em relação ao pK
[H+]
Pk [H+] = [A-]
I MPLICAÇÃO NA SOLUBILIDADE
DO FÁRMACO ÁCIDO
O comprimido precisa ser solubilizado e depois absorvido!
HA
Forma
absorvida
A- + H+
Forma
solúvel
I MPLICAÇÃO NA SOLUBILIDADE
DO FÁRMACO ÁCIDO
O comprimido precisa ser solubilizado e depois absorvido!
A- + H+
HA
Forma
absorvida
NaHCO3
Na+ + HCO3Bicarbonato de sódio
HCO3H2O
[H+]
Forma
solúvel
H2CO3
H2O + CO2
H+ + OH-
pH Basifica a solução facilita solubilização do fármaco
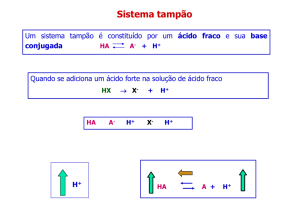
TAMPÕES
Soluções que resistem às variações do pH quando pequenas
quantidades de ácido (H+) ou base (OH-) são adicionados
Composto de um ácido fraco e a sua base conjugada em
concentrações próximas
Tamponamento resulta do equilíbrio de duas reações reversíveis
que apresenta quantidades iguais ou próximas do doador
(ácido) e aceptor (base) de prótons
C OMO
DETERMINAR A
CONCENTRAÇÃO DE UM ÁCIDO
OU BASE EM UMA SOLUÇÃO ?
Ácido Acético Acetato
Titulação:
A concentração de ácido é calculada
a partir do volume e da concentração
de base
CH3COOH
H+ + CH3COO-
pH > pK
pH < pK
V ÍDEO BUFFER
C URVA
DE TITULAÇÃO DE
ÁCIDOS COM FORÇAS
DIFERENTES
Ácido mais fraco (demora mais a
perder H+) maior pKa
Ácido mais forte (perde H+ mais
rapidamente) menor pKa
Íon Amônio
Diidrogênio Fosfato
Ácido Acético
Qual pK deve ter o tampão do citosol?
E do sangue?
E do estômago?
A ÇÃO DOS TAMPÕES CONTRA AS
VARIAÇÕES DE P H NOS SISTEMAS
BIOLÓGICOS
Qual o pH ideal para cada compartimento?
A ÇÃO
DOS TAMPÕES CONTRA AS
VARIAÇÕES DE P H NOS SISTEMAS
BIOLÓGICOS
Variações do pH provocam grandes variações na velocidade dos processos biológicos
Ex: Atividade enzimática em catalisar reações
Pepsina
Enzima digestiva produzida no estômago
Função: quebrar proteínas
em peptídeos mais simples
Tripsina
Age nas proteínas do quimo no intestino
Produzida no pâncreas e ativada no duodeno pelo
suco intestinal
Fosfatase Alcalina
Remove grupos fosfatos de nucleotídeos,
proteínas e alcalóides
Produzida por diversos órgãos e tecidos (ex:
ossos, fígado e placenta)
C OMO MANTER O P H
CONSTANTE E ESPECÍFICO ?
Ácidos ou Bases fracos tamponam
células e tecidos contra variações no pH
C OMO MANTER O P H
CONSTANTE E
ESPECÍFICO ??
Ácidos ou Bases fracos
tamponam células e
tecidos contra variações
no pH
P ROTEÍNAS COMO SISTEMAS
TAMPÃO
Altas concentrações de proteínas
Aminoácidos apresentam grupos funcionais que são ácidos ou bases fracos
As proteínas possuem apenas um
grupo amino e caboxila livre em cada
extremidade. Pois os outros grupos
amino e carboxila dos aminoácidos
intermediários estão ligados
covalentemente entre si (ligações
peptídicas) e por isso não contribuem
para o comportamento ácido base da
proteína. Assim, o que interessa na
proteína como sistema tampão é o
pKa da cadeia lateral.
A MINOÁCIDOS
Pk ente 1 e 2
Grupo Ácido
Grupo Amino
a
Pk ente 9 e 10
Grupo ou Cadeia Lateral
L IGAÇÃO
a
PEPTÍDICA
a
Aminoácido 1
Aminoácido 2
a
a
Ligação Peptídica
Dipeptídeo
C ADEIAS
LATERAIS
Alguns dos aminoácidos formadores de proteínas
Alanina
Serina
Ácido
aspártico
Cisteína
Tirosina
Histidina
P ROTEÍNAS COMO SISTEMAS
TAMPÃO
Altas concentrações de proteínas
Aminoácidos apresentam grupos funcionais que são ácidos ou bases fracos
As proteínas possuem apenas um
grupo amino e caboxila livre em cada
extremidade. Pois os outros grupos
amino e carboxila dos aminoácidos
intermediários estão ligados
covalentemente entre si (ligações
peptídicas) e por isso não contribuem
para o comportamento ácido base da
proteína. Assim, o que interessa na
proteína como sistema tampão é o
pKa da cadeia lateral.
TAMPONAMENTO DO P H DO
CITOPLASMA
Ex: Aminoácido Histidina (pKa = 6)
Tamponamento efetivo em pH neutro
TAMPÕES BIOLOGICAMENTE
IMPORTANTES
Sistemas Fosfato e Bicarbonato
pH é constante e específico
(mantém as biomoléculas em seu estado
iônico ótimo)
TAMPÃO
FOSFATO
pKa ~7,0
Tamponamento do citoplasma
pH
pH entre 6,9 e 7,4
Importância do fosfato nas células:
-integra inúmeros intermediários do
metabolismo dos carboidratos,
proteínas e lipídios.
-armazenamento e transporte de
energia em forma de ATP
-co-fatores, como NAD, NADP e tiamina
pirofosfato, do AMPc e trifosfato de
inositol (segundos mensageiros)
-DNA e RNA.
TAMPÃO
BICARBONATO
H2CO3 do plasma sanguíneo está em equilíbrio com o CO2 dos
pulmões
Tamponamento do plasma sanguíneo
pH ~ 7,4
C OMO
FUNCIONA O TAMPÃO
BICARBONATO DURANTE UM
EXERCÍCIO FÍSICO ?
Ácido láctico (H+) produzido no músculo é adicionado no sangue provocando
Ácido carbônico
hiperventilação
C OMO
FUNCIONA O TAMPÃO
BICARBONATO QUANDO O P H DO
SANGUE AUMENTA ?
Produção de amônia (NH3) durante o catabolismo de proteínas provoca:
Bicarbonato
Respiração lenta
regula pH
PACIENTES
COM PROBLEMAS
RESPIRATÓRIOS
( LIBERAÇÃO DE CO 2 )?
Ex: Fibrose Cística, Asma, Pneumonia Severa, Enfisema Pulmonar (DPOC)
Acidose respiratória
Muco pulmão dificulta a
liberação de CO2
H IPERVENTILAÇÃO
HISTÉRICA
SOLUÇÃO:
Respirar novamente o CO2 expirado
( CO2)
Reverte a alcalose respiratória
H IPERVENTILAÇÃO HISTÉRICA
Ex: Pessoas ansiosas com crise nervosa
Alcalose respiratória
Algumas causas possíveis:
Dor
Histeria
Ansiedade
A alcalose respiratória ocorre
como resultado da
hiperventilação
Freqüência respiratória
A CIDOSE
METABÓLICA
Ex: Diarréia [HCO3-]
SOLUÇÃO:
Hiperventilação consegue
reverter instantaneamente a
acidose metabólica
Hiperventilação
Acidose metabólica não compensada é raramente vista clinicamente
A LCALOSE
METABÓLICA
Ex: Vômito [H+]
(elimina conteúdo do estômago)
hipOventilação
SOLUÇÃO:
Respiração lenta consegue reverter
instantaneamente a alcalose metabólica
D ISTÚRBIOS
ÁCIDO - BASE
E QUILÍBRIO
ÁCIDO - BASE
P RÁTICA