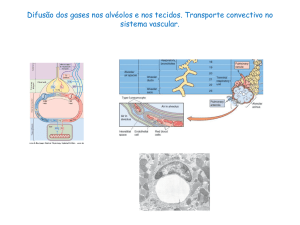
pH e sistema
tampão
pH
pH =
1
= - log [H+]
log[H+]
Determina as concentrações de H+ e OH- em qualquer solução aquosa
Afeta a estrutura e a atividade das biomoléculas
Absorção Medicamentos
Diagnóstico clínico (pH do sangue e urina)
Escala de pH
Escala de pH
BASES: [H+]
Aceptores de prótons, tendem a
incorporá-los em suas moléculas numa
solução aquosa
ÁCIDOS: ↑ [H+]
Doadores de prótons, tendem a perdêlos numa solução aquosa
Ácidos e bases
Ácidos ou bases fortes:
Completamente ionizados quando diluídos em solução aquosa
Ácidos ou bases fracas:
Não estão completamente ionizados quando diluídos em água
Comuns em sistemas biológicos
Papel importante no metabolismo e regulação
Par ácido-base conjugado
Doador de prótons e seu aceptor correspondente
CH3COOH
H+ + CH3COO-
Quanto mais forte o ácido, maior a tendência em perder prótons
HA
H+ + A-
Constante de equilíbrio:
Keq =
[H+] [A-]
[HA]
= Ka
Equação de Henderson-Hasselbach
Absorção de medicamentos
Fármacos são ácidos ou bases fracas presentes nas soluções tanto sob a
forma ionizada (BH+ ou A-) quanto não-ionizada (B ou HA)
Variam de acordo com o pH
BH+
B + H+
HA
A- + H+
Absorção de medicamentos e pH
Ionizada (BH+ ou A-):
Lipossolubilidade baixa sendo incapaz de
atravessar as membranas
Não-ionizada (B ou HA):
Lipossolúveis e podem se difundir através da
membrana
Em qual pH a aspirina será melhor absorvida??
1 = 3 + log [A- ]
[HA]
[A- ] = 1
[HA]
100
log [A- ] = -2
[HA]
log [A- ] = log 0,01
[HA]
[HA] = 100 vezes maior que [A-]
Estômago (ácido)
Como será absorção da aspirina no pH = pka ??
3 = 3 + log [A- ]
[HA]
[A- ] = 1
[HA]
log [A- ] = 0
[HA]
[A- ] = [HA]
log [A- ] = log 1
[HA]
E como será a absorção da aspirina em ph básico ??
8 = 3 + log [A- ]
[HA]
[A- ] = 100.000
[HA]
log [A- ] = 5
[HA]
[A- ]
log [A- ] = log 100.000
[HA]
= 100.000 vezes maior que [HA]
Absorção de medicamentos e pH
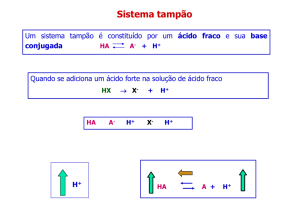
Tampões
Soluções que resistem às variações do pH quando
pequenas quantidades de ácido (H+) ou base (OH-) são
adicionados
Composto de um ácido fraco e a sua base conjugada em
concentrações próximas
Tamponamento resulta do equilíbrio de duas reações reversíveis que
apresenta quantidades iguais ou próximas do doador (ácido) e aceptor
(base) de prótons
Como determinar a concentração de um ácido ou
base em uma solução?
Ácido Acético Acetato
Titulação:
A concentração de ácido é
calculada a partir do volume e
da concentração de base
Curva de titulação de ácidos com forças diferentes
Ácido mais fraco (demora
mais a perder H+) maior pKa
Ácido mais forte (perde H+ mais
rapidamente) menor pKa
Íon Amônio
Diidrogênio Fosfato
Ácido Acético
Qual a importância de uma curva de titulação?
Mostra graficamente que um par ácido-base conjugado
pode funcionar como um tampão
Ácido Acético Acetato
Ação dos tampões contra as variações de pH nos
sistemas biológicos
Variações do pH provocam grandes variações na velocidade dos processos biológicos
Ex: Atividade enzimática em catalisar reações
Pepsina
Enzima digestiva produzida no estômago
Função: quebrar proteínas
em peptídeos mais simples
Tripsina
Age nas proteínas do quimo no intestino
Produzida no pâncreas e ativada no duodeno
pelo suco intestinal
Fosfatase Alcalina
Remove grupos fosfatos de nucleotídeos,
proteínas e alcalóides
Produzida por diversos órgãos e tecidos
(ex: ossos, fígado e placenta)
Como manter o pH constante e específico?
Ácidos ou Bases fracos tamponam
células e tecidos contra variações no pH
Como manter o pH constante e específico??
Ácidos ou Bases fracos
tamponam células e tecidos
contra variações no pH
Proteínas como sistemas tampão
Altas concentrações de proteínas
Aminoácidos apresentam grupos funcionais que são ácidos ou bases fracos
As proteínas possuem apenas um
grupo amino e caboxila livre em
cada extremidade. Outros grupos
amino e carboxila dos
aminoácidos restantes estão
ligados covalentemente entre si
(ligações peptídicas) e assim não
contribuem para o comportamento
ácido base da proteína. Assim, o
que interessa na proteína como
sistema tampão é o pKa da cadeia
lateral.
Tamponamento do pH do citoplasma
Ex: Aminoácido Histidina (pKa = 6)
Tamponamento efetivo em pH neutro
Tampões biologicamente importantes
Sistemas Fosfato e Bicarbonato
pH é constante e específico
(mantém as biomoléculas em seu
estado iônico ótimo)
Tampão fosfato
pH
pKa ~7,0
Tamponamento do citoplasma
pH entre 6,9 e 7,4
Tampão bicarbonato
H2CO3 do plasma sanguíneo está em equilíbrio com o CO2 dos pulmões
Tamponamento do plasma sanguíneo
pH ~ 7,4
Como funciona o tampão bicarbonato durante um
exercício físico?
Ácido láctico (H+) produzido no músculo é adicionado no sangue provocando
Ácido carbônico
hiperventilação
Como funciona o tampão bicarbonato quando o pH
do sangue aumenta?
Produção de amônia (NH3) durante o catabolismo de proteínas provoca:
Bicarbonato
Respiração
lenta regula
pH
Pacientes com problemas respiratórios
(liberação de CO2)?
Ex: Fibrose Cística, Asma, Pneumonia Severa, Enfisema Pulmonar (DPOC)
Acidose respiratória
Muco pulmão dificulta
a liberação de CO2
Acidose Respiratória
Insuficiência Respiratória – redução na eliminação de CO2
Causas possíveis:
Asma - depressão respiratória devido a resistência na passagem do
ar
Pneumonia severa – prejuízo nas trocas gasosas
Aumento da pCO2 nos tecidos.
O equilíbrio desloca-se para a direita.
CO2 + H20
H+ + HCO3Compensação renal:
excreta H+ ( aumentar pH plasmático)
reabsorve HCO3- (combina com H+
livre e aumenta o pH)
Hiperventilação histérica
Ex: Pessoas ansiosas com crise nervosa
Alcalose respiratória
Freqüência respiratória
Alcalose Respiratória
Algumas causas possíveis:
Dor
Histeria
Ansiedade
A alcalose respiratória ocorre como resultado da hiperventilação
A diminuição de CO2 desloca o equilíbrio pra esquerda
Para reverter: respirar dentro de um saco de papel
CO2 + H20
H+ + HCO3-
Compensação renal:
excreta HCO3reabsorve H+ (Diminuir pH, aumentando
conc H+)
SOLUÇÃO:
Respirar novamente o CO2
expirado ( CO2)
Reverte a alcalose respiratória
Acidose metabólica
Ex: Diarréia
[HCO3-]
SOLUÇÃO:
Hiperventilação consegue
reverter instantaneamente
a acidose metabólica
Hiperventilação
Acidose metabólica não compensada é raramente vista clinicamente
Alcalose metabólica
Ex: Vômito
[H+]
(elimina conteúdo do estômago)
hipoventilação
SOLUÇÃO:
Respiração lenta consegue reverter
instantaneamente a alcalose
metabólica
Distúrbios ácido-base
Distúrbios ácido-base
Equilíbrio ácido-base