UNIVERSIDADE FEDERAL FLUMINENSE
INSTITUTO BIOMÉDICO
DEPARTAMENTO DE MICROBIOLOGIA E PARASITOLOGIA
DISCIPLINA DE BACTERIOLOGIA
APOSTILA
DE
AULAS PRÁTICAS
- DISCIPLINA BACTERIOLOGIA
ORIENTADOR DIDÁTICO: PROFESSOR ALOYSIO CERQUEIRA
Roteiros de aulas Práticas
Material utilizado nas práticas
Técnicas e Processo de Assepsia
Microscopia
1
Meios de Cultura e Técnicas de Semeadura
2
Esterilização e Desinfecção
4
Diluição
Contagem de UFC viáveis
Obtenção de Cultura pura
6
Coloração Simples
Morfologia
7
Coloração de Gram
9
Identificação de Cocos Gram positivos
11
Provas Bioquímicas para Idenitifcação de Bacilos Gram Negativos
17
Teste de Sensibilidade a Antibióticos
20
Técnicas de Coloração
Coloração de Gram
Coloração de Zihel-Neelsen (BAAR)
Técnica Para Evidenciação de Espiroquetas
Método de Albert-Laybourn
22
25
27
30
Colimetria: Exame microbiológico da Água
31
ASSUNTO:
- Material utilizado nas práticas de Bacteriologia.
- Técnica e Processos de Assepsia em Bacteriologia.
- Microscopia.
OBJETIVOS:
1- Apresentar a vidraria e outros materiais de uso corrente em um laboratório de
Microbiologia.
2- Executar técnicas de preparo de material e montagem para esterilização.
3- Treinar técnicas de distribuição asséptica.
4- Evidenciar a existência de bactérias no ar, roupas, etc.
5- Explanação sobre o microscópio.
MATERIAL:
-
Vidrarias.
Outros materiais de uso em um laboratório de Microbiologia.
Água peptonada.
Placas de Petri com Agar simples.
Pipetas e tubos de ensaio estéreis.
Papel, barbante, algodão cardado, gaze.
PRÁTICA PARA EXECUTAR:
a. Apresentação da vidraria e outros objetos de uso freqüente nos laboratórios de
Microbiologia.
b. Demonstração, pelo professor, de uma cadeia de assepsia nos trabalhos
microbiológicos.
c. Cada grupo de alunos treinar, com água peptonada, as técnicas de distribuição
asséptica, usando pipetas. Deixar os tubos em temperatura ambiente por no mínimo 48
horas.
d. Expor placas de Agar simples (1 por grupo) ao ar por diferentes espaços de tempo.
Deixar à temperatura ambiente o mínimo de 48 horas.
e. Evidenciar bactérias da pele, roupa, bancada em meio Agar simples.
f. Montagem de vários materiais (tubos, placas, pipetas) para esterilização.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
1
ASSUNTO:
- Meios de Cultura
- Técnicas de Semeadura
OBJETIVOS:
1- Explanação sobre os principais meios de cultura empregados em laboratórios de
Microbiologia
2- Identificação das técnicas de semeadura mais empregadas na rotina
bacteriológica
3- Cultivo de bactérias com finalidade de obtenção de cultura pura, ou seja, uma
população onde todas as bactérias se originam de uma única célula bacteriana.
MATERIAL:
-
tubos de ensaio com caldo simples, Agar simples e Agar semi-sólido.
Placas de Petri com Agar simples.
Culturas bacterianas em caldo simples, Agar simples (em placa de Petri).
Alça e agulha de platina.
PRÁTICA PARA EXECUTAR:
Definir meio de cultura, cultivo e condições necessárias ao crescimento de
microorganismos (pH, pressão osmótica, temperatura de incubação, etc.).
Classificação dos meios de cultura quanto a origem, estado físico, força seletiva.
Seqüência da preparação dos meios.
TÉCNICAS DE SEMEADURA MAIS EMPREGADAS NA ROTINA
I- Semeadura em meios sólidos
A. Meio Inclinado
Em estria sinuosa: semear com alça de platina, em ziguezague, partindo da base para a
extremidade da superfície inclinada do meio
Este tipo de semeadura permite a obtenção de melhor massa de microorganismos.
Em estria reta: semear co agulha de platina, em estria reta, partindo da base para a
extremidade da superfície inclinada do meio, ou em profundidade e superfície.
Este tipo de semeadura é utilizada em provas bioquímicas para identificação bacteriana.
B. Meios em pé (camada alta)
Em picada: com agulha de platina fazer o inoculo penetrar de 0,5 a 1,0 cm no
centro do meio de cultura.
Este tipo de semeadura é bastante utilizado para conservação de bactérias no
meio de cultura e quando o meio utilizado é semi-sólido, esta semeadura é utilizada para
a verificação da motilidade.
2
C. Em Placa de Petri:
C.1. Em superfície
Estrias múltiplas ou esgotamento: fazer o inoculo em um ponto da superfície
do meio, flambar a alça, deixar esfriar e daí semear em ziguezague em toda a superfície
do meio.
Este tipo de semeadura é empregado para o isolamento bacteriano, obtenção de
u.f.c. isoladas.
Denomina-se técnica se esgotamento.
Por distensão: com pipeta, colocar no centro da superfície do meio 0,1 mL da
suspensão e espalhar uniformemente com swab ou alça de Drigalski.
Com swab, obteremos crescimento confluente. Com alça de Drigalski,
utilizamos para contagem.
Utiliza-se este tipo de inoculação para realização de determinados testes, como
por exemplo o antibiograma.
C.2. Em profundidade ou disseminação.
Pour plate: depositar na placa de Petri 0,1/ 1,0 mL da suspensão bacteriana.
Adicionar 10 mL do meio fundido em tubo de ensaio e resfriado a 45-50º C.
Homogeneizar com movimentos giratórios da placa sobre uma superfície plana.
Utilizado, para isolamento, contagem e identificação bacteriana, conforme o
meio de cultura utilizado.
D. Repique por pescaria: colônia em placa de Petri retirada através de uma
agulha para um meio de cultura líquido ou sólido
Método empregado para isolamento bacteriano.
II. Semeadura em meios líquidos
Difusão: com alça de platina ou pipeta, introduzir o inoculo ( 0,1 mL) na
massa do meio. Este tipo de semeadura é empregada para obtenção do crescimento
bacteriano. É um repique normal.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
3
ASSUNTO:
- Esterilização e Desinfecção
- Ação dos Agentes Físicos e Químicos sobre as Bactérias
Objetivos:
1. Verificar a eficiência de agente químico sobre as bactérias
2. Verificar a eficiência de agente físico sobre as bactérias
Material:
- Placas de Petri com agar simples ou caldo simples
- Culturas de E. coli e Bacillus sp
- Soluções antissépticas
- Gaze
- Tripé, tela de amianto e panela
Prática para executar
a. Definição de alguns termos utilizados no controle da população microbiana:
- agente antimicrobiano, assepsia, asséptico, antissepsia, bactericida,
bacteriostático, desinfecção, esterilização, germicida, saneador, sanitização
- agentes físicos: radiações, calor, filtração
- agentes químicos
b. Atividade antisséptica do sabão, álcool e álcool iodado:
Observação de existência de bactérias na superfície do dedo:
1. Pegar uma placa de Agar simples e fazer a semeadura utilizando a ponta do
polegar (fazer a impressão digital suavemente para não ferir a camada do meio
de cultura).
2. Em seguida, lavar o dedo com sabão .
3. Após 1 minuto, fazer a impressão digital no 2º quadrante da placa.
4. Repita a operação com os demais antissépticos.
5. Incubar a placa a 37º C por 24 horas.
1º
4º
2º
3º
c. Atividade do agente físico: calor
4
1. Cultura de E. coli em caldo. Para o primeiro inóculo , marcar t = zero, colocálo em água fervente por 5, 10 e 20 minutos.
2. Após cada intervalo de tempo retirar um inóculo marcando t5, t10,e t20. Incubar
a 37º C por 24 horas.
3. Repetir a técnica com a cultura de Bacillus sp.
0
5
10
20
d. Atividade de diferentes agentes químicos:
1.Semear uma cultura bacteriana com swab (para crescimento confluente) em
uma placa de Petri com agar simples.
2.Assepticamente, com pinça, embeber discos de papel de filtro com diferentes
agentes químicos.
3. Colocar os discos eqüidistantes na placa semeada.
4. Incubar a 37º C por 24 horas.
5. Leitura e interpretação dos dados obtidos.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
ASSUNTO:
5
- Diluição
- Contagem de u.f.c.viáveis
- Obtenção de Cultura Pura
Objetivos:
1. Metodologia de Diluições
2. Plaqueamento para contagem de u.f.c. viáveis
3. Contagem de u.f.c. viáveis
4. Obtenção de cultura pura
Material:
- Tubos com 9mL de salina
- Placas de Petri com Agar simples
- Alças de Drigalski
- Cubas com álcool 70º
- Agar inclinado
- Caldo simples
- Cultura bacteriana em caldo
- Pipetas de 1mL
Prática para executar
a. Diluição
A partir da cultura bacteriana, inocular 1mL em 9mL de salina, homogeneizar, retirar
1mL e transferir para outro tubo com 9mL de salina...
Obtendo assim, as diluições 1/10, 1/100, 1/1000...
b. De cada diluição inocular 0,1mL, em duplicata, na superfície do meio de Agar
simples. Semear por distensão com alça de Drigalski. Incubar a 37ºC por 24 horas.
c. Contagem da u.f.c. com diluição nº placa 1 + nº placa 2 aplicar na fórmula:
2
u.f.c. = nº encontrado x diluição x inoculo
d. Repicar u.f.c. para Agar inclinado e caldo simples.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
ASSUNTO:
- Coloração Simples
6
- Morfologia
Objetivos:
1. Identificação dos vários tipos de corantes de acordo com os diversos métodos de
coloração empregados em Bacteriologia.
2. Preparação de esfregaços partindo de meio líquido e de meio sólido.
3. Fixação de esfregaço por meios físicos e químicos.
4.Coloração simples.
5. Observar formas e arranjos bacterianos através de preparações fixadas e coradas.
Material:
- Azul de metileno ou fucsina
- Solução salina
- Lâminas
- Culturas em meios líquido e sólido
- Alça e agulha de platina
Prática para executar
1. Introdução da técnica sobre corantes, sua classificação (naturais, artificiais, básicos e
neutros) e quanto ao veículo. Técnicas de coloração simples, duplas e mistas.
2. Preparo de esfregaços e fixação por meios físicos e químicos.
a) Preparo das lâminas
As lâminas novas oferecem maior garantia para a confecção de boas preparações
coradas, não obstante as mesmas possam ser recuperadas depois de usadas. O processo
de limpeza e esterilização dessas lâminas implica numa série de medidas que
passaremos a enumerar: lavar com água e sabão, mergulhar em solução detergente e
deixar em ebulição por cerca de 1 a 2 horas, lavar novamente em água corrente, escorrer
e rinsar com água destilada, escorrer e secar. As lâminas devem ser colocadas em
frascos fechados contendo álcool.
As preparações coradas são feitas em 3 tempos:
1º esfregaço
2º fixação
3º coloração
b) Esfregaço
- Tirar do frasco uma lâmina esterilizada e enxugar bem
- Flambar, rapidamente, nos dois lados da lâmina
- Flambar a alça de platina ao rubro e deixá-la esfriar próximo à chama
- Tomar o tubo de cultura (em caldo) com a mão esquerda e com os dedos médio e
anular da mão direita remover o tampão de algodão da boca do tubo
-Flambar a boca do tubo de cultura
- A alça de platina, segura entre o polegar e o indicador da mão direita, será introduzida
no interior do tubo até tocar no meio de cultura
- Flambar novamente a boca do tubo
- Fechar o tubo com o tampão de algodão e colocá-lo na estante
7
- Tomar a lâmina com a mão esquerda e depositar no centro da mesma uma gotícula
(uma ´alçada``) da suspensão bacteriana
- Com movimentos de rotação da alça de platina, o material deve ser bem espalhado a
fim de se obter um esfregaço de forma oval, bem fino e uniforme
- Deixar secar ao ar e marcar com lápis dermatográfico do lado oposto onde se situa a
preparação
Em se tratando de material de cultura em meio sólido, deve ser observado o seguinte:
- Depositar uma pequena gota de água destilada ou solução fisiológica estéril no centro
da lâmina
- Tocar a colônia com uma agulha de platina esterilizada e suspender a mesma na
gotícula d`água, de forma a obter um esfregaço fino e uniforme
c) Fixação do material
A fixação evita que o material se desprenda no decurso das manipulações posteriores.
Pode ser feita por:
# Agentes Físicos (calor) – consiste em passar a lâmina, com a face onde se acha o
esfregaço para cima, na chama do bico de Bunsen 2 a 3 vezes rapidamente
# Agentes Químicos – utiliza-se uma substância química como álcool metílico, álcool
etílico, álcool-acetona, éter-acetona, formol etc., deixando-se em contato com os
esfregaços dessecados durante alguns minutos (2 a 10 minutos).
O fixador pode ser posto sobre o esfregaço convenientemente protegido contra a
evaporação rápida, ou então o preparado será mergulhado no fixador contido em
recipientes apropriados.
3. Coloração Simples , Método fixado e corado
a. Preparo do esfregaço
b. Fixação
c. Coloração
Cobrir o esfregaço com a solução de azul de metileno ou fucsina diluída durante 5
minutos . Lavar, secar com papel de filtro e observar com objetiva de imersão.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
ASSUNTO:
- Coloração de Gram
8
OBJETIVOS:
1. Observar e interpretar o mecanismo de reação de Gram como um método de
coloração diferencial.
2. Discutir as várias etapas da metodologia e a importância taxonômica do método na
Bacteriologia.
MATERIAL:
- Lâminas.
- Culturas em meios líquido e sólido.
- Alça e agulha de platina.
- Cristal violeta.
- Lugol.
- Álcool etílico.
- Fucsina de Ziehl.
PRÁTICA PARA EXECUTAR
COLORAÇÃO DE GRAM (MÉTODO CLÁSSICO)
a. Preparar um esfregaço fino, secar a temperatura ambiente e fixar pelo calor.
b. Cobrir o esfregaço seco e fixado com a solução de cristal violeta (corante) durante 1
minuto.
c. Esgotar a lâmina e cobrir com lugol (mordente) durante 1 minuto.
d. Inclinar a lâmina 45° e lavar em água corrente.
e. Mantendo-a inclinada, diferenciar (lavar) com álcool 95° GL (diferenciador).
f. Lavar e depois cobrir a preparação com solução diluída de fucsina de Ziehl (contracorante) (15 a 30 segundos).
g. Lavar e secar entre duas fitas de papel de filtro, delicadamente.
h. Colocar uma gota de óleo de cedro no centro do esfregaço.
i. Observar com a objetiva de imersão.
Vi
Lulu
Cristal Lugol
Violeta
Ali
A
Álcool Água
Fumar
Algo
Fucsina
Água
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
9
Notas:
1. O etanol poderá ser usado como agente descorante fraco.
2. O material dos corantes empregados na técnica, principalmente sedimento do cristal
violeta poderá aparecer como artefato.
3. O descoramento para mais ou para menos é resultante de incorreta diferenciação pelo
álcool.
4. A idade da cultura bacteriana tem importância fundamental na coloração de Gram.
Em culturas envelhecidas, células Gram-positivas freqüentemente se tornam Gramnegativas. Enzimas líticas excretadas normalmente por culturas envelhecidas podem
causar danos à membrana da célula, como por exemplo, alterando a permeabilidade dos
solventes. Conseqüentemente, o complexo iodo-cristal violeta poderá ser retirado da
célula.
5. Se houver um questionamento acerca da Gram-positividade ou Gram-negatividade da
cultura, uma coloração de Gram paralela é aconselhável. Para isto, deve-se usar culturas
bacterianas conhecidas como G+ (Staphylococcus aureus) e G- (Escherichia coli) como
controle.
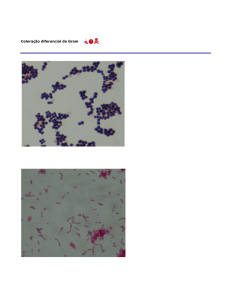
Interpretação: Bactérias G+ coradas em roxo.
Bactérias G- coradas em vermelho.
O mecanismo da coloração de Gram se refere a composição da parede celular,
sendo que as G+ possuem uma espessa camada de peptideoglicano e ácido teicóico, e as
G-, uma fina camada de peptideoglicano, sobre a qual se encontra uma camada
composta por lipoproteínas, fosfolipídeos, proteínas e lipopolissacarídeos. Durante o
processo de coloração, o tratamento com álcool (ou álcool-acetona) extrai os lipídeos,
daí resultando uma porosidade ou permeabilidade aumentada da parede celular das G-.
Assim, o complexo cristal violeta-iodo (CV-I) pode ser retirado e as G- são descoradas.
A parede celular das bactérias G+, em virtude da sua composição diferente, torna-se
desidratada durante o tratamento com álcool, a porosidade diminui, a permeabilidade é
reduzida e o complexo CV-I não pode ser extraído.
Outra explicação baseia-se também em diferenças de permeabilidade entre os dois
grupos de bactérias. Nas bactérias G+, o complexo CV-I é retido na parede após o
tratamento pelo álcool, o que causa, provavelmente, uma diminuição do diâmetro dos
poros da camada de glicopeptídeo ou peptideoglicano da parede celular. Os poros da
parede das bactérias G- permanecem suficientemente grandes, mesmo depois do
tratamento pelo álcool, possibilitando a extração do complexo CV-I.
Segundo Trabulsi, na etapa diferencial com o álcool, as bactérias G- devido à
pequena espessura da camada basal e às descontinuidades existentes nesta camada, em
pontos de aderência entre a membrana externa e a membrana celular, têm o complexo
corado extraído pelo álcool que deixa as células descoradas.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
10
______________________________________________________________________
ASSUNTO:
- Cocos Gram-positivos
OBJETIVOS:
1. Isolamento de bactérias das vias aéreas superiores.
2. Identificação bioquímica através da interpretação do metabolismo microbiano.
MATERIAL:
- cultura de Staphylococcus aureus e Staphylococcus epidermidis
- Placas de Chapman
- Tubos de caldo simples
- Tubos com plasma citratado
- Tubos com Agar simples
- Tubos com água destilada estéril
- Placas DNAse
- Bateria de Gram
- Água oxigenada a 30%
- Swabs
- Solução salina estéril
- Lâminas, alças...
- Microscópio
PRÁTICA PARA EXECUTAR
1º DIA:
a.
b.
inocular swab de orofaringe em Caldo Hitchens-Pike
inocular swab de nasofaringe em Agar Chapman pela técnica de esgotamento
2º DIA:
semear material do crescimento em Hitchens Pike em placa de Agar Sangue, pela
técnica de esgotamento
inocular a UFC típica de Staphylococcus nas provas bioquímicas (catalase,
coagulase e DNAse)
realizar a coloração de Gram
3º DIA:
a.
leitura e einterpretação da placa de Agar Sangue
leitura e interpretação das provas bioquímicas
Identificação das bactérias de importância médica
material de colheita: secreções, líquidos biológicos e outros
11
Cocos Gram positivos aeróbios
Dentre as duas famílias conhecidas (Microcacceae e Streptococcaceae), trataremos dos
gêneros e das espécies de interesse à patogênese das infecções.
I. Staphylococcus
Este gênero, membro da família Micrococcaceae, é constituído de várias espécies,
sendo três de maior interesse humano (S. aureus, S. epidermidis, S, saprophyticcus).
São microorganismos esféricos, imóveis, gram positivos, que crescem em cachos.
Causam diferentes doenças supurativas tais como: furúnculo, impetigo, osteomielite,
abcessos de tecidos, pneumonia, meningite, artrite purulenta, etc. Algumas amostras (S.
aureus) produzem uma “enterotoxina” que provoca um quadro agudo de intoxicação
alimentar, enquanto outros (S. aureus e S. saprophyticcus) causam infecções do trato
urinário. São membros normais da microbiota anfibiôntica da pele e membranas
mucosas.
A colheita do material deve ser realizada com o máximo de assepsia: swab de
nasofaringe, fezes, urina. Em se tratando de sangue, este deverá ser colhido com
heparina, ou ser desfibrinado, nunca utilizar citrato de sódio, pois o sódio inibe G +,
principalmente em pH próximo a 6.
São inibidos pela presença de corantes do tipos Azul de Metileno e Violeta de
Genciana. Crescem em meio de Agar Simples, Agar Sangue e Chapman. Suas colônias
são redondas, elevadas, opacas e de coloração amarelo-dourado a branco. Cresce em
presença de altas concentrações de NaCl, sendo este um fator de estimulação da
produção da enzima coagulase.
O meio Chapman é seletivo, porque contém 7,5% de NaCl; é indicador porque
possui manitol e o indicador Vermelho de Fenol, as UFCs fermentadoras do manitol
apresentam-se com coloração amarelas após 24 – 48 horas de incubação a 37ºC. Após o
crescimento de colônias típicas fazemos a coloração de Gram para observarmos a
presença de cocos Gram + dispostos em grupos (cachos) ou isolados.
Diferenciamos o gênero Staphylococcus do gênero Streptococcus através da prova
da catalase. A diferenciação das espécies do gênero se dá através das provas de
fermentação do manitol, da coagulase, da DNAse, da sensibilidade a novobiocina e da
redução de nitratos.
Provas bioquímicas
- Prova da Catalase:
A catalase é uma enzima responsável pela neutralização de formas tóxicas do
oxigênio ao microorganismo (peróxidos e superóxidos).
Na prova, é utilizado o peróxido de hidrogênio (H2O2). Se o microorganismo
produzir catalase, o H2O2 (água oxigenada) será degradado em H2O e ½ O2 (oxigênio
molecular). A reação é observada através do desprendimento de bolhas gasosas (O2) da
cultura após a adição de água oxigenada a 30%.
A prova pode ser realizada com o microorganismo obtido em qualquer meio de
cultura.
- Fermentação do Manitol:
O manitol é um açúcar que alguns microorganismos são capazes de utilizar como
fonte de energia,a través da fermentação. A prova se baseia na alteração do pH do meio,
12
graças a produção de ácidos durante o processo de fermentação. Essa mudança de pH
pode ser observada pela viragem de cor do meio devido a presença do indicador de pH
Vermelho de Fenol. A prova pode ser realizada em meios de cultura líquidos ou sólidos.
Após a semeadura, o meio deve ser incubado a 37ºC por 18 – 24 horas.
Interpretação:
positivo: amarelo
negativo: não há alteração da cor
- Prova da coagulase:
A coagulase estafilocócica se apresenta em duas formas: coagulase ligada e
coagulase livre.
A coagulase ligada, presente na parede da célula bacteriana, converte o
fibrinogênio em fibrina diretamente, sem o envolvimento dos fatores de coagulação, e
pode ser detectado em teste direto em lâmina, utilizando-se da suspensão de
Staphylococcus acrescida de 2 gotas de plasma citratado, fazendo movimentos
circulares e observando-se a formação de coágulo no tempo de 1-2 minutos. Pode-se
tornar mais sensível o teste em tubo, por este detectar tanto a coagulase livre quanto a
ligada, sendo a prova de escolha.
A coagulase livre é produzida e liberada pelo microorganismo, reagindo com o
fator de coagulação do plasma, CRF, formando uma substância semelhante, mas não
idêntica, à trombina, que converte fibrinogênio em fibrina. Para o teste, utiliza-se
plasma citratado humano ou de coelho, estéril, diluído em solução salina na proporção
de 1:5. a reação ocorre volume a volume a 37ºC.
Estudos recentes demonstraram que a produção da enzima coagulase se intensifica
quando o microorganismo é crescido e meio contendo alta concentração de NaCl. Desta
forma, aconselha-se a utilização de colônias para a prova, crescidas em Agar Manita
(Agar Manitol Salgado) contendo NaCl e Vermelho de Fenol. Este procedimento
aumentaria a sensibilidade do teste.
A prova consiste da semeadura de uma alçada do microorganismo em estudo em
tubo contendo o plasma diluído e incubação a 37ºXC. A menor coagulação é
considerada positiva. Devem ser feitas leituras periódicas a cada 2 horas, por até 24
horas, pois algumas espécies produzem fibrinogênio, que dissolve o coágulo formado.
Aconselha-se também utilizar sempre um teste positivo com uma amostra de S.
aureus.
- Prova da DNAse:
Alguns microorganismos são capazes de utilizar o DNA presente no meio como
fonte de energia, através da produção da enzima DNAse.
No meio com DNA deve ser feita uma estria simples (reta) ou um spot (ponto de
semadura) central com o microorganismo em estudo. Incubar a 37ºC por 24 horas e
adicionar ao meio HCl 1N e aguardar a turvação do meio.
Lembrando que o DNA é material protéico e que o HCl, como ácido, tem poder
desnaturante sobre as proteínas, a turvação do meio é apenas a precipitação do DNA
desnaturado. Se a bactéria produzir DNAse, todo o DNA ao seu redor terá sido
degradado, então ao adicionar o HCL não haverá turvação nesta área. Portanto, se
houver um halo claro ao redor do crescimento bacteriano, o resultado é positivo.
- Sensibilidade a Novobiocina
13
Semear o microorganismo suspeito em placa de Agar simples ou Mueller Hinton
com swab, para obtenção de crescimento confluente, e adicionar o disco de novobiocina
(5g/ml). Incubar a 37ºC por 24 horas. As bactérias resistentes não apresentarão halo de
inibição, enquanto as sensíveis sim.
Interpretação das provas bioquímicas
Provas bioquímicas
Catalase
Fermentação do manitol
Coagulase
DNAse
Sensibilidade a novobicina
Redução de nitratos
S. aureus
+
+
+/+
R
S. epidermidis
+
S
+
S. sapophyticus
+
R
-
I. Streptococcus
O gênero apresenta espécies de interesse médico, como: Streptococcus viridans e
Streptococcus pneumoniae. Apresentam-se em forma de cadeia ou em pares, e são
Gram positivos.
Os Streptococcus foram descritos em 1874 por Billroth, causando exsudato
purulento em lesões de erisiplela e em feridas infectadas. Em seguida, foram isolados do
sangue de pacientes em estado febril, e da garganta de crianças com escarlatina.
Em 1903, Schottmuller propôs que os estreptococos fossem classificados
conforme a capacidade de lisar hemácias “in vitro”. Em 1919, Brown chamou de , e
as lises observadas nas hemácias em placas de Agar sangue.
Os estreptococos hemolíticos apresentam zonas de hemólise parciais, com
hemácias integras na parte mais interna (junto à colônia) e hemólise maior na parte mais
externa. Frequentemente aparece uma coloração esverdeada na área de hemólise
(devido a alteração da hemoglobina pelo sistema oxi-redutor da célula bacteriana), que
originou a qualificação “estreptococos do grupo esverdecente” ou Streptococcus
viridans. O Streptococcus pneumoniae apresentam hemólise e colônia puntiforme
com aprofundamento no ápice da colônia (parecendo um pequeno vulcão)
Os estreptococos hemolíticos produzem uma zona de hemólise total,, não se
observando hemácias íntegras (microscópio óptico com objetiva de 10x). O
Streptococcus pyogenes apresenta dois tipos de hemolisinas: O e S a hemolisina O é
destruída pela ação do oxigênio atmosférico, e, portanto, só demonstrada em colônias
crescidas em profundidade no Agar Sangue. A hemolisina S é estável ao oxigênio do ar
e produz hemólise mesmo nas colônias crescidas na superfície do meio de cultura.
Como cerca de 15% dos Streptococcus apresentam hemolisina O, se torna necessária a
semeadura do microorganismo pela técnica do pour-plate.
Os estreptococos são anemolíticos, ou seja, não produzem hemólise nomeio.
Cultura (“pour plate”)
Fazer uma suspensão do material colhido em um tubo contendo 1 ml de solução
fisiológica estéril e adicionar a uma placa de Petri estéril. Juntar o Agar Sangue fundido
e resfriado e promover a difusão do inóculo no meio através de movimentos circulares.
14
Incubar a 37ºC por 18 horas em atmosfera de microaerofilia ara melhor rendimento, ou
jarra com vela.
Leitura
Observação do tipo de hemólise em Agar Sangue.
Provas bioquímicas
- Prova da optoquina:
Colocar um disco de optoquina na superfície do Agar Sangue (pode-se incluir no
antibiograma). Havendo impedimento do crescimento das colônias ao redor do disco de
optoquina (2 cm de diâmetro), trata-se de teste positivo.
- Bile solubilidade:
A prova é realizada conforme esquema que se segue:
a 1,0 ml de cultura em calo, adicionar uma gota de vermelho de fenol
acertar o pH em aproximadamente 7,5 com NaOH 0,1N (cor rósea)
adicionar aproximadamente 4 gotas de desoxicolato de sódio ou bílis
incubar juntamente com o tubo sem bílis a 37ºC por 3 horas
* clareamento: positivo
* inalterado: negativo
- Bacitracina:
Utilizar discos impregnados com bacitracina (0,04 U) colocados na superfície do
meio de cultura semeado com o microorganismo em estudo (pode-se incluir no
antibiograma) e incubar a 37ºC por 24 horas em microaerofilia.
* Grupo A: sensível a bacitracina
* demais grupos: resistentes
- Crescimento a 56ºC:
15
Para evitar dúvidas entre estreptococos e enterococos (Streptococcus faecalis),
submeter a cultura a um aquecimento a 56ºC por 30 minutos. Somente os enterococos
resistem a este tratamento.
- Crescimento em Agar Chapman:
Os enterococos toleram altas concentrações de NaCl, como acontecem com
Staphylococcus.
- Crescimento em Agar EMB:
Os enterococos suportam a presença de corantes, como o azul de metileno
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
ASSUNTO:
- Provas Bioquímicas para a Identificação de Bacilos Gram-negativos
OBJETIVO
Identificar enterobactéria em gêneros ou espécies, utilizando-se para isso vários
meios de cultura especiais, de acordo co o esquema a seguir:
1. Plaqueamento Seletivo
Etapa de isolamento bacteriano a partir de espécies clínico, utilizando meios
seletivo-indicadores como o Agar EMB. Neste meio as bactérias Gram positivas são
inibidas pela presença de eosina e azul de metileno. As bactérias Gram negativas
fermentadoras de lactose ( LAC + ) apresentam-se como colônias rosa-avermelhadas
com ou sem centro negro, enquanto as não-fermentadoras ( LAC - ) formam colônias
transparentes.
16
2. Triagem
Conjunto de provas bioquímicas realizadas simultaneamente em 1 ou 2 meios,
permitindo uma diferenciação inicial dos isolamentos e direcionamento da
contaminação bioquímica. Quando realizada em meio TSI, podemos observar:
- Fermentação de glicose e produção de gás
- fermentação de lactose e/ou sacarose
- produção de H2S
Bactérias que utilizam apenas glicose provocam acidificação (de coloração
amarela) apenas na base, permanecendo o ápice alcalino (de cor avermelhada).
Bactérias fermentadoras de lactose e/ou sacarose acidificam todo o meio. A formação
de gás é evidenciada pelo rompimento ou descolamento do meio. A produção de H2S se
manifesta pelo escurecimento do meio.
3. Confirmação Bioquímica
Conjunto de provas necessárias para a identificação bioquímica das colônias
suspeitas. Algumas dessas provas estão descritas abaixo:
a. Fermentação de Carboidratos: glicose, lactose, manitol, sacarose.
A utilização dos carboidratos leva à formação de ácidos, com viragem do indicador
(vermelho de fenol) para cor amarela. A partir da glicose podemos observar também a
produção ou não de gás (CO2, H2) no interior do tubo de Durha.
A inoculação é realizada a partir de cultura bacteriana overnight (+/- 18h) em
Agar. Incubar por 24 horas a 37ºC.
Leitura: cor amarelada = + (positivo)
sem alteração
b. VM: Verifica a ocorrÊncia de fermentação ácido-mista ( glicose→ ácidos
estáveis).
Meio: Clark & Lubs.
Inoculação: idem ao item a. Após incubação ( 48 h ), adicionar 3 – 5 gotas do
reativo de VM ( vermelho de metila → alcalino = amarelo pálido / ácido = vermelho).
Leitura: Cor vermelha = +
Cor amarela = c. VP ( Voges & Proskauer ): verifica a ocorrência de fermentação acetoínica
(glicose→acetoína).
Meio: Clark & Lubs (meio glicosado e tamponado).
Inoculação: idem ao item a. Após inoculação (48 h), adicionar os reativos:
VP I (Barrit I): alfa-naftol (0,6 mL)
VP II ( Barrit II): KOH 40% (0,2 mL)
Leitura (após 10 – 15 minutos):
*observar o aparecimento de anel vermelhos na superfície do tubo
(resultado positivo)
*sem alteração: resultado negativo
d. Citrato: verifica a utilização do citrato como única fonte de carbono.
17
Meio: Citrato de Simmon.
Inoculação: idem ao item a.
Leitura:
meio azulado = sem crescimento = e. Indol: verifica a produção de triptofane, que quebra triptofano, liberando indol,
este é revelado com o reativo de Kovacs, observa-se a formação de um anel
escarlate na superfície do meio.
Meio: Caldo semi-sólido (SIM).
Inoculação: idem ao item a. após a inoculação, adicionar 5 gotas do Reativo de
Kovacs.
Leitura: cor rosa = +
sem alteração = f. Mobilidade: verifica se a bactéria é móvel ou imóvel.
meio: Agar semi-sólido (SIM).
Inoculação: utilizar agulha bacteriológica, fazendo uma picada central até ¾ da
profundidade do tubo.
Leitura: crescimento fora do local da picada = + (móvel)
crescimento somente ao redor da picada = - (imóvel)
g. Nitrato: verifica a capacidade de redução do nitrato ( NO3) à nitrito (NO2).
Inoculação: idem ao item a. Após incubação, adicionar 3 a 5 gotas dos reativos:
Nitrato A: alfa naftilamina
Nitrato B: ácido sulfanílico
Leitura: cor vermelha (violácea, escarlate) = + (liberação de NH3)
sem alteração = h. Uréia: meio contendo uréia para verificar a produção da enzima uréase.
Inoculação : idem ao item a.
Leitura: cor vermelha (violácea, escarlate) = + (liberação de NH#)
sem alteração = RESULTADO ESPERADOS NOS TESTES BIOQUÍMICOS
CARACTERÍSTICA
EMB
TSI
H2S
Glicose
Gás
Lactose
Sacarose
E. coli
Salmonella
Klebsiella
Proteus
Lac +
ác/ác
+
+
+
V
Lac alc/ác
+
+
+
-
Lac +
ac/ac
+
+
+
+
Lac –
álc/ác ou ac/ac
+
+
+
V
18
Manitol
+
+
+
V
VM
+
+
+
+
VP
Citrato
V
+ (5 dias)
Indol
+
V
Mobilidade
V
+
+
Nitrato
+
+
+
+
Uréia
V
+
Tabela 1 – Identificação bioquímica de alguns gêneros de enterobactérias.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
ASSUNTO:
- Teste de Sensibilidade a Antimicrobianos (TSA)
Método de Kirby-Bauer
OBJETIVOS:
1. Determinar a sensibilidade de uma bactéria frente a antimicrobianos, para a escolha
da droga mais adequada no tratamento de uma doença.
2. Interpretar um antibiograma.
MATERIAL:
- cultura recente do microorganismo em teste
- discos com antimicrobianos
- placas com Agar Mueller-Hinton
- swabs estéreis
- pinças, régua graduada
PRÁTICA PARA EXECUTAR:
1. Inóculo:
19
Cultura pura, em fase log, padronizado, diluída até obtenção de turvação semelhante ao
tubo nº 0,5 da escala de McFarlnd (1,0x108)
2. Meio
Mueller-Hinton, recente, em camada de 4 – 5 mm, pH = 7,2 – 7,4, com umidade
adequada. Em alguns casos pode ser enriquecido com 5% de sangue, etc.
3. Semeadura
Inocular a cultura a ser testada na superfície do agar, com o auxílio de um swab, para
um crescimento confluente.
4. Antimicrobianos
Com o auxílio de uma pinça flambada, aplicar os discos com antimicrobianos sobre o
meio recém-semeado de modo eqüidistante.
Identificar a placa e incubar a 37°C por 18 – 24 horas em posição invertida.
Ocorrerá difusão das substâncias e suas concentrações diminuem gradativamente a
medida que se afastam do disco.
A eficiência de uma droga é demonstrada pelo aparecimento de um halo de inibição do
crescimento do microorganismo.
5. Leitura
Com o auxílio de uma régua graduada, medir o diâmetro dos halos de inibição,
incluindo o diâmetro do disco.
6. Interpretação
Interpretar a sensibilidade aos antimicrobianos de acordo com o diâmetro do halo de
inibição encontrado em tabelas padronizadas que contém os valores em mm, para as
drogas disponíveis comercialmente.
7. Controle
Usar como controles os seguintes microorganismos, de acordo com as drogas utilizadas:
- Staphylococcus aureus ATCC 25923
- Escherichia coli ATCC 25922
- Pseudomonas aeruginosa ATCC 27853
Antimicrobiano
Ampicilina (AM)
Ácido Nalidíxico (NA)
Cloranfenicol (C)
Sulfa-Trimetropim (STX)
Cefoxitina (CT)
Eritromicina (ERI)
Estreptomicina
Cefalotina
Polimixina
Sulfazotrim
Potência
0,01 mg
0,03 mg
0,03 mg
0,03 mg
Diâmetro do halo de inibição
R
I
S
≤ 11
12 – 13
≥ 14
≤ 13
14 – 18
≥ 19
≤ 12
13 – 17
≥ 18
≤ 10
11 – 15
≥ 16
≤ 14
15 – 17
≥ 18
≤ 13
14 – 22
≥ 23
≤ 11
12 – 14
≥ 15
≤ 14
15 – 17
≥ 18
≤8
09 – 11
≥ 12
≤ 10
11 – 15
≥ 16
Notas:
20
1. leituras de 4 e 6 horas poderão ser feitas em caso de emergência, mas leituras
definitivas deverão ser feitas somente após o tempo estipulado (18 – 24 horas)
2. Não usar sinais para expressar os resultados. Usar as letras “S” para os
microorganismos sensíveis e “R” para os microorganismos resistentes.
3. Lembrar que um halo de inibição maior que outro não indica propriamente uma
maior atividade do antibacteriano sobre o microorganismo em teste. Outros fatores,
como carga antibiótica, difusibilidade, etc., intervêm na formação dos halos. Portanto,
deve ser utilizada a tabela na interpretação dos resultados.
4. Atualmente, no intuito de minimizar erros de interpretação, considera-se a
sensibilidade intermediária como resistente.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
21
ANEXO I
TÉCNICAS DE COLORAÇÃO
A utilização de corantes em microbiologia é atribuída a Goeppert e Cohn (1849).
Os corantes empregados, geralmente derivados da anilina, têm fórmula
quimicamente complexa, e são obtidos por síntese; quase sempre são sais de potássio ou
de sódio, sendo classificados em: naturais, entre os quais podemos citar o carmim e a
hematoxilina, e artificiais, que se dividem em: básicos ou nucleares, ácidos ou
citoplasmáticos e neutros.
As células bacterianas são ricas em ácido nucléico, conduzindo cargas negativas
sob a forma de grupamentos fosfato, e estes se combinam com os corantes básicos, que
são carregados positivamente. Os corantes ácidos não coram as células bacterianas, e
por isso podem ser utilizados para corar o material de fundo com uma cor contrastante.
As soluções corantes são classificadas quanto ao veículo nos seguintes grupos:
soluções aquosas, soluções hidroalcoólicas e soluções hidroalcoólicas mordentes.
Utilizam-se as soluções aquosas quando se quer preservar a vitalidade dos
microorganismos. A adição de substâncias mordentes tem a vantagem de preservá-las
da contaminação mais ou menos estável entre ambas, como exemplos de substâncias
que funcionam como mordentes citamos o fenol, iodo, formol e tanino.
As colorações podem ser simples, quando utilizamos um só corante, duplas e
mistas. Assim podemos ter uma noção da morfologia dos germes utilizando uma
coloração simples, e de outras informações com o emprego de técnicas especiais de
coloração, como por exemplo para diferenciar flagelos, cápsulas, paredes celulares,
membranas celulares, grânulos, núcleos e esporos.
I.
MÉTODO DE GRAM (DIFERENCIAL)
Esse método de coloração é importante em taxonomia bacteriana.
Desde sua descoberta (1884) foi intensamente estudado e muitas modificações
propostas sem, contudo, modificar a idéia original.
A reação de Gram depende do estado fisiológico da célula, enquanto que as culturas
jovens respondem melhor a diferenciação tintorial, as culturas velhas tendem a perder a
capacidade de retenção do corante, levando um Gram positivo a se apresentar como
Gram variável.
A explicação do mecanismo de coloração de Gram baseia-se em diferenças existentes
na composição da parede celular das bactérias Gram positivas e Gram negativas.
As bactérias Gram positivas contém, na parede celular, glicopeptídeos e ácido teicóico,
enquanto que as bactérias Gram negativas possuem glicopeptídeos e
lipopolissacarídeos, lipoproteínas e fosfolipídeos.
A coloração de Gram inicia-se com a aplicação de cristal violeta, a seguir aplica-se
lugol (solução de iodo), que sendo um mordente, fixa o cristal violeta a célula formando
com ele um complexo denominado iodopararosanilina. Até esta etapa, todas as bactérias
estão roxas.
22
Ao lavarmos as células com a solução de álcool-acetona, álcool-éter ou ainda álcool
puro, as bactérias G- são descoradas, enquanto que as G+ retêm o complexo
iodopararosanilina, devido a sua parede celular funcionar como uma barreira a eluição
do complexo corante pelo álcool.
Aparentemente, o álcool dissolve os lipídeos da parede das bactérias G- aumentando a
sua permeabilidade e facilitando a saída do complexo iodopararosanilina, enquanto que
nas bactérias G+ o álcool age como desidratante, diminuindo a porosidade e a
permeabilidade e, consequentemente, retendo o complexo.
Essa explicação é apoiada na observação de que protoplastos obtidos no tratamento de
bactérias G+ por lisozima não retêm o complexo corante. A menor espessura da parede
celular das bactérias G- também pode facilitar; porém é importante a observância do
tempo de uso do diferenciador neste método, pois um descoramento de tempo superior a
15 segundos acarreta o descoramento, inclusive, das bactérias G+.
Em geral, todos os cocos são G+, com exceção do gênero Neisseria e todos os
bastonetes são G-, exceto o gênero Bacillus (aeróbio, esporulado), Clostridium
(anaeróbio), Corynebacterium, Listeria e Lactobacillus.
O gênero Mycobacteriaceae, embora sendo considerado G+ por alguns autotes, cora-se
irregularmente.
Os vibriões são G- e as leveduras coram-se como as bactérias G+.
O método de Gram não se aplica as bactérias espiraladas.
Este método é de grande importância na sistemática bacteriana, pois através dele
podemos classificar as bactérias em dois grupos: bactérias Gram positivas (roxas) e
bactérias Gram negativas (rosas).
OBJETIVOS
1. Avaliação da importância taxonômica do método de Gram;
2. Interpretação da ação e função dos reagentes.
Técnica:
A. Preparação do esfregaço:
Lâmina nova ou estocada em álcool.
Flambar no bico de Bunsen.
Deixar esfriar.
Cultivo em meio líquido
Transferir assepticamente com alça os microorganismos, colocando o inoculo no
centro da lâmina e espalhar (aproximadamente 1,0 a 1,5 cm);
Secar ao ar livre até evaporação total (ou na chama sem aquecer em demasia);
Fixar a preparação passando a lâmina na chama do bico de Bunsen 3 vezes
(repetir esta etapa quantas vezes forem necessárias, sem aquecer a lâmina em
demasia);
Deixar a lâmina esfriar antes de iniciar a técnica de coloração.
23
Cultivo em meio sólido
Colocar uma gota de água destilada estéril, solução salina ou meio líquido
estéril no centro da lâmina;
Tocar, assepticamente, com agulha estéril uma colônia.
Homogeneizar o material colhido no líquido da lâmina, espalhando a
suspensão;
Secar, fixar e esfriar como citado acima.
B. Coloração Simples:
1. Fazer um esfregaço com suspensão bacteriana;
2. Cobrir o esfregaço com qualquer corante por 1 minuto (fucsina, azul de
metileno, violeta de genciana e cristal violeta);
3. Lavar com água;
4. Secar com papel de filtro (sem esfregar);
5. Observar ao microscópio óptico com objetiva de imersão e iluminação forte.
C. Coloração Dupla: Método de Gram:
1. Fazer um esfregaço fino como descrito anteriormente;
2. Fixar a lâmina pelo calor – o calor provoca a termocoagulação das proteínas,
com aderência do material à lâmina e morte do microorganismo. Esfriar;
3. Corar cobrindo a lâmina com solução de cristal violeta ou violeta de genciana
durante 1 minuto;
4. Desprezar o excesso de corante e adicionar lugol por 1 minuto (mordente);
5. Lavar com água;
6. Diferenciar rapidamente com álcool-acetona por aproximadamente 10 a 15
segundos (diferenciador);
7. Lavar com água imediatamente, para evitar que o diferenciador continue agindo;
8. Corar com fucsina diluída por 30 segundos (2º corante);
9. Lavar com água;
10. Secar entre 2 folhas de papel de filtro (sem esfregar);
11. Examinar utilizando objetiva de imersão, óleo de cedro e iluminação forte.
D. Interpretação de resultados:
Microorganismos Gram positivos: azuis-arroxeados (com parede celular mais
espessa e sem lipídeos).
Microorganismos Gram negativos: vermelhos/rosas (com parede celular mais
fina e com lipídeos).
Soluções reagentes:
1. Cristal violeta:
- Cristal violeta
- Álcool a 95°
- Água
1,0g
10mL
100mL
24
2. Lugol:
- Iodo
- Iodeto de potássio
- Água
1,0g
10mL
300mL
3. Fucsina:
- Fucsina básica
- Fenol
- Álcool a 95°
- Água
0,3g
5,0g
10mL
100mL
Deverá ser diluída 1:10 para ser utilizada no método de Gram. Existem várias
modificações introduzidas no método visando melhora-lo, uma das utilizadas é a de
Kopeloff-Beermann. Com adição de bicarbonato de sódio à solução de cristal violeta e a
substituição da solução de fucsina por safranina. As principais vantagens deste método
modificado: não irão sofrer interferência de pH (como a acidez do pus) e, preservar as
bactérias G+ que se descoram facilmente (Gram lábeis).
4. Álcool-acetona proporção 1:1.
II. TÉCNICAS DE COLORAÇÃO ZIEHL-NEELSEN
As micobactérias constituem um grupo que causa doenças no homem e nos
animais superiores. No homem essas doenças variam de infecções superficiais até a
tuberculose. Atualmente, constituem um dos maiores problemas em países
desenvolvidos, podendo causar, além da tuberculose bovina, a Doença de Johne e
doenças em roedores, répteis, peixes e galinhas.
As micobactérias são microorganismos encontrados com facilidade no meio ambiente,
com exceção do Mycobacterium tuberculosis e M. leprae. Pertencem ao gênero
Mycobacterium e se apresentam como bacilos longos, delgados, retos ou ligeiramente
encurvados, imóveis e aeróbios. São bacilos álcool-ácido resistentes (BAARs)
apresentam crescimento lento e alto conteúdo lipídico na parede celular. Algumas
espécies podem crescer em meios simples, mas em geral, os meios são complexos,
como o de Lowenstein – Jensen, apresentando crescimento macroscópico após 3 a 4
semanas de incubação à 37º C. Neste gênero, duas espécies produzem doenças
importantes: Mycobacterium tuberculosis e M. leprae, as demais são denominadas
atípicas e divididas em 4 grupos (grupos de Runyon I, II, III e IV).
M. tuberculosis é o agente etiológico da tuberculose, esta pode se apresentar em
diversas formas clínicas, sendo a mais comum a pulmonar (cerca de 80%), a única
forma clínica contagiosa. O teste confirmativo para diagnóstico da tuberculose é a
demonstração do M. tuberculosis em material clínico colhido do paciente suspeito,
através de baciloscopia pelo Método de Ziehl-Neelsen ou cultura em meios apropriados
(diagnóstico bacteriológico).
M. leprae é o agente etiológico da hanseníase, uma doença que se caracteriza por
lesões da pele, mucosas e nervos periféricos. São BAARs semelhantes ao M.
tuberculosis e caracterizam-se pela disposição em feixes ou globias. Até o momento não
25
se obteve êxito para o seu cultivo em laboratório, sendo considerado parasita
intracelular obrigatório.
A coloração de Ziehl-Neelsen é uma técnica de fácil execução, muito útil e
importante para o diagnóstico clínico das micobacterioses e se fundamenta na
propriedade tintorial que têm as micobactérias de quando coradas resistirem ao
descoramento por soluções álcool-ácido. A evidenciação direta de BAARs no material
clínico suspeito (escarro, urina, líquor, fezes, lesões de pele e lavado gástrico) é apenas
presuntiva, pois não identifica a espécie observada.
OBJETIVOS:
1. Evidenciar as características morfotintoriais de M. tuberculosis e M. leprae e
micobactérias em geral.
2. Diagnóstico e avaliação do tratamento de tuberculose pulmonar.
3. Diagnóstico e avaliação das formas multibacilares da hanseníase.
Técnica:
1. No material suspeito, observar o aspecto, coloração e presença ou não de
sangue.
2. Na lâmina limpa e desengordurada, fazer o esfregaço do material com bastante
assepsia, retirando a alçada da porção mais densa.
3. Flambar a alça.
4. Deixar o esfregaço secar ao ar.
5. Fixar na chama do Bico de Bunsen.
6. Cobrir a lâmina com fucsina de Ziehl concentrada, aquecendo a lâmina até a
emissão de vapores (5 minutos).
7. Escorrer o corante e lavar com a solução álcool-ácido clorídrico 3%
(diferenciador) – tempo delicado.
8. Lavar com água
9. Cobrir a lâmina com solução de azul de metileno (1 minuto)
10. Lavar, secar e observar ao microscópio com objetiva de imersão, óleo de cedro e
iluminação forte.
As micobactérias se coram mal pelo método de Gram. No método de Ziehl-Neelsen elas
permanecem coradas, por serem BAARs, com tonalidade vermelha, enquanto as outras
estruturas e bactérias se mostram azuis.
Pelas normas estabelecidas pela Campanha Nacional contra a Tuberculose, a
interpretação da lâmina pode ser:
Negativo (-)
Positivo (+)
Positivo (++)
Positivo (+++)
ausência de BAARs em 100 campos microscópicos
menos de 1 bacilo/campo em 100 campos
1 a 10 bacilos/campo em 50 campos
mais de 10 bacilos/campo em 20 campos
Coloração de Ziehl Neelsen para M. leprae
a. Material de lesão cutânea, lóbulo da orelha e cotovelo, mesmo sem lesões.
26
b. Técnica de coloração idêntica a descrita anteriormente, com exceção do
ácido clorídrico (1%)
c. Observar ao microscópio o agrupamento típico.
Material necessário:
Escarro de pacientes com tuberculose pulmonar ou
Lâminas preparadas com M. leprae de linfa de lesões coradas pelo ZiehlNeelsen
Bateria de corantes de Ziehl-Neelsen
1. Azul de metileno
Azul de metileno
1g
Álcool etílico 95º GL 100 ml
Água q.s.p.
1000 ml
Triturar o corante em um gral. Adicionar o álcool aos poucos. Homogeneizar, completar
o volume com água. Deixar em repouso por 24 horas. Filtra em papel ou algodão e
estocar em frasco âmbar com tampa de rosca esmerilhada.
2. Sol. Álcool-ácido
Obs: deixar o ácido escorrer lentamente pelas paredes do recipiente contendo álcool,
agitar suavemente.
III. TÉCNICA PARA EVIDENCIAÇÃO DE ESPIROQUETAS
Os organismos espiralados de significado médico, os Treponemataceae, incluem
três grupos patogênicos para o homem e vários outros animais: Leptospira, que causa a
leptospirose humana; Borrelia, incluindo B. recurrentis e B. vicemii, que causam febre
recorrente e a angina de Vicent, respectivamente e Treponema, responsável pelas
doenças conhecidas como treponematoses, destacando-se T. pallidum, T. pertenue e T.
carateum, organismos que causam a sífilis, a bouba e a pinta, respectivamente e o T.
cuniculi, que causa a sífilis em coelhos. Outros treponemas incluem espécies não
patogênicas encontradas na boca e genitais do homem. Nenhum dos quatro treponemas
patogênicos foi ainda cultivado “in vitro” e nenhuma diferença morfológica, antigênica
ou metabólica convincente foi observada entre eles. Os hospedeiros naturais são o
homem, os macacos superiores e os coelhos, mas todos de sangue quente até agora
testados podem ser infectados.
Atualmente, quase todos os casos de sífilis são adquiridos por contato sexual com lesões
infecciosas. Meios incomuns de transmissão incluem o contato pessoal não sexual, com
fômites contaminados, transfusões sanguíneas ou a infecção em útero. Uma grande
proporção das infecções extra genitais ocorre nas proximidades da boca, como resultado
da disseminação dos microorganismos pela cavidade oral durante o beijo. Até o
momento, não há nenhum agente imunizante ativo como profilaxia para a infecção
sifílica.
Leptospirose é um termo aplicado à doença causada por todas as leptospiras,
sem considerar o sorotipo específico. A doença ocorre em uma grande variedade de
27
hospedeiros animais, domésticos e selvagens e nos seres humanos é uma ocorrência
acidental.
Por febre recorrente, entende-se um grupo de doenças infecciosas agudas
clinicamente caracterizadas por períodos de febre e aperexia. Estas doenças são
causadas por espiroquetas do gênero Borrelia e ocorrem em duas variedades
epidemiológicas, uma transmitida pelo piolho (urbana) e outra pelo carrapato (rural). As
borrelias são também importantes como agentes de doenças periodontais.
A família Spirochaetaceae compreende bactérias de formas espiraladas, espessas
ou delgadas, tamanho variável, rígidas ou flexíveis, possuindo cinco gêneros. A
intensidade de coloração varia quando são empregadas a coloração simples ou o método
de Gram; sendo assim utilizadas, para a sua visualização, técnicas especiais de
impregnação, imunofluorescência e campo escuro.
T. pallidum é o agente causal da sífilis. No doente, pode ser observado no sangue
durante o período de incubação da doença, nas secreções de cancro no estágio primário
e no material de lesões de pele e membranas mucosas no estágio secundário. O
diagnóstico laboratorial da sífilis pode ser feito por pesquisa Direta do treponema por
testes sorológicos e pesquisa de anticorpos específicos, mas o único exame que tem
valor absoluto para os diagnósticos da sífilis é a pesquisa direta do treponema em lesões
sinfilíticas. A colheita deve ser feita em lesões úmidas, e o material observado
preferencialmente em microscopia de campo escuro, ou na impossibilidade, através do
método de impregnação pela prata, devendo ser lembrado, no entanto, que nem sempre
é possível evidenciar a espiro que ta nas lesões.
Para as leptospiroses e infecções por Borrelia esses métodos não devem ser feitos,
através do método em campo escuro, para as leptospiroses e, no sangue, durante um
episódio febril, para as espiroquetas do gênero Borrelia.
Objetivo:
Evidenciação de espiroquetas através da microscopia de campo escuro e/ou
impregnação pela prata.
3.1 – Microscopia em campo escuro
Partículas cujas dimensões são inferiores a 0,2m ou objetos cujos índices de refração
são muito próximos daquele do meio em que estão suspensos não são visíveis ao
microscópio óptico, ao exame em campo claro. Para vê-los, recorre-se ao artifício do
campo escuro, que consiste em adaptar ao microscópio óptico comum um dispositivo
que impede a penetração dos raios diretos provenientes de uma fonte luminosa intensa,
de tal maneira que só penetram na objetiva os raios refratados e refletidos pelo objeto
observado. Utilizam-se com esta finalidade condensadores especiais, sendo o mais
usado o condensador cardióide.
Solução impregnadora (nitrato de prata amoniacal):
Dissolver 5 g de nitrato de prata em 100 ml de água
Retira alguns mL
28
Ao restante, adicionar gota a gota solução concentrada de amônia ata que o
precipitado castanho que se forma dissolva-se totalmente
Adicionar gota a gota a solução de nitrato que foi retirada até que apareça uma
fraca turvação persistente.
Material
a.
b.
c.
d.
e.
f.
g.
h.
i.
j.
Microscópio óptico(M.O.)
M.O. + condensador
Lâminas
Reagentes Fontana-Tribondeau
SWAB
Álcool
Óleo de cedro
Solução salina
Culturas em meios líquidos e sólidos
Exsudato positivo
Resultado: num campo escuro as espiroquetas aparecem claras.
3.2. Método de Fontana-Tribondeau (Impregnação pela Prata)
a.
Preparar o esfregaço numa lâmina limpa e desengordurada
Secar ao ar
Fixar o esfregaço com líquido de Ruge durante 1 minuto
Lavar com água destilada
Cobrir a preparação com ácido tânico(mordente) e com chama de um swab
embebido em álcool, aquecer a lâmina com solução de nitrato de prata
amoniacal aquecê-la até a emissão de vapores (30 segundos)
Lavrar com água destilada
Cobrir a lâmina com solução de nitrato de prata amoniacal e aquecê-la até a
emissão de vapore (30 segundos)
Lavar com água destilada
Secar ao ar
Examinar ao microscópio com objetiva de imersão.
Resultado: As formas espiraladas aparecem em marrom escuro em um campo
marrom claro. Os espiralados possuem uma parede delgada que não é
evidenciada pelos métodos habituais, o nitrato de prata impregna na parede.
Reagentes de Fontana-Tribondeau:
1. Líquido de Ruge
- Ácido acético
- Formalina
- Água
2. Mordente
- fenol
- ácido tânico
1,0 mL
2,0 mL
100 mL
1,0 g
5,0 g
29
- água
100 ml
IV. MÉTODO DE ALBERT-LAYBOURN
O método de Albert-Laybourn baseia-se no fato de algumas bactérias apresentarem
corpúsculos citoplasmáticos localizados nas regiões polares (corpúsculos
metacromáticos ou corpúsculos de Babes Emst) da célula bacilar, que se coram pelo
Lugol forte (de cor marrom), se evidenciando em contraste com o corpo bacilar, que se
cora em verde-azulado pela solução de Laybourn. Tais características encontramos nas
corinebactérias e difteróides, e tal metodologia descria, associada aos sintomas clínicos
característicos da difteria, possibilita um diagnóstico presuntivo da doença pela
microscopia ótica.
Técnica:
1. Preparação do esfregaço
a.
Preparar um esfregaço homogêneo, delgado e fixado.
Cobrir o esfregaço por + ou – 5 minutos com a solução de Albert-Laybourn
Escorrer (sem lavar)
Cobrir com solução de Lugol forte por + ou – 2 minutos
Lavar e secar
Observar em objetiva de imersão (100x)
Soluções reagentes:
1. Solução de Albert-Laybourn
- azul de toluidina
- verde malaquita
- ácido acético glacial
- álcool 95%
- água destilada
2. Solução de lugol Forte
- iodo metálico
- iodeto de potássio
- água destilada
0,15g
0,20g
1,00ml
2,00ml
100ml
2,0g
3,0g
300ml
Obs: guardar em frasco âmbar ao abrigo da luz.
30
ASSUNTO:
- Colimetria.
INTRODUÇÃO
A água é elemento fundamental para a sobrevivência humana. Sua grande
utilização no abastecimento público, na recreação, na industria, no uso domestico atesta
essa importância vital.
As águas para abastecimento podem ser poluídas por servir de reservatório para
espécies microbianas patogênicas e permitir a sobrevivência das mesmas, e é
reconhecida desde os primórdios da civilização. Várias doenças podem ser veiculadas
pela água, tais como cólera, febre tifóide, disenterias, leptospirose, tuberculose, hepatite,
poliomielite, doenças parasitárias e fúngicas. Essas doenças são resultantes da ingestão
de água e alimentos contaminados ou do emprego de água poluída pela irrigação, pesca,
lazer, piscicultura, cultura de marisco.
Em cidades onde existe um sistema eficiente de esgotamento sanitário, o esgoto
doméstico é um dos principais responsáveis pela poluição das águas, estimulando o
crescimento de microrganismo. A assimilação destes contaminantes orgânicos
biodegradáveis é realizada com o concurso de bactérias presentes, por meio de um
processo, que consome o oxigênio dissolvido na água dos rios ou reservatórios. Quando
a carga de matéria orgânica biodegradável presente na água, e o OD (Oxigênio
Dissolvido), que mede a concentração de oxigênio disperso na água (Soares, 1999).
Além dos esgotos domésticos, os efluentes industriais e o escoamento superficial
urbano contribuem grandemente na poluição dos corpos d’água. Os efluentes industriais
contem grandes números ou metais pesados. O escoamento superficial urbano contém
todos os poluentes que se depositam na superfície do solo na ausência de chuvas, como
lixo e matéria orgânica. Estes acumulados no solo, valas e bueiros são arrastos quando
da estação chuvosa para os cursos d’água superficiais, constituindo-se numa outra fonte
de poluição (Soares, 1999).
Os microrganismos dotados de potencial patogênico chegam às extensões
hídricas procedentes das excreções intestinais do homem e de outros animais. Embora já
existam métodos desenvolvidos para a detecção de vários organismos patogênicos de
veiculação hídrica, os mesmos não são aplicáveis na rotina devido ao alto custo e
necessidade de pessoal especializado (CETESB, 1993).
Uma alternativa para a avaliação da qualidade sanitária da água é a pesquisa de
organismo não patogênicos constituintes da microbiota normal das fezes de animais de
sangue quente, que quando encontrados indicam a ocorrência de contaminação fecal,
evidenciando o risco da presença de patógenos. Fezes humanas contém de 20-30 % de
resíduos alimentares não digeridos, sendo o restante constituído de água e bactérias. NO
indivíduo saudável essas bactérias constituem os habitantes normais do intestinos onde
a Escherichia coli é a representante característica. O número desses microrganismos
pode atingir XXXXcélulas/g de fezes. Assim a presença da Escherichia coli em
alimentos e água é indicativo de contaminação fecal e possibilidade de presença de
patógenos entéricos.
Microrganismos indicadores de poluição de água são utilizados para monitorar,
classificar e restringir o uso das águas. Um indicador ideal deveria preencher os
seguintes critérios: 1. Ser aplicável a todo tipo de água; 2. Estar presente
simultaneamente com os microrganismos patogênicos, com um tempo de sobrevivência
igual àquele patógeno entérico mais resistente; 3. Não se reproduzir em águas
contaminadas, para não resultar em valores aumentados ( HAGLER E MENDONÇAHAGLER, 1998 ).
31
Não se conhece nenhum microrganismo ou grupo de microrganismo que atenda
a todos esses requisitos, mas há vários que se aproximam das exigências referidas e que
são muito úteis.
As bactérias empregadas como indicadores de poluição fecal em águas são: os
coliformes totais, coliformes fecais, estreptococos fecais e o Clostridium perfringens.
Contagens de Salmonella e de bactérias do gênero Bifidobactérias têm sido propostas. O
Indicador microbiológico mais empregado é o grupo dos coliformes. Este e outros
indicadores de poluição orientam a margem de segurança sanitária de água potável, da
água utilizada para fins recreativos e dos cultivos de organismos marinhos comestíveis.
A Organização Mundial de Saúde (OMS) recomenda para águas recreacionais
um máximo de 100 coliformes fecais por 100ml de água.
COLETA DE AMOSTRAS
A coleta de amostras para exame microbilógico deve ser feita em garrafas
esterilizada que tenham sofrido tratamento prévio de limpeza e rinsagem com água
destilada.
→ Água clorada: adiciona-se 0,1 ml de tiossulfato de sódio 10% para cada
250ml de água para neutralizar-se o cloro livre presente, impedindo que continue com
propriedades desinfetantes entre o período da coleta e o momento da inoculação,
impedindo que continue com propriedades desinfectantes entre o período da coleta e o
momento da inoculação.
→Água com alto teor de cobre e zinco: coleta na presença de um agente
quelante, de forma a reduzir a toxicidade provocada pelos metais ( 0,3 ml de EDTA a
15%, ph = 6,5para cada 120mL de água ).
Quando a amostra for coletada, deve ser deixado um espaço livre na garrafa
(cerca de 2,5 cm) para facilitar a homogeneização antes da inoculação. As garrafas
devem ser mantidas vedadas até o momento da coleta da amostra e devem ser tomados
todos os cuidados de assepsia no momento da coleta, de forma a evitar contaminações
secundárias.
*PONTO DE COLETA
1. Água da torneira
a. Abrir a torneira e deixar correr por 5 minutos, para eliminar as impurezas e a água na
acumulada nas tubulações.
b. Com algodão embebido em álcool, passar na abertura e internamente e em seguida
flambar.
c. Abrir a torneira novamente por mais 1 a 2 minutos.
d. Abrir o frasco esterilizado e coletar a água. Introduzir água no frasco até cerca de
três quartos do seu volume.
e. Tampar o frasco e transportar imediatamente ao laboratório.
2. Poços e Cisternas
a. Preparação do frasco – amarrar o frasco e uma pedra como contrapeso com um
barbante para facilitar a descida no poço.
b. Descer o frasco dentro do poço sem permitir que o mesmo toque nos lados.
c. Submergir o frasco completamente na água.
32
d. Uma vez que o frasco estiver cheio, recolher e derramar parte da água para criar um
espaço de ar e colocar a tampa no frasco imediatamente.
3. Rios, Lagoas e Mares
a. Coleta da amostra de água de rios e lagoas – nestes casos deve-se mergulhar o frasco
até uma profundidade de 20cm, com abertura voltada em direção contrária a corrente, a
fim de evitar a contaminação da água com as mãos.
b. Coleta da água do mar – a coleta deve ser feita na região onde as pessoas costumam
banhar-se, que corresponde à profundidade aproximadamente de 1,0 m, que é a região
das praias mais utilizada para a recreação de contato primário, na maré baixa e 24 horas
sem chuvas.
ACONDICIONAMENTO
LABORATORIO
E
TRANSPORTE
DA
AMOSTRA
PARA
O
O ideal é a análise iniciar-se até 1 hora após a coleta. Caso isto seja impossível, a
amostra deve ser transportada sob refrigeração. A amostra deve ser mantida entre 4 a 10
graus Celsius no prazo máximo de até 30 horas após a coleta.
Amostras presumivelmente poluídas têm de ser inoculadas no máximo após 6
horas da coleta.
Entre o recebimento da amostra e o inicio da inoculação, a mesma deve ser mantida em
geladeira (cerca de 5 graus Celsius).
EXAMES BACTERIOLÓGICOS DA ÀGUA
O exame bacteriológico da água é feito através de dois processos: Contagem de
bactérias heterotróficas viáveis na água e determinação ou estimativa do número de
bactérias coliformes.
A metodologia padrão empregada no exame bacteriológico da água, para medida
do grupo coliforme, inclui dois procedimentos: a técnica dos tubos múltiplos e a técnica
da membrana filtrante (“Standard Methods for the Examination of Water and
Wastewater” -APHA, 1980).
A. Determinação de coliformes pela técnica dos tubos múltiplos –
NÚMERO MAIS PROVÁVEL (NMP)
A técnica do número mais provável consiste no exame de uma série de tubos
onde foram inoculados volumes diferentes de amostra.
O valor obtido resulta da consulta da tabela que foram estimuladas com base em
fórmulas de probabilidade. Considerações teóricas e determinações repetidas em grande
escala indicam que este tipo de técnica tende a fornecer valores mais elevados do que o
número real. As disparidades tendem a diminuir quando se adota séries com maior
número de tubos em cada diluição. Portanto, a sensibilidade do teste depende do
número de tubos adotados.
Existem várias tabelas de NMP e a escolha da série a ser adotada é função das
características microbiológicas da amostra.
33
Tabelas de NMP/100 ml de amostra:
a.
5 X 10 ml ----- 2,2 > NMP 16
b.
5 X 10 ml ----- 2,2 > NMP > ou = 240
1 X 1 ml
1 X 0,1 ml
3) 3 X 10 ml ----- 3
3 X 1 ml
3 X 0,1 ml
> NMP > ou = 2400
4) 1 X 50 ml ------ 1 > NMP > ou = 240
5 X 10 ml
5 X 1 ml
5) 5 X 10 ml ----- 2 > NMP > ou = 2400
5X 1
5 X 0,1 ml
6) 5 X 50ml ----- 1 > NMP > ou = 240
→OBS: nos tubos onde o inoculo é de 10 ou 50 ml, usar concentração dupla do
meio e volume igual ao inoculo.
TABELA DOS
VIGENTES
PADRÕES
MICROBIOLÓGICOS
TUBOS POSITIVOS POR:
10 ml
1 ml
0,1 ml
0
0
0
0
0
1
0
1
0
0
2
0
1
0
0
1
0
1
1
1
0
1
1
1
1
2
0
2
0
0
2
0
1
2
1
0
2
1
1
2
2
0
2
2
1
2
3
0
3
0
0
3
0
1
3
0
2
DE
PROBABILIDADE
Nmp PARA 100 ml
3 tubos
<3
3
3
6
4
7
7
11
11
9
14
15
20
21
28
30
23
39
64
34
3
3
3
3
3
3
3
3
3
3
1
1
1
2
2
2
3
3
3
3
0
1
2
0
1
2
0
1
2
3
43
75
120
93
150
210
240
460
1100
2400
Água potável: Ausência de coliformes totais
Ausência de coliformes fecais
Teste Presuntivo
Inocular, após a escolha da tabela, dem tubos contendo caldo lauril sulfato triptose
ou caldo de lacose em concentrações dupla ou simples. Os tubos devem conter tubinhos
de Durham.
Ocriscimento com formação de gás significa teste presuntivo positivo para
coliformes totais. Os tubos que não apresentarem formação de gás com 24 horas de
incubação devem ser incubados até 48 horas.
Os tubos positivos com 24 horas devem ser imdiatamente inoculados nos meios de
confirmação para se evitar que um crescimento muito abundante provoque o
abaixamento do pH, o que pode provocar resultados falsamente negativos.
Teste de Confirmação
Coliformes Totais
A partir dos tubos dom formação de gás, semear por alçada (diâmetro=3 mm) em
tubos contendo caldo de bílis para igual número de tubos contendo caldo EC. Incubar os
tubos a 35 ± 0,5º por 48 ± 3 horas.
A formação de qualquer quantidade de gás constitui teste positivo para coliformes
totais.
Coliforems Fecais
Dos tubos positivos do teste presuntivo, transferir com uma alça de platina uma
pequena porção do meio para igual número de tubos contendo caldo EC. Incubar os
tubos a 44,5 ±0,2 ºC por 24 horas.
A presença de gás no interior dos tubinhos de Durhan é considerada reação
positiva, indicando contaminação de origem fecal.
A ausência de gás mesmo com evidência de crescimento indica a presença de
coliformes de outra fonte que não seja de intestinos de animais de sangue quente.
Teste complemento
35
A partir dos tubos positivos de caldo bílis verde brilhante, semear por estrias em
placa contendo endo agar ou azul de metileno agar (agar EMB). Incubar a 35 ± 0,5ºC
por 24 ± 2 horas.
Colônias típicas: Meio endo agar - colônias vermelhas
Meio agar BEM - coloônias verdes com centro escuro.
De cada placa, escolher uma ou mais colônias típicas e bem isoladas; transferir
cada colônia para tubos contendo caldo de lactose ou caldo lauril triptose e para um
tubo inclinado de agar nutriente. Incubar a 35 ± 0,5ºC por 24 ± horas, prosseguindo a
incubação atë 48 ± 3 horas caso não tenha ocorrido formação de gás após a primeira
incubação.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
B. TÉCNICA DE FILTRAÇÃO EM MEMBRANA
A técnica de filtração na membrana para análise da água passou a ser
recomendada pelo "Standard
Methods for the Examination of Water and Wastewater", ao lado da ténica de NMP,
após a 13ª edição . A recomendação afirma que a técnica popde ser adotada para
determinar a potabilidade de qualquer água, desde que, após uma série de exames
paralelos, obtenha-se com as duas técnicas, resultados compatíveis.
Entretanto, deve ser observado, quanto a técnica de filtração em membrana:
Vantagens:
- Os resultados são obtidos após 22-24 horas.
- Podem ser analizados volumes maiores e mais representativos das amostras.
- Os resultados em membrana têm maior grau de precisão, em relação à técnica
dos tubos mútiplos, proporcionado também maior reprodutibilidade.
- Um maior número de amostras pode ser processado com um mínimo de
espaço e equipamentos.
36
Limitações:
- As amostras com alta densidade de bactérias não coliformes, porém capazes de
se desenvolverer sobre o meio de cultura, pois os coliformes poderão ser impedidos de
se desenvolverem ou senão a densidade de coliformes poderão ser impedidos de se
desenvolverem ou senão a densidade de coliformes pode ser menor do que a obtida pela
técnica do NMP.
- äguas com alta turbidez devido as alfgas ou substâncias em suspensão, pois
estas podem formar uma película na superfície da membrana e interferir no
desenvolvimento de colônias característica de coliformes.
Técnica
Um volume de 100 ml de amostra é filtrada a vácuo através de uma membrana de
0,45 μ de diâmetro de poro.
As bactérias ficam retidas na membrana e esta é transferida para placas
apropriadas contendo almofadas de papel absorventes embebidas nos meios adequados.
Meio para coliformes totais: Endo (caldo ou agar)
Incubação 35 ± 0,5 ºC por 22-24 horas.
Colônisa Típicas: cor rosa ou vermelha escura com brilho metálico característico.
Meio para coliformes fecais: M-FC-Broth
Incubação: 44,5 ± 0,2º por 24 horas.
Colônias Típicas: or azul.
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
37