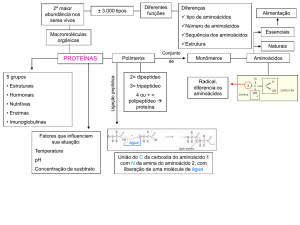
Proteínas
São compostos orgânicos
de alto peso molecular,
são formadas pelo
encadeamento de
aminoácidos.
Representam cerca do 50
a 80% do peso seco da
célula sendo, portanto, o
composto orgânico mais
abundante de matéria
viva.
• Pertencem à classe dos peptídeos, pois são
formadas por aminoácidos ligados entre si por
ligações peptídicas. Uma ligação peptídica é a união
do grupo amino (-NH 2 ) de um aminoácido com o
grupo carboxila (-COOH) de outro aminoácido,
através da formação de uma amida.
Aminoácidos
CARACTERÍSTICAS GERAIS:
• São as unidades fundamentais das proteínas.
• Todas as proteínas são formadas a partir da ligação em seqüência de
apenas 20 aminoácidos.
• Existem, além destes 20 aminoácidos principais, alguns aminoácidos
especiais, que só aparecem em alguns tipos de proteínas.
Os aminoácidos que intervêm na composição das proteínas (existem
outros) são número de 20 e obedecem à estrutura geral representada
na figura abaixo:
Os vegetais têm a capacidade de fabricar os vinte aminoácidos
necessários para a produção de suas proteínas, já as células
animais não sintetizam todos eles, sendo que alguns devem ser
ingeridos com o alimento.
Assim, os aminoácidos podem ser classificados em dois tipos:
•
Essenciais - são aqueles que não podem ser sintetizados pelos
animais.
Ex: Fenilalanina; Valina; Triptofano; Treonina; Lisina; Leucina;
Isolucina; Metionina.
• Não essenciais (Naturais) - são aqueles que podem ser
sintetizados pelos animais.
Ex: Glicina; Alanina; Serina; Cisteína; Tirosina; Arginina; Ácido
aspártico; Ácido glutâmico; Histidina; Asparagina; Glutamina;
Prolina.
É importante ressaltar que, para os vegetais, todos os
aminoácidos são não essenciais. Fica claro que classificar um
aminoácido em não essencial ou essencial depende da espécie
estudada; assim um certo aminoácido pode ser essencial para um
animal e não essencial para outro.
HOMEM: produz 8 (isoleucina, leucina, valina, fenilalanina, metionina,
treonina, triptofano e lisina)
RECÉM-NASCIDOS: além desses não produz também a histidina
O QUE DIFERE AS PROTEÍNAS:
•
Quantidade de AA do polipeptídio
•
Tipos de AA
•
Seqüência dos AA
Classificação
• Proteínas simples
– Somente aminoácidos
• Proteínas conjugadas
(proteínas ligadas a
outras substâncias)
–
–
–
–
Nucleoproteínas
Glicoproteínas
Metaloproteínas
Lipoproteínas
Níveis de Organização:
Estrutura Primária (seqüência linear de
AA)
• Dada pela seqüência de aminoácidos e
ligações peptídicas da molécula.
• É o nível estrutural mais simples e mais
importante, pois dele deriva todo o
arranjo espacial da molécula.
• A estrutura primária da proteína resulta
em uma longa cadeia de aminoácidos
semelhante a um "colar de contas",
com uma extremidade "amino terminal"
e uma extremidade "carboxi terminal".
• A estrutura primária de uma proteína é
destruída por hidrólise química ou
enzimática das ligações peptídicas,
com liberação de peptídeos menores e
aminoácidos livres.
• Sua estrutura é somente a seqüência
dos aminoácidos, sem se preocupar
com a orientação espacial da molécula.
Estrutura Secundária (enrolamento
helicoidal )
•
•
•
•
É dada pelo arranjo espacial de
aminoácidos próximos entre si na
seqüência primária da proteína.
É o último nível de organização
das proteínas fibrosas, mais
simples estruturalmente.
Ocorre graças à possibilidade de
rotação das ligações entre os
carbonos a dos aminoácidos e
seus grupamentos amina e
carboxila.
O arranjo secundário de um
polipeptídeo pode ocorrer de
forma regular; isso acontece
quando os ângulos das ligações
entre carbonos a e seus ligantes
são iguais e se repetem ao longo
de um segmento da molécula.
Estrutura Terciária (dobramento sobre si mesma)
• Dada pelo arranjo espacial de aminoácidos distantes entre si na
seqüência polipeptídica.
• É a forma tridimensional como a proteína se "enrola".
• Ocorre nas proteínas globulares, mais complexas estrutural e
funcionalmente.
• Cadeias polipeptídicas muito longas podem se organizar em
domínios, regiões com estruturas terciárias semi-independentes
ligadas entre si por segmentos lineares da cadeia polipeptídica.
• Os domínios são considerados as unidades funcionais e de estrutura
tridimensional de uma proteína.
Estrutura Quaternária (união de cadeias polipeptídicas)
• Surge apenas nas proteínas oligoméricas.
• Dada pela distribuição espacial de mais de uma cadeia polipeptídica
no espaço, as subunidades da molécula.
• Estas subunidades se mantém unidas por forças covalentes, como
pontes dissulfeto, e ligações não covalentes, como pontes de
hidrogênio, interações hidrofóbicas, etc.
• As subunidades podem atuar de forma independente ou
cooperativamente no desempenho da função bioquímica da proteína.
• Proteínas GLOBULARES (Albumina) e FIBROSAS (Queratina)
DESNATURAÇÃO DAS PROTEÍNAS;
•
TEMPERATURA / agitação das
moléculas rompimento de
ligações / Ex: ovo cozido
•
GRAU DE ACIDEZ / meios
ácidos ou básicos
rompimento de atrações
elétricas que ajudam manter a
configuração espacial /
fabricação de queijos e
coalhadas
Funções: as proteínas podem ser agrupadas em várias categorias de
acordo com a sua função.
•
Função estrutural - participam da estrutura dos tecidos.
Exemplos:
- Colágeno: proteína de alta resistência, encontrada na pele, nas
cartilagens, nos ossos e tendões.
- Actina o Miosina: proteínas contráteis, abundantes nos músculos, onde
participam do mecanismo da contração muscular.
- Queratina: proteína impermeabilizante encontrada na pele, no cabelo e
nas unhas. Evita a dessecação, a que contribui para a adaptação do animal
à vida terrestre.
- Albumina: proteína mais abundante do sangue, relacionada com a
regulação osmótica e com a viscosidade do plasma (porção líquida do
sangue).
•
Função enzimática - toda enzima é uma proteína. As enzimas são
fundamentais como moléculas reguladoras das reações biológicas. Dentre
as proteínas com função enzimática podemos citar, como exemplo, as
lipases - enzimas que transformam os lipídios em sua unidades
constituintes, como os ácidos graxos e glicerol.
•
Função hormonal - muitos hormônios de nosso organismo são de
natureza protéica. Resumidamente, podemos caracterizar os hormônios
como substancias elaboradas pelas glândulas endócrinas e que, uma vez
lançadas no sangue, vão estimular ou inibir a atividade de certos órgãos. É
o caso do insulina, hormônio produzido no pâncreas e que se relaciona
com e manutenção da glicemia (taxa de glicose no sangue).
•
Função de defesa - existem células no organismo capazes de
"reconhecer" proteínas "estranhas" que são chamadas de antígenos. Na
presença dos antígenos o organismo produz proteínas de defesa,
denominados anticorpos. 0 anticorpo combina-se, quimicamente, com o
antígeno, do maneira a neutralizar seu efeito. A reação antígeno-anticorpo
é altamente específica, o que significa que um determinado anticorpo
neutraliza apenas o antígeno responsável pela sua formação.
Os anticorpos são produzidos por certas células de corpo (como os
linfócitos, um dos tipos de glóbulo branco do sangue). São proteínas
denominadas gamaglobulinas.
•
Função nutritiva - as proteínas servem como fontes de aminoácidos,
incluindo os essenciais requeridos pelo homem e outros animais. Esses
aminoácidos podem, ainda, ser oxidados como fonte de energia no
mecanismo respiratório. Nos ovos de muitos animais (como os das aves) o
vitelo, material que se presta à nutrição do embrião, é particularmente rico
em proteínas.
•
Coagulação sangüínea - vários são os fatores da coagulação que
possuem natureza protéica, como por exemplo: fibrinogênio, globulina antihemofílica, etc...
•
Transporte - pode-se citar como exemplo a hemoglobina, proteína
responsável pelo transporte de oxigênio no sangue.
Enzimas – Proteínas Especiais
•
As enzimas são proteínas especializadas na catálise de reações biológicas.
Elas estão entre as biomoléculas mais notáveis devido a sua extraordinária
especificidade e poder catalítico, que são muito superiores aos dos
catalisadores produzidos pelo homem. Praticamente todas as reações que
caracterizam o metabolismo celular são catalisadas por enzimas.
•
Como catalisadores celulares extremamente poderosos, as enzimas aceleram
a velocidade de uma reação, sem no entanto participar dela como reagente ou
produto.
•
•
•
As enzimas atuam ainda como reguladoras deste conjunto complexo de
reações.
As enzimas são, portanto, consideradas as unidades funcionais do
metabolismo celular.
As enzimas são classificadas segundo os
compostos nos quais elas agem:
• lipases atuam nas gorduras decompondo-as em glicerol e ácidos
graxos;
• catalases decompõem a água oxigenada;
• amilases decompõem os amidos em açúcares mais simples;
• proteases decompõem as proteínas;
• celulases decompõem a celulose;
• pectinases decompõem a pectina;
• isomerases catalizam a conversão da glicose em frutose;
• beta-glucanases decompõem a beta-glucana;
• outras.
Modelo de Chave-Fechadura
FATORES QUE AFETAM A ATIVIDADE DAS ENZIMAS:
• TEMPERATURA:
• temperatura atividade enzimática / até certo limite.
• agitação moléculas possibilidades de choques , mas
rompimento de ligações / perda da conformação, isto é, ocorre
desnaturação e inativação da enzima.
• Temperatura Ótima / HOMEM ~ 35 E 40 ºC
Concentração do Substrato
• Quanto maior a concentração do substrato, maior a velocidade da
reação, até o momento em que todas as enzimas estejam
ocupadas. Não adianta aumentar a concentração do substrato
porque a velocidade da reação aumentará.
pH
• Cada enzima tem uma ação ótima de acordo com um determinado
pH. Ex: a pepsina (protease do suco digestório do estômago) tem
um pH ótimo ao redor de 2,0 (ácido).
Inibidores enzimáticos
São compostos que podem diminuir a atividade de uma enzima.
A inibição enzimática pode ser reversível ou irreversível.
Existem 2 tipos de inibição enzimática reversível:
Inibição Enzimática Reversível Competitiva:
• Quando o inibidor se liga reversivelmente ao mesmo sítio de ligação
do substrato;
• O efeito é revertido aumentando-se a concentração de substrato
• Este tipo de inibição depende das concentrações de substrato e de
inibidor.
Inibição Enzimática Reversível Não-Competitiva:
• Quando o inibidor liga-se reversivelmente à enzima em um sítio
próprio de ligação, podendo estar ligado à mesma ao mesmo tempo
que o substrato;
• Este tipo de inibição depende apenas da concentração do inibidor.
Na inibição enzimática irreversível, há modificação covalente e
definitiva no sítio de ligação ou no sítio catalítico da enzima.