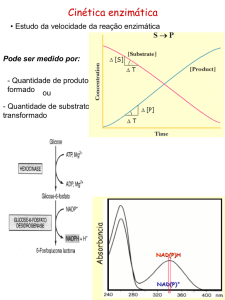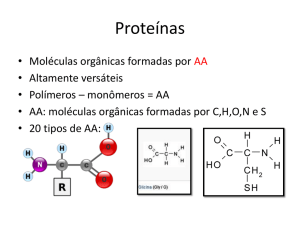
Cinética enzimática
• Estudo da velocidade da reação enzimática bem como os
fatores que a influença
Pode ser medido por:
- Quantidade de produto
formado por unidade de
tempo
ou
-Quantidade de substrato
transformado por unidade
de tempo
V=-
S/ t =
P/ t
Cinética enzimática
[produto]
• Atividade enzimática pode ser medida pela velocidade da
reação catalisada
5[S]
4[S]
3[S]
2[S]
[S]
Velocidade
da reação
tempo
[S]
V0 varia com a concentração de substrato
V0 sobe linearmente a medida que se aumenta a concentração
de substrato, e então começa a se nivelar e se aproximar e um
ponto máximo onde a velocidade não aumenta mesmo em
concentrações maiores de substrato.
Velocidade da reação é
proporcional a S
Substrato satura todas
as moléculas de enzima
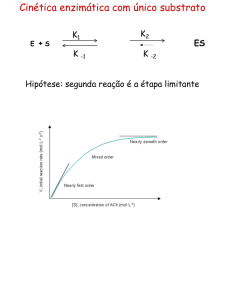
Cinética enzimática com único substrato
E
+S
K1
K
ES
-1
K2
K -2
E + P
Hipótese: segunda reação é a étapa limitante
Após curto tempo - estabilidade dinâmica com relação a [E]
e [ES] é alcançado
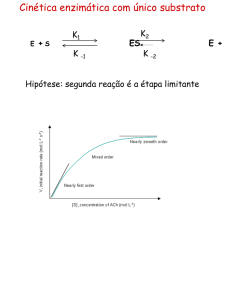
Cinética enzimática com único substrato
E
+
S
K1
K
K2
ES
-1
V0 – Velocidade Inicial
Estado estacionário – [ES] constante
Então Formação de [ES] = Degradação de [ES]
Vo = K2 [ES]
[Et]=[E] + [ES]
V de Formação de ES = K1 [E] [S]
V de degradação de ES = K –1[ES] + K2 [ES]
Já que Formação de [ES] = Degradação de [ES]
K1 ([Et]-[ES]) [S] = K –1[ES] + K2 [ES]
K1[S][Et] - K1[S][ES] = (K –1+ K2) [ES]
[ES] =
[Et] [S]
[S] + (K
–1+
K2) / k1)
Km
E + P
[ES] = [Et] [S]
Km
Se, V0 = k2 [ES]
+ [S]
Então: V0 = k2 [Et] [S]
Km +[S]
Em V máxima
[Et] = [ES]
Então V max = k2 [Et]
Sendo assim
Vo = Vmax [S]
Km +[S]
Uma propriedade importante:
Quando V = Vmax
2
Km +[S] =
Km =
Vmax =
2
2 . [S]
2 . [S] - [S]
Vmax . [S]
Km +[S]
Km= [S]
Propriedades importantes de Km:
• É numericamente igual a [S] na
qual a velocidade da reação é
metade da Vmax.
• Característico de cada enzima.
• Reflete a afinidade da enzima
pelo seu substrato.
Km = [S]
Gráfico Linewevear-Burk
•
A VELOCIDADE DA REAÇÃO É PROPORCIONAL À
CONCENTRAÇÃO DA ENZIMA
v0
[E]
•
FACILITA A DETERMINAÇAO DA CONCENTRACAO DE
UMA ENZIMA
•
DOSAGENS (transaminases, LDH, amilase, fosfatase
alcalina)
Reações enzimáticas com mais de um substrato
Ex:
ATP + Glicose
hexocinase
ADP + Glicose 6- P
Reações em que há 2 substratos envolvem a transferência de átomos
ou grupos funcionais de um substrato para o outro:
Sequencial (formação do complexo ternário)
Pingue-pongue ou duplo deslocamento
Inibidores
A atividade das enzimas pode ser diminuida ou parada por
várias substâncias chamadas de inibidores. Tem inibidores
naturais fazendo parte dos constituintes da célula e
outros estranhos ao organismo que podem provocar
alterações do metabolismo celular. Aqueles encontrados
nas células são fundamentais para a fiosiologia. Esses
inibidores permitem ás células um controle preciso da
velocidade de algumas reações chaves permetindo uma
resposta integrada à mudanca das condições
fisiológicas.
Inhibição específica de certas enzimas permita as
aplicações farmacológicas
ex: sulfonamidos (sulfadoxina, ...)
Usados para combater as infecções bacterianas
Pneumonia a pneumocystis (Pneumocystis jirovici, P.
carinii) IO em pacientes HIV +
Infecção do tracto urinário
Shigelose (Desinteria)
Algumas infecções por protozoários (Plasmodium
falciparum)
Sulfonamidos são inibidores competitivos da
dihidropteroato sintetase (dhps) enzima importante
envolvida no metabolismo dos folatos de muitos
organismos menos o homem.
Os folatos nos serem humanos são fornecidos pela dieta.
Toxicidade seletiva para bactérias.
Largo campo de aplicaçacão para o combate de insetos
Ex: enzimas digestivas de insetos como as a-amilases
catalisam a hidrólise de ligações glicosídicas a-1,4 do amido,
glicogênio e outros carboidratos. Essas enzimas são muito
importantes para os insetos, especialmente para aqueles que se
desenvolvem em grãos ricos em amido. (No feijao foram
identificados 4 desses inhibidores)
Desenvolvimento de plantas mais resistentes ao ataque das
pragas contribuindo para a redução do uso de inseticidas
Importância:
Inibidores
• Agentes farmacêuticos
• Ferramentas no estudo de mecanismo de funcionamento
das enzimas
• Ferramenta nos estudos das vias metabólicas
Irreversíveis
Inibidores
Reversíveis
Inib. Competitiva (freqüente)
Inib. Acompetitiva
(quando o inibidor liga-se ao
complexo ES , mas não a
enzima livre)
Inib. Mista
Inib. Não-competitiva
(caso particular de inib. Mista)
Inibidores Irreversíveis
Inibidor irreversível
1-Reagentes específicos para grupo (R)
2- Análogos de substrato
3- inibidor suicida
1
2
Inibição Reversível
Semelhança estrutural entre S e I
Não há semelhança estrutural entre S e I
= inib. acompetitiva
Não há semelhança estrutural entre S e I
Inibidor competitivo
• Estrutura semelhante à do
substrato
• Liga-se ao Sítio Ativo da
Enzima
• Aumento da [substrato]
diminui a inibição
• A Vmax NÃO se altera
•Km da enzima AUMENTA
Na presença do inibidor
Inibição não-Competitiva
•Inibidor não tem semelhança
estrutural com o substrato
•NÃO se liga no sítio ativo da
enzima
•Aumento da [substrato] não
diminui a inibição
•Km da enzima NÃO se altera
•A VMAX DIMINUI na
presença do inibidor
Inibição competitiva
Su bst r at o (m M )
0.2
0.4
0.8
1.0
2.0
4.0
6.0
V0 (sem in ibid or )
m m ol .L -1 .m i n -1
5
7.5
1 0.0
1 0.7
1 2.5
1 3.6
1 3.5
V0 (com in ibid or )
m m ol .L -1 .m i n -1
3
5
7.5
8.3
1 0.7
1 2.5
1 3.5
-1
V0 (mol.L .min )
15
Sem inibidor
10
-1
Com inibidor
5
0
0
1
2
3
4
5
6
Substrato (mM)
Exemplo: Succinato desidrogenase
7
Inibição competitiva
Inibição não-competitiva
Inibição acompetitiva
O inibidor se liga somente no complexo ES em sítio próprio.
Analgésicos... inibidores de Prostaglandinas
Ligação covalente
Inibidor irreversível
(suicída) - Aspirina
Interações sem ligação covalente
Inibidor competitivo e reversível –
Ponstan
Regulação de perfusão renal
Agregação plaquetária
Protetora de mucosa gástrica
Inflamação
Sítio Ativo da Ciclooxigenase
•Inibidor irreversível
Ligação covalente
Ácido acetil salicílico
•Inibidor competitivo e reversível
Interações sem ligação covalente
Ácido mefenâmico
Inibidor competitivo e reversível da
COX-1/2 Interação iônica
Dipirona sódica
Inibidor competitivo e
reversível da COX-2
Meloxicam
Inibidores Competitivos de proteases do
vírus HIV
Gag e Gag Pol são clivados pela protease do vírus HIV em 9
pontos específicos para produzir proteínas funcionais. O
precursor Gag vai originar proteínas estruturais e o precursor
Pol vai originar enzimas como transcriptase reversa, integrase e
proteases.
Amprenavir
Ciclo de Replicação do Vírus HIV
*
Inibidores de proteases
Protease produz partículas virais infecciosas
Inibidores Competitivos de proteases do
vírus HIV
Gag e Gag Pol são clivados pela protease do vírus HIV em 9
pontos específicos para produzir proteínas funcionais. O
precursor Gag vai originar proteínas estruturais e o precursor
Pol vai originar enzimas como transcriptase reversa, integrase e
proteases.
Amprenavir
Regulação da atividade enzimática das enzimas
alostéricas
• Enz. alostéricas analogia com protéina
alostérica (ex: Hb)
• Moduladores alostéricos (≠ de inibidores
não-competitivos ou mistos!!)
• Mudanças conformacionais entre forma ativa
e inativa e parámetros cinéticos diferentes (≠
do Michaelis-Menten)
Sigmoide
Hiperbole
• Dois tipos: enzimas homotrópicas (reguladas
pelo substrato) e heterotrópicas
Enzimas alostéricas... O que é isso?
Sistema multienzimático sequencial
Enzimas alostéricas... O que é isso?
-Reguladas por moduladores
alostéricos => envolvendo ou
não o sítio ativo
-Várias subunidades
- Inibição por
retroalimentação
Ex: Aspartato Transcarbamilase (AtCase) -síntese de pirimidinas
Aspartato + carbamil-fosfato
AtCase
N-carbamil aspartato
Citidina
trifosfato
Uridina
trifosfato
Um modulador alostérico pode ser tanto um inibidor quanto
um ativador.
Michaellis-Menten
Enzimas Alostéricas
Enzima Homotrópica
Efeito moduladores
Efeito moduladores
Exemplos de enzimas regulatórias
Fosfofrutokinase –1 (PFK-1):
ALOSTERIA
Glicogênio Fosforilase
ALOSTERIA
MODIFICAÇÃO COVALENTE
Modificação covalente reversível
Ativação Proteolítica
Fatores que afetam a velocidade
enzimática
pH
Temperatura
Concentração de substratos
Concentração de cofatores
Presença de Inibidores e/ou ativadores
Modificações químicas: fosforilações, adenilações, etc
Concentração de enzima