ESPECIALIZAÇÃO EM MICROBIOLOGIA APLICADA
CASCAVEL - 2009
Infecção Bacteriana Aguda do Trato
Respiratório Inferior
Profa. Vera Lucia Dias Siqueira
Bacteriologia Clínica – DAC - UEM
Sistema Respiratório
Pneumonias Bacterianas
• Etiologia variável
• Idade, doença de base;
• fatores de risco, ocupacionais, geográficos
• (Comunitária ou Hospitalar)
Agentes Bacterianos de Pneumonias
• Origem Comunitária
– Neonatos
– Chlamydia trachomatis
– Streptococcus agalactiae
– Crianças
– Staphylococcus aureus
– Streptococcus pneumoniae
– Haemophilus influenzae
Agentes Bacterianos de Pneumonias
• Origem Comunitária
– Adultos Jovens
– Mycoplasma pneumoniae
– Chlamydia pneumoniae
– Adultos
–
–
–
–
–
–
Streptococcus pneumoniae (80%)
Staphylococcus aureus
Klebsiella pneumoniae e outras enterobactérias
Haemophilus influenzae
Anaeróbios da orofaringe
Outros
Agentes Bacterianos de Pneumonias
• Origem Hospitalar
E outras Enterobactérias
–
–
–
–
–
–
Klebsiella pneumoniae
Staphylococcus aureus
Pseudomonas aeruginosa
Acinetobacter spp
Streptococcus pneumoniae
Legionella spp.
E outros Não-Fermentadores
– (mais comum L. pneumophila – BGN pleomórfico que cresce em meios
especiais – BCYE – agar extrato de levedura e carvão tamponado e com
antibióticos)
Pneumonia no Paciente com Fibrose Cística
Doença de caráter genético autossômico
recessivo. Mais comum na raça branca .
Mutação no gene que codifica a
proteína reguladora da condutância
iônica transmembrana (CFTR – “cystic
fibrosis transmembrane regulator)
Muco respiratório é 30 a 60 vezes mais espesso do que o de
uma pessoa normal, o que dificulta sua depuração através do
movimento ciliar → lesão do epitélio pseudoestratificado
colunar ciliado → favorece infecção.
Pneumonia no Paciente com Fibrose Cística
Agentes mais comuns
Crianças
Staphylococcus aureus
Haemophilus influenzae
Adolescência – Adulto
Pseudomonas aeruginosa
Outros Agentes
Complexo Burkholderia cepacia e outras espécies de Burkholderia
Ralstonia e Pandoraea
Achromobacter xylosoxidans, Stenotrophomonas maltophilia,
Enterobactérias, etc.
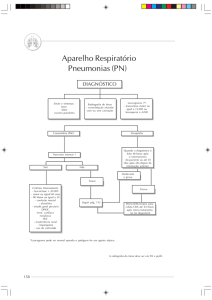
Diagnóstico das Pneumonias
• Clínico + Radiológico
• Laboratorial
• Coleta da Amostra
Importantíssimo
Diagnóstico das Pneumonias
COLETA E TRANSPORTE DO MATERIAL CLÍNICO
ESCARRO
Preferencialmente pela manhã.
Escovação dos dentes e gargarejo com água (não usar soluções anti-sépticas).
Coletar o escarro através do esforço de tosse em frasco estéril
Processar imediatamente (1 a 2 horas), não é recomendado refrigeração ou meio
de transporte
Necessita validação
ESCARRO INDUZIDO
Nebulização com salina hipertônica – (20 a 30 ml de solução de NaCl 3 a 10% ou
solução contendo 15% de NaCl e 10% de glicerina por aproximadamente 10
minutos).
Fisioterapia respiratória UNESP
Processar imediatamente, não é recomendado refrigeração ou meio de transporte
Necessita validação
Diagnóstico das Pneumonias
COLETA E TRANSPORTE DO MATERIAL CLÍNICO
ASPIRADO DE TRAQUEOSTOMIA E ENDOTRAQUEAL
Pacientes em ventilação mecânica
Utilizar sistema coletor
Processar imediatamente
Necessita validação
Fisioterapia respiratória UNESP
Diagnóstico das Pneumonias
COLETA E TRANSPORTE DO MATERIAL CLÍNICO
ASPIRADO TRANSTRAQUEAL
Material indicado quando da suspeita de bactérias anaeróbias
Coleta com auxílio de agulha, seringa e catéter
Processar imediatamente
Não necessita validação
Diagnóstico das Pneumonias
COLETA E TRANSPORTE DO MATERIAL CLÍNICO
BRONCOSCOPIAS
Lavado bronco-alveolar
Lavado brônquico
Escovado brônquico
Biópsia transbrônquica
Processar imediatamente
Não refrigerar
Não necessita validação
Diagnóstico das Pneumonias
COLETA E TRANSPORTE DO MATERIAL CLÍNICO
ASPIRADO PULMONAR
Transcutâneo
BIÓPSIA PULMONAR
Processo cirúrgico
Diagnóstico das Pneumonias
VALIDAÇÃO DA AMOSTRA
Seleção de Amostras de Escarro e Aspirado Traqueal para Cultivo
Grupo
REJEITAR
Comp. celular / número/ campo
Células epiteliais
Leucócitos
1
maior que 25
menor que 10
2
maior que 25
10 a 25
3
maior que 25
maior que 25
4
10 a 25
maior que 25
5
menor que 10
CULTIVAR
maior que 25
Campo de Pequeno aumento (10x)
Obs.: “O EXAME MICROSCÓPICO DEMONSTROU GRANDE QUANTIDADE DE CÉLULAS EPITELIAIS INDICANDO
CONTAMINAÇÃO OROFARINGEANA. FAVOR COLETAR NOVA AMOSTRA”.
Diagnóstico das Pneumonias
VALIDAÇÃO DA AMOSTRA
Em infecção por micobactérias, fungos, micoplasmas e vírus a
contaminação orofaringeana não é tão importante – uso de procedimentos e
meios específicos.
Em infecção por anaeróbios – escarro expectorado não tem valor –usar
aspirado transtraqueal
Número de leucócitos não deve ser levado em conta em pacientes
neutropênicos (doença de base, intubação prolongada), mas com contagem
baixa de células.
Legionelose – paciente geralmente imunodeprimido – não validar amostra
Diagnóstico das Pneumonias
CULTURA SEMI-QUANTITATIVA
Processamento da Amostra: Avaliar a parte mais purulenta da
amostra e semear (manipular em capela de fluxo laminar)
Meios de Cultura:
Ágar Sangue (AS)
Ágar Chocolate (AC)
McConkey (Mc)
Tipo de Semeadura: Estrias descontínuas
Incubação:
AS e Mc – 35-37°C, 48 a 72 h, examinadas após 18-24 h
AC - 35-37°C, em tensão de 5% de CO2 (jarra com vela)
48 a 72 h, examinadas após 18-24 h
Diagnóstico das Pneumonias
Identificar,
correlacionando o
crescimento c/
resultado do Gram
do material clínico.
CULTURA SEMI-QUANTITATIVA
Interpretação
Valorizar e identificar apenas as colônias com
crescimento predominante (tabela).
Grau
+
++
+++
++++
Número de colônias por quadrante
1º
2º
3º
Menor que 10
Maior que 10
Maior que 10
Maior que 10
Menor que 5
Maior que 5
Maior que 5
Menor que 5
Maior que 5
Diagnóstico das Pneumonias
CULTURA QUANTITATIVA
Processamento da Amostra
ESCARRO E ASPIRADO TRAQUEAL: Adicionar ao material coletado igual
volume de N-acetil-cisteína 1% (“Fluimucil”), agitar em vortex e incubar a 35oC
por 20 min ou à temperatura ambiente por no máximo 30 minutos.
ESCOVADO PROTEGIDO: Cortar a ponta da escova e colocá-la em um tubo
contendo 1 mL de salina estéril. Agitar em vortex.
LAVADO BRONCO-ALVEOLAR: Agitar o material em vortex.
Diagnóstico das Pneumonias
CULTURA QUANTITATIVA
Meios de Cultura:
Ágar Sangue (AS)
Ágar Chocolate (AC)
McConkey (Mc)
Tipo de Semeadura: alça calibrada de 0,001 mL (1µL) e de 0, 01 mL (10 µL)
semeadura p/ contagem de colônia (tipo urina)
Incubação:
AS e Mc – 35-37°C, 48 a 72 h, examinadas após 18-24 h
AC - 35-37°C, em tensão de 5% de CO2 (jarra com vela) 48
a 72 h, examinadas após 18-24 h
Diagnóstico das Pneumonias
CULTURA QUANTITATIVA
Realizar a contagem de colônias, fazendo a médias das placas (duas alças). Multiplicar
pelo fator da diluição considerando o volume da alça.
Identificar as bactérias que apresentarem crescimento conforme tabela
VALORES DE REFERÊNCIA, EM SECREÇÕES RESPIRATÓRIAS, PARA
DIAGNÓSTICO DE PNEUMONIA:
Secreção traqueal (escarro)________________________________ ≥ 106 UFC/mL
Parênquima pulmonar (biópsia) _____________________________≥ 104 UFC/g
Lavado bronco-alveolar (coletado por broncoscopia) ____________ ≥ 104 UFC/ml
Lavado bronco-alveolar protegido (coletado por broncoscopia) ____ ≥ 104 UFC/ml
Lavado bronco-alveolar coletado às cegas –(sem broncoscopia) __ ≥ 104 UFC/ml
Escovado protegido (coletado por broncoscopia) _______________≥ 103 UFC/ml
Escovado coletado às cegas (sem broncoscopia) _______________≥ 103 UFC/ml
FLUXOGRAMA PARA AMOSTRAS DE BRONCOSCOPIAS
Transferir a escova p/ frasco
com 1 ml de salina estéril
Agitar em Vortex
Gota
10 µl
Adicionar 0,1 ml em 0,9 ml
de Sol. Fisiol. estéril
Alça de 10µl
Diluição 1:1000
Diluição 1:10.000
AS
AC
MC
GRAM
Alça de 1µl
AS
Incubar a 35-37ºC (AC
na Jarra)
AC
MC
Aspirado Traqueal
Homogeneizar
Preparar esfregaços, corar
Gram. Avaliar amostra
(tabela)
AVALIAÇÃO
Grupo 1, 2 e 3 → Guardar em
geladeira e requisitar nova
amostra.
Grupo 4 e 5 → Processar
frasco com 1 ml de fluimucil
(Diluição 1:2)
1 ml
Homogeneizar (Vortex)
Frasco com 9,9 ml de salina
estéril.(diluição 1:100)
0,1 ml
AS
AC
AS
Alça de 1µl
Alça de 10µl
(diluição 1: 200.000)
(diluição 1: 20.000)
MC
AC
MC
Incubar a 35-37ºC (AC na Jarra)
Diagnóstico das Pneumonias
PROCEDIMENTOS ESPECIAIS
Nocardia spp
Bordetella pertussis
Chlamydia psitacci e C. trachomatis
Mycoplasma pneumoniae
Legionella spp (L. pneumophila)
Pneumonias
Prevenção/Tratamento
• Vacinas
• Antimicrobianos adequados
• Fisioterapia