VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
Química Geral
Classificação da Matéria
Substâncias: a classificação das diferentes substâncias é feita
de acordo com sua composição.
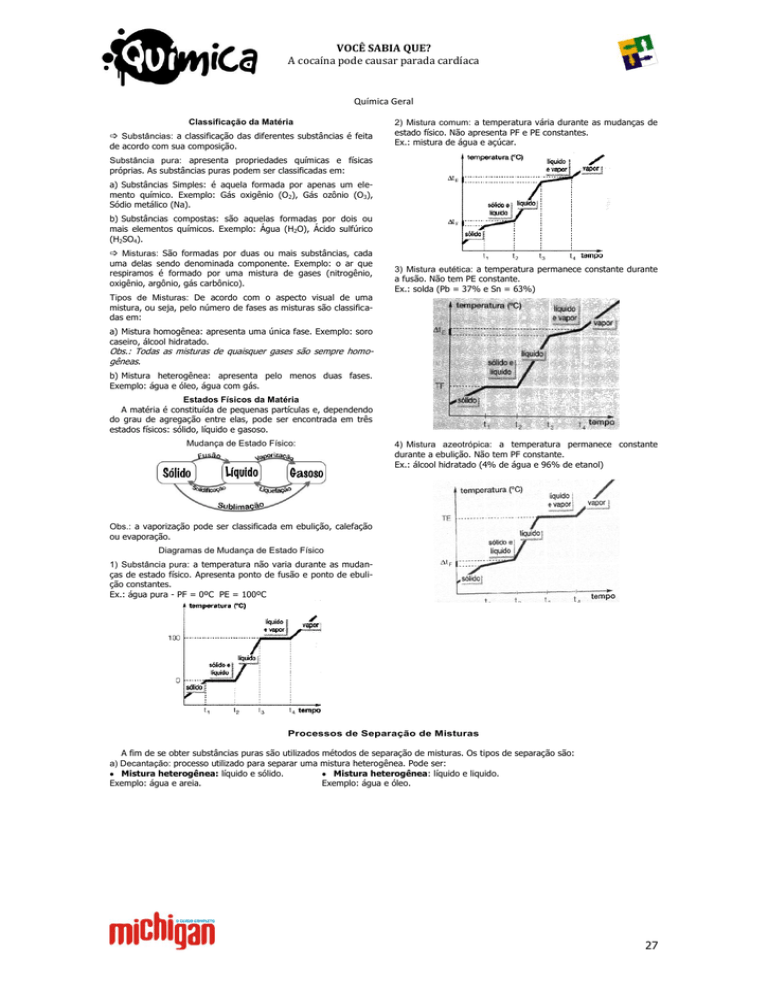
2) Mistura comum: a temperatura vária durante as mudanças de
estado físico. Não apresenta PF e PE constantes.
Ex.: mistura de água e açúcar.
Substância pura: apresenta propriedades químicas e físicas
próprias. As substâncias puras podem ser classificadas em:
a) Substâncias Simples: é aquela formada por apenas um elemento químico. Exemplo: Gás oxigênio (O2), Gás ozônio (O3),
Sódio metálico (Na).
b) Substâncias compostas: são aquelas formadas por dois ou
mais elementos químicos. Exemplo: Água (H2O), Ácido sulfúrico
(H2SO4).
Misturas: São formadas por duas ou mais substâncias, cada
uma delas sendo denominada componente. Exemplo: o ar que
respiramos é formado por uma mistura de gases (nitrogênio,
oxigênio, argônio, gás carbônico).
Tipos de Misturas: De acordo com o aspecto visual de uma
mistura, ou seja, pelo número de fases as misturas são classificadas em:
3) Mistura eutética: a temperatura permanece constante durante
a fusão. Não tem PE constante.
Ex.: solda (Pb = 37% e Sn = 63%)
a) Mistura homogênea: apresenta uma única fase. Exemplo: soro
caseiro, álcool hidratado.
Obs.: Todas as misturas de quaisquer gases são sempre homogêneas.
b) Mistura heterogênea: apresenta pelo menos duas fases.
Exemplo: água e óleo, água com gás.
Estados Físicos da Matéria
A matéria é constituída de pequenas partículas e, dependendo
do grau de agregação entre elas, pode ser encontrada em três
estados físicos: sólido, líquido e gasoso.
Mudança de Estado Físico:
4) Mistura azeotrópica: a temperatura permanece constante
durante a ebulição. Não tem PF constante.
Ex.: álcool hidratado (4% de água e 96% de etanol)
Obs.: a vaporização pode ser classificada em ebulição, calefação
ou evaporação.
Diagramas de Mudança de Estado Físico
1) Substância pura: a temperatura não varia durante as mudanças de estado físico. Apresenta ponto de fusão e ponto de ebulição constantes.
Ex.: água pura - PF = 0ºC PE = 100ºC
Processos de Separação de Misturas
A fim de se obter substâncias puras são utilizados métodos de separação de misturas. Os tipos de separação são:
a) Decantação: processo utilizado para separar uma mistura heterogênea. Pode ser:
Mistura heterogênea: líquido e sólido.
Mistura heterogênea: líquido e liquido.
Exemplo: água e areia.
Exemplo: água e óleo.
27
VOCÊ SABIA QUE?
O uso do crack leva a morte de forma rápida e violenta.
b) Filtração: processo utilizado para separar substâncias em misturas heterogêneas envolvendo
sólidos e líquidos.
c) Destilação: processo utilizado para separar uma mistura homogênea. Pode ser:
Destilação Simples: mistura homogênea entre sólido e líquido. Ex.: água e sal.
28
VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
Destilação Fracionada: mistura homogênea entre líquidos. Ex.: água e álcool.
Tipos de Fenômenos:
a) Fenômenos físicos: é todo aquele em que não há destruição
b) Fenômenos químicos: é toda transformação em que há
ou formação de substâncias. Nesses fenômenos, a forma, o
destruição de moléculas e formação de novas espécies químicas.
tamanho, a aparência e o estado físico podem mudar, porém a
Quando ocorre um fenômeno químico, uma o mais substâncias se
constituição da substância não sofre alterações. Ex.: as mudanças
transformam e dão origem a novas substâncias, logo podemos
de estado físico.
dizer que ocorreu uma reação química. Exemplo: queima de
materiais.
ESTRUTURA ATÔMICA
Número quântico secundário (l): está relacionado ao
subnível de energia do elétron.
CARACTERÍSTICAS DO ÁTOMO
Subnível
s
p
d
f
* Número Atômico (Z) : é o número de prótons presentes no
Valores
de
l
0
1
2
3
núcleo de um átomo.
Z=P
Obs.: átomos neutros e- = p
Número quântico magnético (m): está relacionado à
região de máxima probabilidade de se encontrar o elétron,
ÍONS: excesso de carga
denominada orbital.
Carga positiva – cátions ( perde elétrons)
s2
Carga negativa – ânions ( ganha elétrons)
0
* Número de Massa (A): é a soma do número de prótons e de
nêutrons.
A=Z+n
Obs.: n = A – Z
p6
d
-2 -1
Representação geral: z X A
Semelhanças Atômicas
Isótopos
Isóbaros
Isótonos
Z
=
A
p
=
f14
n
-1 0 +1
10
e
=
=
0 +1 +2
-3 –2 –1
0 +1 +2 +3
Número quântico spin (s): está relacionado à rotação do
elétron.
=
Isoeletrônicos: Átomos ou íons com nº e =
s = -1/2
ELETROSFERA
K
2
L
8
M
18
7 níveis (camadas)
O
P
Q
32
18
2 ou 8
N
32
qtdade máxima de es
2
4 subníveis
p
d
6
10
s = +1/2
Obs.: cada orbital suporta no máximo 2 elétrons de spins contrários
Obs.: elétron celibatário (elétron desemparelhado)
f
14
qtdade máxima de eNÚMEROS QUÂNTICOS
São os nº que caracterizam um elétron.
Número quântico principal (n): está relacionado com o
nível de energia do elétron.
n = 1,2,3,4,5,6 ou 7
Tabela Periódica
Na tabela, os elementos estão arranjados horizontalmente,
em seqüência numérica, de acordo com seus números atômicos,
resultando o aparecimento de sete linhas horizontais (ou períodos).
Elementos Químicos: Os elementos químicos são representados
por letras maiúsculas ou uma letra maiúscula seguida de uma
letra minúscula.
Os Símbolos são de origem latina:
Português
Sódio
Potássio
Enxofre
Fósforo
Latim
Natrium
Kalium
Sulphur
Phosphurus
Símbolo
Na
K
S
P
29
VOCÊ SABIA QUE?
O uso do crack leva a morte de forma rápida e violenta.
Ouro
Aurum
Au
Períodos ou Séries: São as filas horizontais da tabela periódica. São em número de 7 e indicam o número de níveis ou camadas preenchidas com elétrons.
Famílias ou Grupos: São as colunas verticais da Tabela Periódica. Em um Grupo ou Família, encontram-se elementos com propriedades
químicas semelhantes. Para os Elementos Representativos, o nº do Grupo representa o nº de elétrons da última camada (camada de
valência).
Classificação Periódica
Atual
Observações sobre a tabela:
Diagrama de Linus Pauling
1 - São elementos líquidos: Hg e Br;
2 - São Gases: He, Ne, Ar, Kr, Xe, Rn, Cl, N, O, F, H;
3 - Os demais são sólidos;
4 - Chamam-se cisurânicos os elementos artificiais de Z menor
que 92 (urânio): Astato (At); Tecnécio (Tc); Promécio (Pm)
5 - Chamam-se transurânicos os elementos artificiais de Z maior
que 92: são todos artificiais;
6 - Elementos radioativos: Do bismuto (83Bi) em diante, todos os
elementos conhecidos são naturalmente radioativos.
Propriedades Periódicas
- Raio e Eletropositividade
- Afinidade eletrônica
- Energia de ionização
- Eletronegatividade*
* gases nobres não apresentam eletronegatividade
Ligação química: É a força de atração suficientemente forte entre os átomos a fim de mantê-los unidos.
Valência: Capacidade de combinação dos átomos.
Regra do octeto: Os átomos, ao se unirem, procuram perder ou ganhar elétrons na última camada até atingirem a configuração eletrônica de um gás nobre.
Ligações Interatômicas
Ligação
Iônica
Elementos
Ligantes
Metais e ametais.
Metais e hidrogênio.
Grande diferença de eletronegatividade.
30
Pequena diferença de eletronegatividade.
Metálica
Metais
Alta eletropositividade
Compartilhamento de pares
de elétrons de valência através da formação de orbitais
moleculares.
Liberação parcial dos
elétrons mais externos,
formando uma estrutura
de cátions envoltos pelos
elétrons parcialmente
liberados.
Cristal iônico, representado Moléculas, representadas pela
pelo íon-fórmula ou fórmula
fórmula molecular ou cristal
mínima (mínimo de cátions e covalente (macro-molécula),
ânions necessários para que a representada pela reestrutura
soma das cargas elétricas
mínima seguida do índice n.
Cristal metálico, representado pelo símbolo do
elemento.
Transferência de elétrons dos
metais (que formam cátions)
Como ocorre a
para os ametais (que formam
ligação
ânions). Cátions e ânions
sofrem atração elétrica.
Unidade
formadora
Covalente
Ametais e ametais.
Ametais e hidrogênio.
Hidrogênio e hidrogênio.
VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
seja zero).
Cristal iônico de cloreto de
sódio.
íon-fórmula: NaCl.
Exemplo
importante
Molécula de água.
Fórmula molecular: H2O
Cristal metálico de alumínio.
Cristal covalente de diamante.
Representação: Al(s)
Representação: Cn(s)
Ligações Interatômicas
Definição e Ocorrência
As forças intermoleculares são as que mantêm a coesão das
moléculas ou partículas
que compõem uma
substância. Na prática,
as forças intermoleculares podem atuar em
conjunto e a interação
entre as moléculas é
calculada pela soma dos
diversos tipos de forças
intermoleculares atuantes. Por exemplo, na
água a principal força
de interação molecular
são as pontes de
hidrogênio, embora
também haja interações
do tipo dipolo permanente.
Forças de
Van der
Waals
Dipolo
Permanente
Pontes de
hidrogênio
São forças de natureza elétrica de intensidade fraca. Uma
das principais forças são as dispersões de London, ou seja,
interações que ocorrem entre moléculas apolares e átomos
de gases nobres quando, por um motivo qualquer, ocorre
uma assimetria na nuvem eletrônica de uma molécula ou
átomo, gerando um dipolo que induz as demais moléculas
ou átomos a também formarem dipolos. Na fase sólida,
formam cristais moleculares. He(l), Ne(l), CO2(S), Br2(l), I2(s)
Forças de natureza elétrica, que ocorrem entre moléculas
polares, de modo que a extremidade negativa do dipolo de
uma molécula se aproxime da extremidade positiva do
dipolo de outra molécula. Na fase sólida, orienta a posição
de cada molécula no espaço, formando os cristais dipolares.
HBr, HCl, HI, H2S, PH3
Forças de natureza elétrico do tipo dipolo permanente,
porém bem mais intensas. Ocorrem quando a molécula
possui hidrogênio ligado a um elemento muito eletronegativo: flúor F, oxigênio O ou nitrogênio N, de modo que o
hidrogênio de uma molécula estabelece uma ponte (ligação)
com o átomo muito eletronegativo de outra molécula. H2O,
HF, NH3
Número de Oxidação (Nox)
É o número que designa a carga elétrica real ou aparente de
um átomo em função da diferença de eletronegatividade entre ele
e seus ligantes.
Regras
Substância simples = 0
Íon simples = carga de íon
A soma dos Nox de todos os átomos da molécula = 0
Metais alcalinos e a Ag = + 1
Metais alcalinos-terrosos e o Zn = +2
Alumínio, Bismuto e Boro = +3
Silício = +4
Fluor = -1
Halogênios em qualquer halogeneto = - 1
Oxigênio: normal = -2
peróxidos= -1
superóxidos= -½
fluoretos= +1 e +2
Hidrogênio: normal= +1
hidretos iônicos = -1
Pt4+
Fe2(SO4)3
Fe2S3O12
CaCO3
+2 +4 -2
+6
+3
+2 +4 -6 = 0
+6
+18
NH4+
-3 +1
-2
-3 +4 = +1
-24 = 0
Pb4+
Mn4+
As5+
Bivalentes
-
F
fluoreto
O
Cl-
cloreto
O22-
peróxido
Br-
brometo
S2-
sulfeto
I
-
iodeto
2-
SO3
2-
sulfito
hipoclorito
SO42-
sulfato
ClO2-
clorito
S2O32-
tiossulfato
clorato
2-
carbonato
ClO3
-
CO3
CIO4-
perclorato
C2O42-
oxalato
NO2-
nitrito
SiO32-
metassilicato
NO3-
nitrato
SiF62-
fluorsilicato
cianeto
HPO32-
fosfito
OCN-
cianato
CrO42-
cromato
SNC-
tiocianato
Cr2O72-
dicromato
CN
-
-
metafosfato
MnO4
Bivalentes
Mg2+
Fe2+
Al3+
Au3+
Li+
Cu+
Ca2+
Mn2+
Bi3+
Fe3+
+
2+
2+
3+
Sb3+
3+
3+
+
Na
+
K
+
Rb
Cs+
Au
NH4
+
+
H3O
Sr
2+
Ba
2+
Pb
2+
Sn
2+
Ra
Pt
Zn2+
Cu2+
Co2+
Ni2+
Co
Cr
3+
Ni
As
3+
B
MnO32-
manganito
AlO2-
aluminato
SnO22-
estanito
MnO4
-
permanganato
SnO3
Tetravalentes
Pentavalentes
2-
estanato
OH-
hidróxido
PbO22-
plumbito
H-
hidreto
PbO32-
plumbato
Trivalentes
PO43AsO3
3-
AsO43-
Cd2+
manganato
hipofosfito
Trivalentes
Ag+
2-
H2PO2-
ZnO2
H+
óxido
ClO-
Principais Cátions
Monovalentes
Sb5+
Principais ânions
Monovalentes
PO3
Nox +7 a -7
Sn4+
SbO3
3-
SbO4
3-
BO33-
fosfato
2-
zincato
S2O62-
hipossulfato
S2O72-
pirossulfato
Tetravalentes
P2O74-
pirofosfato
4-
hipofosfato
arsenito
P2O6
arseniato
SiO44-
antimonito Fe(CN)6
silicato
4-
ferrocianeto
antimoniato
borato
31
VOCÊ SABIA QUE?
O uso do crack leva a morte de forma rápida e violenta.
Fe(CN)63- ferricianeto
Funções Inorgânicas: Veja o quadro que resume as principais funções inorgânicas
Função
Ácidos:
Conceito de
Arrhenius
Bases:
Conceito de
Arrhenius
Sais
Óxidos
Peróxidos
Superóxidos
Hidretos
Definição e Exemplos
São soluções aquosas iônicas que possuem como único cátion o hidrônio H3O+,
formado pela reação entre a água e
determinados compostos covalentes.
Exemplos: HCl(aq), H2SO4(aq), H3PO4(aq)
São compostos capazes de se dissociarem na água liberando íons, mesmo que
muito poucos, dos quais o único ânion é
o hidróxido OH1Exemplos: NaOH, Ca(OH)2, Al(OH)3
Propriedades
Conduzem corrente elétrica, possuem
sabor azedo e mantêm incolor uma
solução de fenolftaleína.
Só conduzem corrente elétrica as
bases de metais das famílias 1 e 2.
Possuem sabor adstringente e mudam
a cor de uma solução de fenolftaleína
para vermelho.
Só os sais predominantemente iônicos
São compostos capazes de se dissociaconduzem corrente elétrica, na fase
rem na água liberando íons, mesmo que
líquida ou em solução aquosa. Possumuito poucos, dos quais pelo menos um
em sabor salgado e mantêm ou
cátion é diferente de H3O+ e pelo menos
mudam a cor de uma solução de
um ânion é dirente de OH1-.
fenolftaleína conforme o caráter ácido
Exemplos: NaCl, NaHCO3, Mg(OH)Cl
ou básico.
Os óxidos de caráter iônico conduzem
São compostos binários (formados por
corrente elétrica na fase líquida. Com
dois elementos), onde o oxigênio é o
exceção do CO, NO e NO2, que são
elemento mais eletronegativo e apresenneutros, podem manter ou mudar a
ta NOX= 2-.
cor de uma solução de fenolftaleína
Exemplos: CO2, CaO, Al2O3
conforme reajam com a água formando ácido ou base.
São compostos binários formandos pelo
O H2O2 é molecular e se decompõem
oxigênio ligado a metais da família 1 ou
em meio básico em O2 e H2O. os
2 prata ou zinco, onde o oxigênio apredemais são iônicos, reagem com água
senta NOX = 1-.
produzindo base e H2O2 e com ácido
Exemplos: H2O2, Na2O2, ZnO2
produzindo sal e H2O2.
São compostos binários formandos pelo
São extremamente instáveis. Reagem
oxigênio e metais das famílias 1 ou 2, onde com água produzindo base, H2O2 e O2.
o oxigênio apresenta NOX médio 1/2Reagem com ácido, produzindo sal,
Exemplos: Na2O4, K2O4, CaO4
H2O2 e O2.
Os hidretos metálicos são instáveis e
São compostos que possuem o hidrogêreagem com água de modo violento
nio como elemento mais eletronegativo.
produzindo base e H2. Os hidretos
Exemplos: NaH, MgH2, LiAlH4
moleculares são estáveis e tóxicos.
Características Gerais dos Ácidos
Característica
Definição
Exemplos
Nomenclatura
Ácido + nome do ânion com terminação:
trocada de eto para ídrico
trocada de ito para oso
trocada de ato para ico
H2S(aq): ácido sulfídrico
H2SO3(aq): ácido sufuroso
H2SO4(aq): ácido sulfúrico
Presença de
oxigênio
Oxiácidos possuem oxigênio na fórmula.
Hidrácidos não possuem oxigênio
HClO3(aq), H3PO4(aq), HNO3(aq)
HCl(aq), HCN(aq), H2S(aq)
Grau de
ionização
Fortes: > 50% ou R > ou = 2
Semifortes: 5% < ou = < ou = 50% ou R < 2
Fracos: < 5% ou R < 2
Onde R = y - x para HxEzOy
Fortes: HCl(aq), HI(aq),
H2SO4(aq).
Semifortes: HF, H3PO4
Fracos: HCN, H3BO3
Ponto de
ebulição
Ponto de ebulição alto: ácidos fixos
Ponto de ebulição baixo: ácidos voláteis
H2SO4(aq) (340°C) e H3PO4(aq)
(213°C)
HCl(aq) (-85°C), HCN(aq)
(26°C)
Características Gerais das Bases
Nomenclatura
Solubilidade
em água
Força ou grau
de dissociação
32
Definição
Exemplos
Hidróxido + de + nome do cátion
NaOH: hidróxido de sódios
Fe(OH)2: hidróxido de ferro II
Fe(OH)3: hidróxido de ferro III
São solúveis as bases de metais alcalinos e de
amônios. As bases de metais alcalino-terrosos
são pouco solúveis e as demais são praticamente insolúveis.
São fortes as bases de metais alcalinos.
Semifortes as bases de metais alcalinoterrosos.
As demais bases são fracas.
O hidróxido de amônio é instável
NaOH: 0,95 (mol/L)2
Ca(OH)2: 1,3 . 10-6 (mol/L)3
Fe(OH)3: 6,0 . 10-38 (mol/L)4
Fortes: LiOH, NaOH, KOH
Semifortes: Mg(OH)2, Ca(OH)2
Fracas: AgOH, Zn(OH)2, Al(OH)3
<NH4OH(aq)> NH3(g) + H2O(l)
VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
Características Gerais dos Sais
Característica
Nomenclatura
Caráter em
solução aquosa
Solubilidade
em água
Definição
Exemplos
Nome do(s) ânion(s) + de + nome(s) do(s)
cátion(s)
O caráter do sal depende do cátion e do
ânion dos quais ele é formado. Sabendo que
o cátion do sal vem da base e o ânion do sal
vem do ácido, temos:
Sal ácido: cátion de base fraca e ânion de
ácido forte
Sal básico: cátion de base forte e ânion de
ácido fraco
Sal Neutro: cátion de base forte e ânion
de ácido forte ou cátion de base fraca e ânion
de ácido fraco
De modo geral são solúveis os sais que
contêm cátion de metal alcalino, metal
alcalino-terroso e amônio, e também os sais
que contêm ânion nitrato, e halogenetos
(com exceção dos halogenetos de Ag1+, Pb2+
e Cu1+). Os demais são poucos soluveis ou
praticamente insolúveis.
MgBr2: brometo de magnésio
Sal ácido: Al2(SO4)3. sulfato de
alumínio
Sal básico: NaHCO3, bicarbonato de sódio ou carbonato
"ácido" de sódio
Sal Neutro: NaCl, cloreto de
sódio
Solúvel: NaCl, KNO3, MgSO4
Pouco Solúvel: PbCl2, CaSO4
Quase insolúvel: BiS, Ba3(PO4)2
Características gerais dos Óxidos
Característica
Óxidos Iônicos
Óxidos Covalentes
Exemplos
Nomenclatura
óxido + de + nome
do cátion
Óxido + de + prefixo
de quantidade +
nome do elemento
Na2O: óxido de sódio
CuO: óxido de cobre II
CO2 dióxido de (mono)carbono
SO3: trióxido de (mono)enxofre
Caráter
básico
ácido (anidridos)
Na2O e CuO são básicos
CO2 e SO2 são ácidos
Reações
Reagem com água
produzindo base e
reagem com ácido
produzindo sal e
água
Reagem com água
produzindo ácido e
reagem com base
produzindo sal e
água
Na2O(s) + H2O(l) 2NaOH(aq)
CO2(g) + H2O(l) H2CO3(aq)
SO3(g) + 2KOH K2SO4(aq) +
H2O(l)
Além dos óxidos descritos, temos:
Óxidos neutros: Não possuem caráter ácido nem básico. São
todos covalentes: Ex: CO, NO e N2O. O gás N2O e conhecido
como gás hilariante, pois ao ser inalado produz uma sensação de
euforia.
Óxidos anfóteros: reagem com água formando base, reagem com
base como se fossem ácido formando sal e água e reagem com
ácido com se fossem bases, formando sal e água. São formados
por elementos de eletronegatividade média, que podem ser
metais ou semimetais.
Classificação das Reações Químicas
Equação química: É a representação gráfica e abreviada da
reação química.
2H2
reagentes
(1° membro)
+
½ O2 2H2O
produtos
(2° membro)
Equação iônica: É a equação química em que aparecem íons,
além de átomos e moléculas.
H+ + OH- H2O
- aumenta o nox: oxidação (perde elétrons)
- diminui o nox: redução (ganha elétrons)
- agente oxidante: substância onde encontra-se o elemento que
reduz
- agente redutor: substância onde encontra-se o elemento que
oxida
Relações de Massa
1 Mol --- M --- 6,02x1023 entidades químicas
1 Mol --- 22,4 L (CNTP)
Estequiometria
- Lei de Lavoisier: a reação deve estar sempre balanceada.
- Pureza e Rendimento: valores teóricos equivalem a 100%
Soluções: São misturas de duas ou mais substâncias que
apresentam aspecto uniforme. As soluções são sistemas homogêneos formados por uma ou mais substâncias dissolvidas (soluto) em outra substância em maior proporção na mistura (solvente).
Aspectos quantitativos das Soluções
massa da
solução
Reação de Síntese ou Adição
CaO+H2O Ca(OH)2
Reação de Análise ou Decomposição
H2O2 H2O + O2
Pirólise: calor
Fotólise: luz
Eletrólise: eletricidade
Reação de Deslocamento ou Simples Troca
Fe + 2HCl FeCl2 + H2
Reação de Dupla Troca ou Dupla Substituição
NaCl + AgNO3 AgCl + NaNO3
Reações de óxi-redução
=
massa do
soluto
+
massa do
solvente
m = m1 + m2
Unidades de Concentração
1) Concentração comum (C)
C
m1
V
Unidades: g/L, g/mL, g/cm3 , g.L-1
Obs.: 1 L = 1000 mL = 1000 cm3
2) Densidade (d)
d
m
V
Unidades: g/L, g/mL
3) Título e porcentagem em massa (τ ou T)
33
VOCÊ SABIA QUE?
O uso do crack leva a morte de forma rápida e violenta.
T
m1
m1
m2
Ex.: O soro glicosado possui 5 g de glicose em 95 g de água.
Calcule o título e a porcentagem em massa.
T=
5
= 0,05 x 100 = 5 %
5+95
Obs.: Título ou porcentagem em volume
Ex.: o álcool é formado por 96 mL de etanol e 4 mL de água.
T = 96
= 0,96 x 100 = 96%
96 + 4
4) Molaridade ou Concentração molar ou Concentração
em mol/L (M)
M=
m1
Mol x V(L)
Obs.: o volume deve ser necessariamente em Litros. Unidades:
mol/L ou M (molar)
Relações entre C, T, d, M
C = d x T = M x Mol
Obs.: C e d em g/L
TERMOQUÍMICA
É o estudo das quantidades de calor liberadas ou absorvidas
durante as reações químicas.
Exotérmicas: São as que liberam calor.
CH4(g) + 2O2(g)
CO2(g) + 2H2O(l) + 212,8 Kcal/Mol
Tipos de entalpia
calor absorvido ou liberado na
formação de 1 mol de substância, a
partir das substâncias simples no
estado padrão.
Entalpia de calor liberado na combustão total de
combustão
1 mol de substância no estado
Hc
padrão.
calor liberado na neutralização de 1
Entalpia de
equivalente-grama de um ácido por
neutralização
um equivalente-grama de uma base
Hn
no estado padrão
Entalpia de
formação
H0f
Energia de ligação
É a quantidade de calor absorvida na quebra de um mol
(6,02.1023) de ligações no estado padrão. H>0
Lei de Hess
A quantidade de calor liberada ou absorvida numa reação
química depende dos estados inicial e final da reação.
CINÉTICA QUÍMICA
É o estudo da velocidade das reações químicas e dos fatores
que nela influem.
Velocidade média: Vm
t
Fatores que influem na velocidade das reações: Temperatura,
Eletricidade, Estado físico, Pressão, Luz, Concentrações dos
reagentes
Catalisador: É a substância que aumenta a velocidade da reação,
sem ser consumida durante o processo.
O catalisador diminui a energia de ativação e não altera o H
da reação.
EQUILÍBRIOS QUÍMICOS
Reação reversível é aquela que se processa simultaneamente
nos dois sentidos.
aA + bB
V1
cC + dD
V2
Endotérmicas: São as que absorvem calor.
Cl2(g) 2 Cl(g) - 57,9 Kcal/Mol
V1 = velocidade da reação direta
V2 = velocidade da reação inversa
Constante de equilíbrio:
KC
[C ]c .[D]d
[A ]a.[B]b
Kc = constante de equilíbrio em função das concentrações molares
[ ] = concentrações molares no equilíbrio.
Kp
c
d
pC
. pD
paA pbB
Kp = constante de equilíbrio em função das pressões parciais
p = pressões parciais no equilíbrio
ECA = energia do complexo ativado
Hf = entalpia final
Hi = entalpia inicial
H = variação de entalpia
H
Hf
Hi
EA = energia de ativação energia mínima que as moléculas
devem possuir ao se chocarem, para haver reação.
Estado padrão (convenção)
Temperatura: 25°C ou 298 K
Pressão: 1 atm ou 760 mmHg
Estado físico: mais comum
Forma alotrópica: mais estável
Entalpia das substâncias simples: H = 0
34
Deslocamento do equilíbrio
Concentração A adição de uma substância desloca o equilíbrio
no sentido em que será consumida (lado oposto).
A retirada de uma substância desloca o equilíbrio no sentido em
que será refeita (mesmo lado).
Pressão Um aumento de pressão desloca o equilíbrio no
sentido do menor volume. Uma diminuição de pressão desloca o
equilíbrio no sentido de maior volume.
Temperatura Um aumento de temperatura desloca o equilíbrio
no sentido endotérmico. Uma diminuição da temperatura desloca
o equilíbrio no sentido exotérmico.
ESCALAS DE pH E pOH
[H+] . [OH-] = 10-14
[H+] = [OH-] solução neutra
[H+] > [OH-] solução ácida
[H+] < [OH-] solução básica
pH + pOH = 14
pH = 7 solução neutra
VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
pH > 7 solução básica
pH < 7 solução ácida
ELETROQUÍMICA
Pilhas
Oxidação
Redução
Ânodo
Cátodo
Pólo negativo Pólo positivo
Corrosão
Deposição
Elétrons migram da oxidação para a redução
- Representação oficial de uma pilha:
ânodo//cátodo
- Cálculo da voltagem:
∆E = ERed maior – ERed menor
Hibridação e geometria do Carbono
sp3: 4 lig. simples (tetraédrica)
sp2: 1 lig. dupla (trigonal plana)
sp: 1lig. tripla ou entre 2 duplas (linear)
Classificação de cadeias
Aberta (alifática ou acíclica):
Normal ou ramificada
Saturada ou insaturada
Homogênea ou heterogênea
Fechada (cíclica):
Alicíclica ou aromática
Alicíclica (sat. ou insat. e homog. ou hetg.)
Aromática (mononucleada ou polinucleada)
Química Orgânica
Destilação Fracionada do Petróleo
35
VOCÊ SABIA QUE?
O uso do crack leva a morte de forma rápida e violenta.
Funções Orgânicas
36
VOCÊ SABIA QUE?
A cocaína pode causar parada cardíaca
Isomeria plana
Isomeria espacial
Reações Orgânicas
* Esterificação
ácido carboxílico + álcool
éster + água
* Oxidação de Álcool
álcool primário
aldeído
ácido carboxílico
álcool secundário
cetona
álcool terciário
não sofre oxidação
* Hidrogenação de alcenos e alcinos
Quebra de ligação dupla ou tripla e acréscimo de H2
Bioquímica
* Glicídios
oses (monossacarídeos): aldoses (glicose)
cetoses (frutose)
osídios: dissacarídeos (sacarose)
polissacarídeos (amido e celulose)
* Lipídios
- óleos: obtido a partir de ácido graxo insaturado
- gordura: obtida a partir de ácido graxo saturado
37












