Aminoácidos
e Proteínas
PROTEÍNAS
As
proteínas
são
macromoléculas
abundantes
as
mais
nas
células
vivas.
Ocorrem
em
todas
as
células e em todas as
partes das mesmas.
FUNÇÕES DAS PROTEÍNAS
Formam estruturas de sustentação – colágeno e elastina
Transportam oxigênio – hemoglobina
Catalisam reações químicas – enzimas
Atuam no controle do metabolismo – hormônios
São componentes de mecanismos contráteis – actina e
miosina
Coagulação sanguínea – fibrinogênio
Defesa – reação a proteínas estranhas (antígeno/anticorpo)
Controla a atividade de genes
CONSTITUIÇÃO DOS AMINOÁCIDOS
Os aminoácidos apresentam em sua molécula um grupo
amino (-NH2) base e, e um grupo carboxila (-COOH). Em pH
fisiológico eles apresentam-se ionizados.
Fórmula básica dos aminoácidos:
pH neutro
-NH2: amino, é uma base
fraca que é um receptor de
prótons (H+).
-COOH:
carboxila,
atua
como um ácido fraco, que
doa prótons
- R: cadeia lateral
SOLUBILIDADE DOS AMINOÁCIDOS
Os aa, podem ser classificados pelos seus grupos R:
De acordo com sua solubilidade em água os aminoácidos se
classificam em:
-Apolares (hidrofóbicos): pouca ou nenhuma solubilidade em
água – glicina, alanina, valina, leucina, isoleucina, prolina,
metionina, fenilalanina e triptofano.
-Polares (hidrofílicos): altamente solúveis em água (-OH, SH, -NH2 ou –COOH).
- neutros: mesmo número de carga positiva e negativa –
asparagina, glutamina, cisteína, serina, treonina e tirosina.
- ácidos: com predomínio de carga negativa – aspartato e
glutamato
- básicos: com predomínio de carga positiva – arginina,
histidina e lisina.
SOLUBILIDADE DOS AMINOÁCIDOS
SOLUBILIDADE DOS AMINOÁCIDOS
SOLUBILIDADE DOS AMINOÁCIDOS
Aa essenciais
Fenilalanina Valina Treonina Triptofano Isoleucina
Metionina
Histidina Lisina
Arginina
Leucina
PROTEÍNAS
Alanina Asparagina Aspartato
Cisteína
Glutamato
Glutamina Glicina Prolina Serina Tirosina
Aa não-essenciais
OS AMINOÁCIDOS – ÁCIDOS E BASES
Os aa, podem agir como ácidos e bases (NATUREZA
ANFOTÉRICA)
1- Em ambientes ácidos há mais prótons (H+), portanto o
ácido fica protonado (COOH), tanto quanto a base (NH3+).
2- Quando o pH vai subindo, com a adição de hidroxila (OH),
o grupo ácido libera o próton.
3- Quando é adicionado mais (OH-), não há mais prótons no
grupo ácido, então ele retira o próton do grupo amino.
SOLUBILIDADE DOS AMINOÁCIDOS
SOLUBILIDADE DOS AMINOÁCIDOS
SOLUBILIDADE DOS AMINOÁCIDOS
PROTEÍNAS – LIGAÇÃO PEPTIDICA
Os dipeptídeos e proteínas são formados por ligações
peptídicas entre aminoácidos.
Ligação peptídica: ligação do grupo carboxila (COOH) de um
aminoácido com o grupo amino (NH2) de outro, com a saída
de 1 molécula de água.
PROTEÍNAS – LIGAÇÃO PEPTIDICA
PEPTÍDEOS E PROTEÍNAS
A cadeia poliptídica pode apresentar de 2
aminoácidos.
2 aa: dipeptídeo
3 aa: tripeptídeo
Até 30 aa: oligopeptídeo
> 30 aa polipetídeo
> 50 aa proteínas C
a milhares de
ESTRUTURA DAS PROTEÍNAS
Estrutura primária: é a sequência de aa ao longo da cadeia
polipetídica. Começa na porção amino e termina na porção
carboxila.
ESTRUTURA DAS PROTEÍNAS
Estrutura secundária: descreve a formação de estruturas regulares pela
cadeia polipeptídica.
Alfa-hélice: ocorre o enrolamento da cadeia ao redor de um eixo
mantidas por pontes de hidrogênio, formando uma mola ou hélice, cada
volta tem 3,6 aa., ex. cabelo e lã (estrutura elástica).
ESTRUTURA DAS PROTEÍNAS
Folha beta pregueada: estrutura mantida por pontes de hidrogênio entre
os aa de cadeias diferentes dispostos paralelamente. Estrutura flexível
porém não elástica (fios de seda).
ESTRUTURA DAS PROTEÍNAS
Estrutura terciária: o dobramento final da cadeia polipeptídica
por interação de regiões alfa-hélice ou folha beta-pregueada
ou regiões sem estrutura definida.Confere às proteínas sua
atividade biológica específica.
ESTRUTURA DAS PROTEÍNAS
Estruturas terciárias são estabilizadas por ligações fracas
que estabilizam os dobramentos da estrutura terciária.
TIPOS DE LIGAÇÕES:
Pontes de hidrogênio: estabelecida entre as cadeias laterais
de aa polares: serina, treonina e tirosina
Interações hidrofóbicas: formadas entre as cadeias laterais
dos aa apolares: glicina, alanina, isoleucina ,etc.
Ligações eletrostáticas ou iônicas: interações de grupos com
cargas opostas. Importante para o dobramento da cadeia.
Localizados na superfície da proteína.
ESTRUTURA DAS PROTEÍNAS
ESTRUTURA DAS PROTEÍNAS
Estrutura quaternária: associação de 2 ou mais cadeias
polipeptídicas para formar 1 proteína funcional. Ex:
hemoglobina com 4 cadeias polipeptídicas.
ESTRUTURA DAS PROTEÍNAS
ESTRUTURA DAS PROTEÍNAS
FORMA DAS PROTEÍNAS
As proteínas, segundo a sua forma, podem ser chamadas de
globulares ou fibrosas.
Proteínas globulares: são proteínas com formato final esférico e
com alta solubilidade em água. Ex: tripsina – proteína enovelada,
cadeias laterais hidrofóbicas no interior da molécula e cadeias
laterais ionizadas no exterior interagindo com a água.
Albuminas: solúveis em água, desnaturadas pelo calor,
ovoalbumina, albumina sérica.
Globulinas: levemente solúveis em água, desnaturadas pelo calor,
globulina sérica
Lipoproteínas: lipídios como colesterol e triglicerídeos não são
solúveis em água, devendo ser complexados com uma proteína
transportadora hidrossolúvel.
FORMA DAS PROTEÍNAS
As proteínas, segundo a sua forma, podem ser chamadas de
globulares ou fibrosas.
Proteínas globulares: são proteínas com formato final esférico e
com alta solubilidade em água. Ex: tripsina – proteína enovelada,
cadeias laterais hidrofóbicas no interior da molécula e cadeias
laterais ionizadas no exterior interagindo com a água.
Albuminas: solúveis em água, desnaturadas pelo calor,
ovoalbumina, albumina sérica.
Globulinas: levemente solúveis em água, desnaturadas pelo calor,
globulina sérica
Lipoproteínas: lipídios como colesterol e triglicerídeos não são
solúveis em água, devendo ser complexados com uma proteína
transportadora hidrossolúvel.
FORMA DAS PROTEÍNAS
Proteínas fibrosas:
1- Contém quantidades maiores de estrutura secundária
regular
2- Apresenta forma de cilindro longo
3- Apresenta baixa solubilidade em água
4- Apresenta função estrutural
Exemplos:
Alfa queratina: 2 ou 3 cadeias de alfa-hélice associados
formando longos cabos. Epiderme, cabelo, lã, chifres, unhas,
cascos, bicos, penas etc.
FORMA DAS PROTEÍNAS
Colágeno: composto por
glicina,
prolina
e
hidroxiprolina
Beta queratina: as fibras
são
formadas
por
empilhamento em folhas
beta pregueadas. Ex:
fios de seda e teia de
aranha
DESNATURAÇÃO DAS PROTEÍNAS
A proteína é dita desnaturada quando sua
conformação nativa é destruída, devido a
quebra
de
ligações
não
covalentes,
resultando em uma cadeia distendida
DESNATURAÇÃO DAS PROTEÍNAS
Fatores que provocam desnaturação:
Aquecimento: aquecimento da proteína nativa provoca
rompimento de ligações não-covalentes
PH: muito alto ou muito baixo, conferem à molécula uma
elevada carga positiva ou negativa ocasionando uma
repulsão intramolecular, expondo o interior hidrofóbico.
Uréia: substituem as ligações que mantinham a estrutura
nativa da molécula
Detergentes: introdução de sua cauda hidrofóbica no interior
apolar da proteína rompe ligações hidrofóbicas.
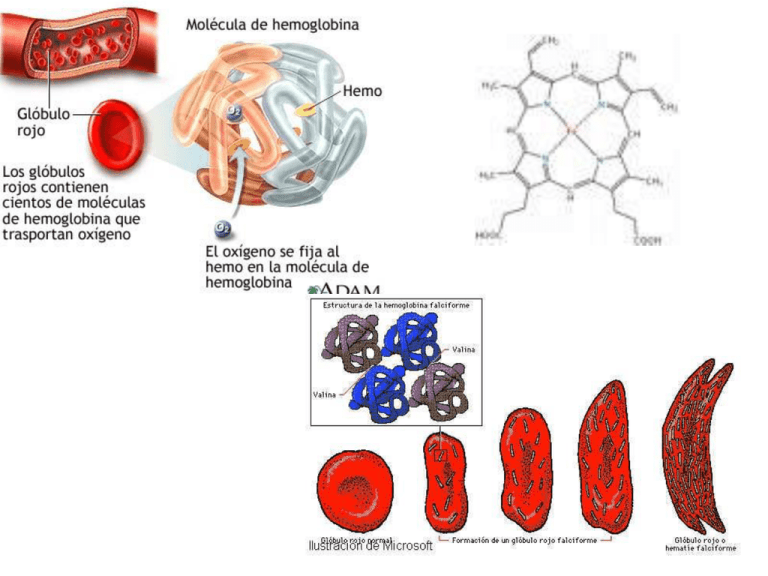
ANEMIA FALCIFORME
Doença resultante de uma mutação com substituição de
ácido glutâmico (grupo R com carga negativa) por valina
(grupo R hidrofóbico). As moléculas da hemoglobina
substituída sofrem agregação quando estão desoxigenadas.
Os agregados formam um preciptado fibroso que distorce as
hemácias adquirindo forma de foice, que obstruem capilares
impedindo a oxigenação.
DIGESTÃO DE PROTEÍNAS
Locais:
estômago
• intestino
•
Síntese das
enzimas:
• estômago
• pâncreas
• intestino
DIGESTÃO DE PROTEÍNAS - ENZIMAS
• Pepsina
•
•
•
•
Tripsina
Quimotripsina
Elastase
Carboxipeptidases
•
•
•
•
Enteropeptidase
Aminopeptidases
Dipeptidases
Tripeptidases
Estômago
Pâncreas
Intestino Delgado
Digestão
Proteínas da dieta
Lúmen Intestinal
Aminoácidos
40%
Capilares
aa
+
Dipeptídios
Tripeptídios
60%
Enterócito
Aminoácidos
aa
Dipeptidases
Tripeptidase
Somente fetos e recém-nascidos são capazes de captar algumas
proteínas sem digestão prévia (por pinocitose). Imunoglobulinas do
colostro do leite são absorvidas intactas fornecendo imunidade
passiva.
Fato sem importância em termos nutricionais










