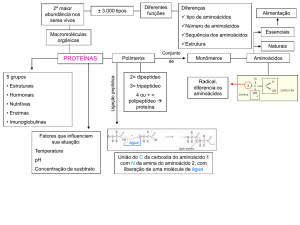
Componentes fundamentais de todos os seres vivos,
incluindo os vírus.
Macromoléculas de elevado peso molecular.
Formadas pela união de dezenas a centenas de
aminoácidos.
Proteína = polipeptídeo formado por uma cadeia de
vários aminoácidos (mais de 50).
AMINOÁCIDOS
Unidade estrutural das proteínas.
Composição química: C, H, O, N e S (alguns casos).
Existem 20 tipos diferentes, todos com a mesma estrutura química
básica, se diferenciando apenas pelo radical (R).
Podem ser classificados como:
Aminoácidos essenciais: não são sintetizados a partir de
outros, devendo estar presentes na dieta.
Aminoácidos não essenciais ou naturais: são sintetizados a
partir de outros.
Curiosidades:
Nosso organismo sintetiza 11 dos 20 aminoácidos de que
necessitamos;
Os vegetais sintetizam todos os aminoácidos de que necessitam a
partir das cadeias de carbono obtidas pela fotossíntese.
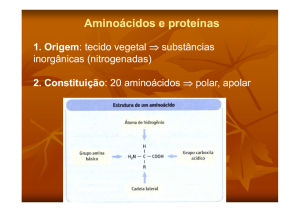
ESTRUTURA DOS AMINOÁCIDOS
Grupo Amina: NH2
Carbono Central: Carbono α
Grupo Carboxila: COOH
Radical: R (Variável para cada um dos 20 tipos de aminoácidos)
ESTRUTURA DOS AMINOÁCIDOS
LIGAÇÃO PEPTÍDICA
Ligação entre dois aminoácidos vizinhos ao longo de
toda cadeia proteica.
Reação de síntese por desidratação.
Ocorre entre o grupamento amina de um aminoácido e o
grupamento carboxila do aminoácido vizinho.
Através dela, formam-se:
Dipeptídeo: 2 aminoácidos
Tripeptídeo: 3 aminoácidos...
Polipeptídeo: mais de 20 aminoácidos
Proteína: mais de 50 aminoácidos
CLASSIFICAÇÃO DAS PROTEÍNAS
Proteínas Simples
• Apenas cadeias de aminoácidos em sua composição.
• Ex.: albumina
Proteínas Compostas
• Cadeias de aminoácidos, ligadas a um grupo prostético*
(carboidrato, lipídio, fósforo, ferro...)
• Ex.: hemoglobina
* Componente de natureza não-proteica, presente em proteínas conjugadas,
que é essencial para a atividade biológica das proteínas. Os grupos prostéticos
podem ser orgânicos (vitamina, carboidrato, lipídio) ou inorgânicos (íons
metálicos) e encontram-se ligados de forma firme à cadeia polipeptídica,
muitas vezes através de ligações covalentes.
EXEMPLOS DE PROTEÍNAS
Albumina
Cadeia polipeptídica formada por
609 aminoácidos.
Elevado valor nutricional.
Presente principalmente na clara do
ovo, no leite e no sangue.
Também é sintetizada no fígado
pelos hepatócitos.
Usada como suplemento alimentar
para aumento da massa muscular.
Usada em tratamentos relacionados
com queimaduras e hemorragias
graves.
Hemoglobina
Formada
por
4
cadeias
polipeptídicas interligadas, contendo
574 aminoácidos.
Presente nas hemácias (glóbulos
vermelhos).
Contém em sua estrutura química o
elemento ferro (grupamento prostético
heme)
Ligação ao oxigênio e transporte do
mesmo pelas células sanguíneas.
Uma mutação em um único
aminoácido da cadeia da hemoglobina
causa uma doença genética chamada
de anemia falciforme.
Hemoglobina e a Anemia Falciforme
Indivíduo afetado possui
hemácias em forma de
foice.
Deficiência na circulação
dessas
células
e
no
transporte de oxigênio.
Viscosidade sanguínea,
aglomeração
celular,
coágulos, dores agudas,
necessidade constante de
transfusões sanguíneas.
A ARQUITETURA DAS PROTEÍNAS
As proteínas podem diferir quanto:
À quantidade
polipeptídica;
de
aminoácidos
na
cadeia
Aos tipos de aminoácidos que compõem a cadeia
polipeptídica;
À sequência de aminoácidos da cadeia polipeptídica;
Ao formato da molécula (estrutura tridimensional).
A ARQUITETURA DAS PROTEÍNAS
1) ESTRUTURA PRIMÁRIA
Sequência linear de aminoácidos na cadeia polipeptídica.
Determinada geneticamente.
Definida pelo código genético presente no DNA de cada
espécie)
É o “número de identidade” da proteína, pois determina a
função desta.
A ARQUITETURA DAS PROTEÍNAS
1) ESTRUTURA PRIMÁRIA
IMPORTANTE
A simples substituição de um único aminoácido na estrutura
primária de certas proteínas pode prejudicar seu funcionamento
e inclusive mudar a identidade desta proteína. A anemia
falciforme, por exemplo, deve-se ao fato de existir, na pessoa
afetada, moléculas de hemoglobina com morfologia alterada
(forma de foice), prejudicando assim as funções biológicas dos
glóbulos vermelhos no sangue.
A ARQUITETURA DAS PROTEÍNAS
2) ESTRUTURA SECUNDÁRIA
Ocorre quando as cadeias
polipeptídicas enrolam-se em
forma de hélice.
Pontes de hidrogênio ligam
os átomos de H, e de O dos
aminoácidos em intervalos
regulares.
É o “fio
enrolado”.
do
telefone
A ARQUITETURA DAS PROTEÍNAS
3) ESTRUTURA TERCIÁRIA
Os filamentos em forma de hélice da
estrutura secundária dobram-se sobre si
mesmos e se mantêm unidos por pontes
de enxofre.
Define a forma
espacial da proteína.
tridimensional,
Está diretamente relacionada com as
funções biológicas exercidas pela
proteína.
Típica de proteínas globulares.
É o “fio do telefone enrolado sobre si
mesmo várias vezes”.
A ESTRUTURA TERCIÁRIA E A DESNATURAÇÃO PROTEICA
A desnaturação é uma alteração da estrutura terciária da
proteína, modificando assim a sua estrutura espacial,
tridimensional.
Pode ser reversível ou não.
Em alguns casos, a desnaturação provoca perda de função
da proteína.
Obs: Não há alteração da
sequência
de
aminoácidos
(estrutura primária) da proteína.
Ex.: clara do ovo aquecida
AGENTES DESNATURANTES
Aumento de temperatura (cada proteína suporta certa
temperatura máxima, se esse limite é ultrapassado, ela
desnatura);
Extremos de pH;
Solventes orgânicos miscíveis com a água (etanol e acetona);
Solutos (uréia);
Exposição a detergentes;
Agitação vigorosa da
abundante de espuma.
solução
proteica
até
formação
A ESTRUTURA TERCIÁRIA E A DESNATURAÇÃO PROTEICA
A ARQUITETURA DAS PROTEÍNAS
4) ESTRUTURA QUATERNÁRIA
Ocorre em algumas proteínas (ex. hemoglobina).
Duas ou mais cadeias polipeptídicas se unem , através de
ligações de pontes de hidrogênio.
A IMPORTÂNCIA BIOLÓGICA DAS PROTEÍNAS
As proteínas podem ser agrupadas em várias categorias de
acordo com a sua função. De maneira geral, as proteínas
desempenham nos seres vivos as seguintes funções:
Proteínas Estruturais: participam da estrutura das células e tecidos.
• Colágeno: proteína de alta resistência, encontrada na pele, nas
cartilagens, nos ossos e tendões.
• Actina e Miosina: proteínas contráteis, abundantes nos músculos,
onde participam do mecanismo da contração muscular.
• Queratina: proteína impermeabilizante encontrada na pele, no
cabelo e nas unhas. Evita a dessecação, o que contribui para a
adaptação do animal à vida terrestre.
• Albumina: proteína mais abundante do sangue, relacionada com a
regulação osmótica e com a viscosidade do plasma (porção líquida
do sangue).
Proteínas Hormonais: muitos hormônios de nosso organismo são de
natureza proteica. Podemos caracterizar os hormônios como
substâncias produzidas pelas glândulas endócrinas e que, uma vez
lançadas no sangue, vão estimular ou inibir a atividade de certos
órgãos. É o caso do insulina e do glucagon, hormônios produzidos no
pâncreas e que se relacionam com e manutenção da glicemia. Outros
exemplos: hormônios da tireóide, da hipófise etc.
Proteínas de Defesa: Existem células no organismo capazes de
"reconhecer" proteínas "estranhas" que são chamadas de antígenos.
Na presença dos antígenos o organismo produz proteínas de defesa,
denominados anticorpos. O anticorpo combina-se, quimicamente,
com o antígeno, de maneira a neutralizar seu efeito. A reação
antígeno-anticorpo é altamente específica, o que significa que um
determinado anticorpo neutraliza apenas o antígeno responsável
pela sua formação. Os anticorpos são produzidos por certas células
de corpo (como os linfócitos, um dos tipos de glóbulos brancos do
sangue). São proteínas denominadas gamaglobulinas.
Proteínas de Nutrição: Servem como fontes de aminoácidos,
incluindo os essenciais requeridos pelo homem e outros animais.
Esses aminoácidos podem, ainda, ser oxidados como fonte de
energia no mecanismo respiratório. Nos ovos de muitos animais
(como os das aves) o vitelo, material que se presta à nutrição do
embrião, é particularmente rico em proteínas.
Proteínas de Coagulação: vários são os fatores da coagulação que
possuem natureza proteica, como por exemplo: fibrinogênio,
globulina anti-hemofílica, protrombina, presentes no plasma.
Proteínas de Transporte: Participam do transporte de gases
respiratórios. A principal é a hemoglobina, proteína responsável
pelo transporte de oxigênio no sangue.
Proteínas Enzimáticas: As enzimas são fundamentais como moléculas
reguladoras das reações biológicas. Dentre as proteínas com função
enzimática podemos citar, as lipases, as proteases, as carboidrases
etc.
IMPORTANTE
TODA ENZIMA É UMA PROTEÍNA, MAS NEM TODA PROTEÍNA É
UMA ENZIMA.
ENZIMAS
Tipos especiais de proteínas que atuam como catalisadores
biológicos, acelerando as reações químicas e diminuindo a
energia de ativação das reações que ocorrem no interior das
células.
ENZIMAS
NOMENCLATURA
1) Radical do nome do substrato + sufixo ASE
Ex.: lactase, lipase, sacarase, amilase.
2) Radical do nome da reação catalisada pela enzima + sufixo ASE
Ex.: hidrolase, polimerase, oxirredutase.
3) Denominações consagradas pelo uso
Ex.: ptialina, pepsina, tripsina.
Obs:
Catalase
Importância na degradação do peróxido de hidrogênio (H2O2),
produzido após o metabolismo de gorduras. É um enzima
produzida no fígado.
ENZIMAS
PROPRIEDADES
1) São catalisadores específicos
Para cada tipo de substrato existe um tipo de enzima.
MODELO CHAVE-FECHADURA
A enzima possui uma conformação tridimensional que se
encaixa perfeitamente ao seu substrato, na maioria dos casos.
Essa região de encaixe é chamada de centro ativo (sítio ativo).
Algumas vezes o centro ativo da enzima não possui a forma
idêntica de seu substrato. Isso só ocorre a enzima se liga ao
substrato. É o que chamamos de encaixe induzido.
MODELO CHAVE-FECHADURA
ENZIMAS
PROPRIEDADES
2) Não sofrem modificações durante as reações que, em geral,
são reversíveis.
FATORES QUE INFLUENCIAM NAS REAÇÕES ENZIMÁTICAS
INIBIDORES E ATIVADORES ENZIMÁTICOS
Ambos são capazes de se ligar ao centro ativo da enzima.
Podem complementar a forma de encaixe da enzima ao seu
substrato (ativadores).
Ex.: COFATORES (íons, como Mg+2, Ca+2)
COENZIMAS (moléculas orgânicas, como vitaminas (Coenzima
A, formada pela vitamina B5)
Podem impedir a ligação da enzima ao seu substrato
(inibidores)
Ex.: Cianeto (inibe enzimas da cadeia respiratória, antibióticos
inibem enzimas bacterianas...)
ATIVAÇÃO ENZIMÁTICA
INIBIÇÃO ENZIMÁTICA
INIBIÇÃO ENZIMÁTICA
INIBIÇÃO ENZIMÁTICA
FATORES QUE INFLUENCIAM NAS REAÇÕES ENZIMÁTICAS
FATORES QUE INFLUENCIAM NAS REAÇÕES ENZIMÁTICAS
CONCENTRAÇÃO DE SUBSTRATO
Quanto maior a concentração do substrato, maior será a
velocidade da reação enzimática, até um certo ponto.
A partir deste ponto, as enzimas estarão todas ligadas a um
substrato e a velocidade da reação permanecerá a mesma.
FATORES QUE INFLUENCIAM NAS REAÇÕES ENZIMÁTICAS
TEMPERATURA
Cada enzima possui uma temperatura ótima, na qual a
velocidade da reação é máxima.
A elevação da temperatura acelera as reações químicas porque
aumenta o movimento vibratório das moléculas.
Para cada tipo de organismo, existe uma temperatura ótima.
A queda na velocidade da reação
após a temperatura ótima ocorre em
função da desnaturação da enzima.
Quando aquecida em excesso, a
enzima
(proteína)
perde
sua
configuração tridimensional e se
desnatura.
FATORES QUE INFLUENCIAM NAS REAÇÕES ENZIMÁTICAS
pH
Cada enzima possui um pH ótimo, no qual a velocidade da
reação é máxima.
O grau de acidez ou de basicidade do meio interfere na
atividade enzimática.
Em nosso corpo, temos tecidos e órgãos com diferentes valores
de pH. As enzimas que atuam em cada um desses locais devem ter
como pH ideal o pH da região onde atuam.
Controle da produção enzimática
• Feedback negativo ou retroinibição
Objetivo: a quantidade disponível de X tende a se manter constante.