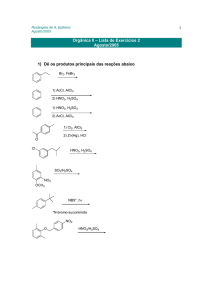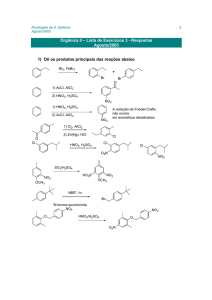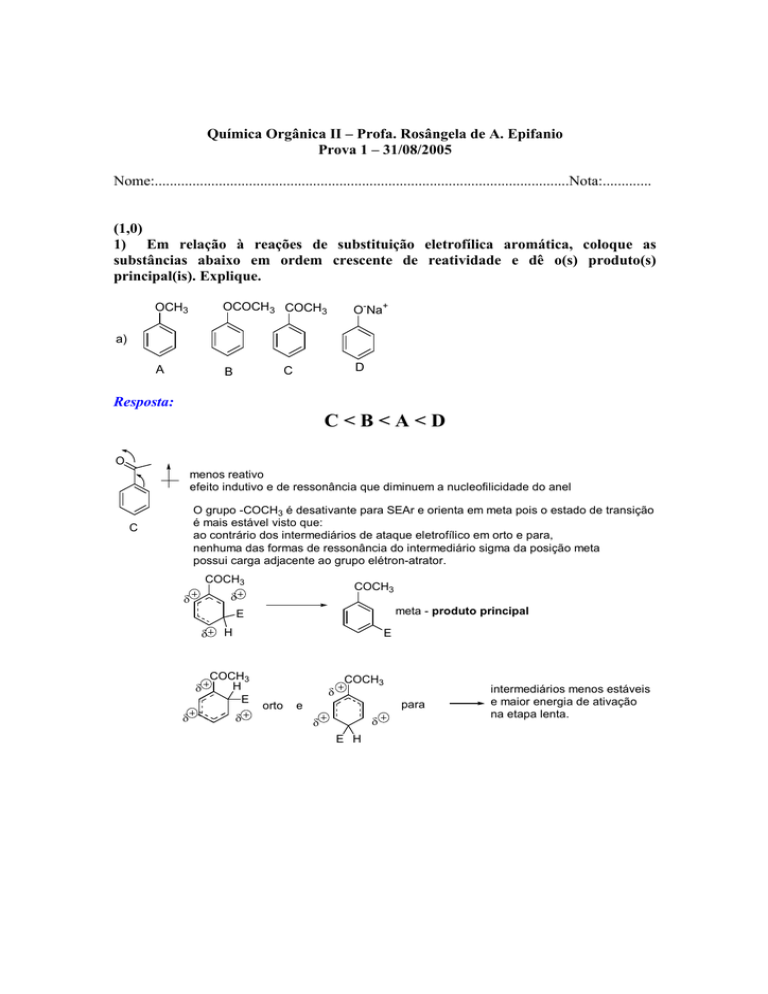
Química Orgânica II – Profa. Rosângela de A. Epifanio
Prova 1 – 31/08/2005
Nome:..............................................................................................................Nota:.............
(1,0)
1) Em relação à reações de substituição eletrofílica aromática, coloque as
substâncias abaixo em ordem crescente de reatividade e dê o(s) produto(s)
principal(is). Explique.
OCH3
OCOCH3 COCH3
A
B
O-Na+
a)
D
C
Resposta:
C<B<A<D
O
menos reativo
efeito indutivo e de ressonância que diminuem a nucleofilicidade do anel
O grupo -COCH3 é desativante para SEAr e orienta em meta pois o estado de transição
é mais estável visto que:
ao contrário dos intermediários de ataque eletrofílico em orto e para,
nenhuma das formas de ressonância do intermediário sigma da posição meta
possui carga adjacente ao grupo elétron-atrator.
C
COCH3
COCH3
δ
δ
meta - produto principal
E
δ
δ
δ
H
E
COCH3
H
E
δ
δ
orto
COCH3
para
e
δ
δ
E H
intermediários menos estáveis
e maior energia de ativação
na etapa lenta.
O
R = Ac, Me ou
R
As substâncias A, B e D são ativantes para reações de SEAr
Apesar do oxigênio ser mais eletronegativo do que o carbono, o par de elétrons
não ligantes do oxigênio pode fazer ressonância com o anel, aumentando a sua
nucleofilicidade, diminuindo a energia de ativação do intermédiário da etapa lenta
e aumentando a velocidade da reação
δ O R
δ
δ
δ
Nos três casos as posições orto e para serão ativadas.
Os intermediários da etapa lenta são mais estáveis, possuindo uma forma
extra de ressonância em relação ao intermediário em meta
O
R
O
R
E
H
para
E
orto
H
Comparando A, B e D:
OCOCH3
Em relação a A e D o par de elétrons (os pares) do oxigênio está(ão)
menos diponível(is) devido a ressonância com a carbonila
B
O
Ar O
O
Deste modo, B é menos reativo do que A e D
Ar O
OCOCH3
E
O produto principal deve ser em para.
O intermediário em orto deve ser menos
estável devido a interações espaciais
desfavoráveis com o grupo -OCOCH3
Comparando agora A e D:
e ... "Lembrando": Vimos em sala de aula p. ex. que a polibromação do fenol em H2O pode ser controlada (no produto
mono, di ou tri bromado) dependo da concentração de bromo usada. No entanto, em meio básico forma-se apenas o
tribromado, independente da diluição.....
O
OCH3
Na
Existem várias maneiras de explicar o porque que D é mais
reativo do que A
e
D
A
Por exemplo, em D os intermediários da etapa lenta terão estruturas de ressonância sem carga (e por isso
mais estáveis):
O
O
E
H
orto
Neste caso será difícil controlar a monossubstituição e
o produto deve ser o trissubstituído pelo eletrófilo
O-Na+
E
E
para
ou
E H
E
Para A, assim como C, o produto majoritário será o de substituição em para (pelo mesmo motivo que em C)
OCH3
E
(2,0)
2) A reação de acetofenona (1-fenil-etanona) com Br2/FeBr3 fornece um único
produto.
a) Qual?
O
O
Br2, FeBr3
m-bromo-acetofenona
acetofenona
Br
b) Utilizando as mesmas condições reacionais, esta reação seria mais rápida ou mais lenta
em relação a bromação do benzeno? Explique.
A reação é mais lenta para a acetofenona em relação ao benzeno já que o grupo acila (-COCH3)
é desativante para SEAr. Em outras palavras, o intermediário da reação (complexo π) é menos
estável devido ao efeito eletron-atrator do grupo acila. Deste modo, a energia de ativação para
sua formação na etapa lenta é maior e a reação mais lenta (ver gráfico).
c) Dê o mecanismo completo e explique a regioespecificidade desta reação.
Mecanismo:
Br-Br +
FeBr3
O
O
δ
O
lenta
Br Br FeBr 3
+ FeBr4
δ
δ
Br H
Br
+ HBr
+ FeBr3
Os complexos sigma – intermediários da etapa lenta –de adição do eletrófilo nas
posições orto e em para são menos estáveis em relação ao da posição meta.
Nas estruturas de ressonância dos intermediários de adição de Br+ em orto e
para a carga positiva fica adjacente ao grupo acila eletron-atrator.
Intermediários da etapa lenta da reação com adição do eletrófilo em orto e para
δ
δ
O
δ
Br
δ
H
δ
H
Br
ORTO
O
δ
PARA
Deste modo a energia de ativação para formação do complexo π em meta é
menor e o produto é formado mais rapidamente.
d) Supondo que reagentes e produtos possuem estabilidade próxima, desenhe um gráfico
de energia vs coordenada de reação comparativo entre as duas reações
Intermediário de A
A = bromação da acetofenona
B = bromação do benzeno
E
Intermediário de B
Ea de B
Ea de A
Coordenada de reação
(1,5)
3) Proponha um mecanismo para a reação de síntese do DDT mostrada abaixo.
2
+ Cl3CCHO
Cl
Cl
Cl
H2SO4
DDT
CCl3
O
+
CL3C
O H
H2SO4
O H
CL3C
H
HSO4-
Cl3C
H
H
Cl
Cl3C
OH
Cl3C
+ H2SO4
OH
H
δ
δ
Cl
Cl3C
HSO4-
δ
Cl δ
Cl3C
OH2
+ HSO4-
+ HSO4
+
Cl
H2O
Cl
Cl
HSO4-
δ
Cl
δ
δ
H
Cl
CCl3
δ
Cl
Cl
CCl 3
(3,0)
4) Proponha uma síntese para cada uma das substâncias abaixo a partir do benzeno.
H2N
NO2
Br
A
B
H2N
Reações que deverão ser utilizadas:
- Nitração e redução a amina
- Acilação de Friedel-Crafts (alquilação daria rearranjo)
- bromação
Br
A
Cuidados: orientação dos grupos, polissubstituição em anéis muito ativados,
regioespecificidade e lembrar que acilação não ocorre em anéis desativados
Possibilidade 1:
NO2
NH3
FeBr3
NH2
H2, Ni
O
Ac2O
Anel muito ativado.
Deve ser "protegido" para
evitar reação com ácidos ou
polissubstituição
H+ ou
ácido de Lewis
ex: FeBr3
desativantes e orientadores meta
NHAc
NH2
HNO3, H2SO4
Br2, CCl4
NHAc
NHAc
C2H5COCl
C2H5
produto
principal
AlCl3
Br
1) Zn(Hg), HCl
2) H3O+
PRODUTO DESEJADO
Br
2
Possibilidade 2
O
O
C2H5COCl
Zn(Hg), HCl Pr
Br2, FeBr3 C H
2 5
AlCl3
Br
Anel desativado,
único produto
Zn(Hg), HCl
Br
E+
Pr
Deve ser difícil de controlar
adição em uma dessas posições
para continuar a síntese
Br
SO3, H2SO4
sulfonação para orientar nitração em para
NO2
NH2
HNO3, H2SO4
H2, Ni
SO3H
SO3H
SO3H
1) H3O+ (retirar ácido)
2) Ac2O
NH3
NHAc
SO3
provavelmente se encontra
nesta forma
produto desejado
Rota mais longa
do que 1
1) Br2, CCl4
Pr
2) H3O+
Apenas uma possibilidade viável:
NO2
B
Br
SO3, H2SO4
FeBr3
deve ser controlada para evitar
polialquilação
1) HNO3, H2SO4
2) H3O
SO3H
+
PRODUTO
(2,8 – 0,4 cada item)
5) Complete as reações abaixo com o(s) produto(s) principais.
N(CH3)2
HO3S
NaNO2/HCl
NH2
H2O, 0oC
A
B
Cl
HO3S
HO3S
N
N
N
NMe2
N
NHCOCH3
NO2
NHCOCH3
HNO3/H2SO4
C
SO3H
SO3H
FeBr3
D
Br
+
NO2
NO2
O
O
HNO3/H2SO4
E
O2N
O
Cl /AlCl3
1)
O
OCH3
F
2) H3O
+
OCH3
Cl
1) Cl2/FeCl3
G
2) H2SO4 fumegante
SO3H