Química Orgânica II – Profa. Rosângela de A. Epifanio
Prova 1 – 04/04/2005
Nome:..............................................................................................................Nota:.............
(1,0)
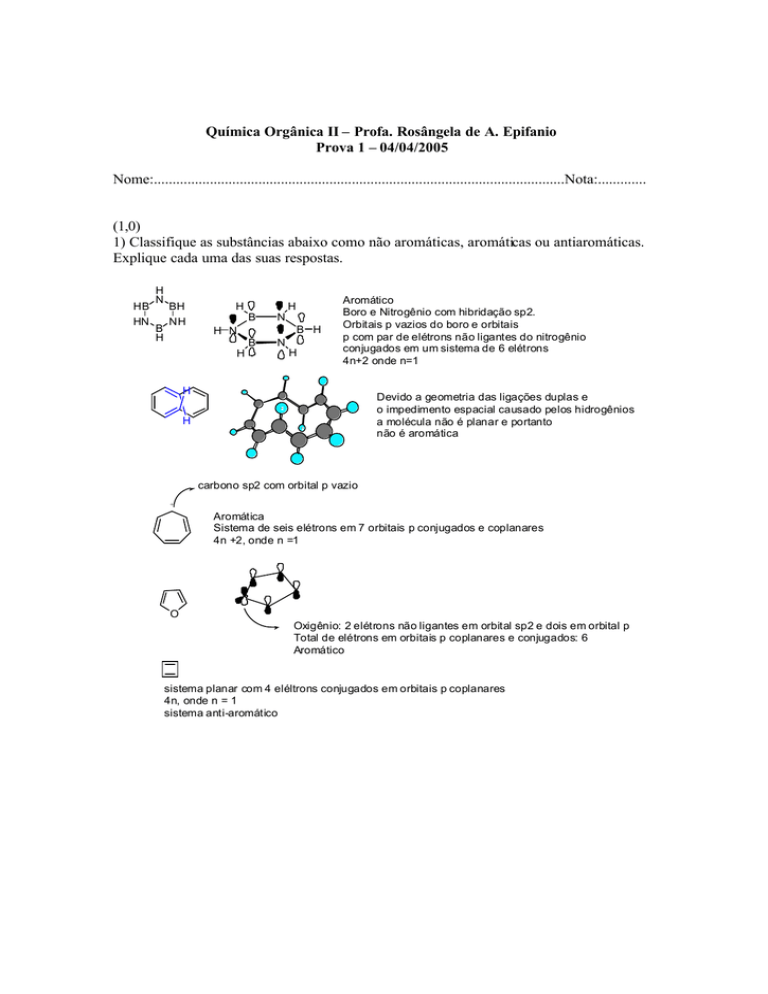
1) Classifique as substâncias abaixo como não aromáticas, aromáticas ou antiaromáticas.
Explique cada uma das suas respostas.
HB
HN
H
N
B
H
BH
NH
H
H
B
N
B
N
B H
H N
H
H
Aromático
Boro e Nitrogênio com hibridação sp2.
Orbitais p vazios do boro e orbitais
p com par de elétrons não ligantes do nitrogênio
conjugados em um sistema de 6 elétrons
4n+2 onde n=1
H
H
H
H
Devido a geometria das ligações duplas e
o impedimento espacial causado pelos hidrogênios
a molécula não é planar e portanto
não é aromática
carbono sp2 com orbital p vazio
+
Aromática
Sistema de seis elétrons em 7 orbitais p conjugados e coplanares
4n +2, onde n =1
O
Oxigênio: 2 elétrons não ligantes em orbital sp2 e dois em orbital p
Total de elétrons em orbitais p coplanares e conjugados: 6
Aromático
sistema planar com 4 eléltrons conjugados em orbitais p coplanares
4n, onde n = 1
sistema anti-aromático
(1,0)
2) Coloque as substâncias abaixo em ordem crescente de reatividade frente à substituição
eletrofílica aromática.
N(CH3)2
A
H
N(CH3)2
+
CH2CH3
NO2
C
B
Br
E
D
D<B<E<C<A
(2,0)
3) A reação de sulfonação do naftaleno pode fornecer diferentes produtos, dependendo da
temperatura utilizada. A 80 o C o produto principal é o ácido 1-naftilsulfônico, enquanto
que a 160 o C forma-se o ácido 2-naftilsulfônico.
Descreva os mecanismos destas reações e explique o porque dos resultados obtidos em
diferentes temperaturas. Desenhe o diagrama de Energia vs Coordenada de Reação
comparando as duas reações.
SO3H
o
80 C
o
160 C
Areação de sulfonação é reversível.
A temperatura mais baixa temos a formação do produto
cinético, cuja energia de ativação para a formação do
intermediário na etapa lenta da reação é menor Produto A
A
SO3H
B
H
Intermediário de B
SO3H
A
Em temperatura mais
elevada ocorre a formação
do produto mais estável –
Produto B que não possui
interação espacial
desfavorável mostrada
acima.
Energia
Intermediário de A
Ea de A
Ea de B
A
B
Coordenada de Reação
Ea = Energia de ativação para
formação do intermediário
HO3S H
HO3S H
H+
+
+ SO 3
+
HO3S H
HO3S H
+
+
SO3H
HSO4
HO3S H
+
-
Intemediário mais
estável
Duas estruturas de
ressonância
aromáticas
Produto A
+
H+
+ SO3
+
SO3H
H
SO3H
H
SO3H
H
+
+
SO3H
Produto B
HSO4
-
SO3H
H
SO3H
H
+
Intemediário menos
estável
Uma estrutura de ressonância
aromática
(3,5)
4) Proponha uma síntese para cada uma das substâncias abaixo a partir do benzeno.
NH 2
Br
A
NO 2
HNO3/H 2SO4
NH 2
Sn, HCl
ou
H 2, Ni
ou
Fe, HCl
ou
Zn(Hg), HCl
NH 2
2 moles CH 3CH2COCl
AlCl3
NHCOCH 2CH 3
HCl, Zn(Hg)
Br2
H2O
O
A
NO 2
B
Br
SO 3H
SO3, H 2SO 4
AlBr 3
SO 3H
produto principal
HNO3
H2SO4
B
H 2O, H 2SO4
HO 3S
NO 2
(2,8 – 0,4 cada item)
5) Complete as reações abaixo com o(s) produto(s) principais.
HO3S
NH2
NaNO2/HCl
HO3S
H2O, 0 oC
N(CH3)2
+
N N
Cl
A
HO3S
N
N
B
NHCOCH3
NO2
NHCOCH3
HNO3/H 2SO4
C
SO3H
SO3H
FeBr3
Br
+
D
1) CH3COCl, AlCl 3
2) H3O+
E
O
O
H 2SO4 fumegante
F
SO3H
OCH3
NO2
Br2, FeBr3
OCH3
NO2
G
Br
produto principal
Br
OCH3
NO2
N(CH3)2