UNIVERSIDADE DE SÃO PAULO
ESCOLA SUPERIOR DE AGRICULTURA “LUIZ DE QUEIROZ”
DEPARTAMENTO DE GENÉTICA
MÉTODOS DE TRANSFORMAÇÃO EM
PLANTAS
Dra. MARIZA MONTEIRO
CONTEÚDO
1- INTRODUÇÃO
2- ISOLAMENTO DO GENE E CONSTRUÇÃO DO CASSETE DE
EXPRESSÃO
3- MÉTODOS DE TRANSFORMAÇÃO
3.1- Agrobacterium
3.2- Biobalística
3.3- Eletroporação
4- CULTURA DE TECIDOS COMO PRÉ-REQUISITO PARA
TRANSFORMAÇÃO
5- CULTIVO DE PLANTAS TRANSGÊNICAS NO MUNDO
6- EXEMPLOS DE PLANTAS TRANSGÊNICAS
7– CONSIDERAÇÕES FINAIS
1- INTRODUÇÃO
MELHORAMENTO DE PLANTAS CULTIVADAS
MÉTODOS MELHORAMENTO
CLÁSSICO
MÉTODOS
BIOTECNOLÓGICOS
TRANSFORMAÇÃO GENÉTICA
Plantas Transgênicas
São plantas que tiveram sua constituição genética
alterada pela introdução de gene(s) de um outro
organismo, em geral de outra espécie.
(Torres et al., 1999)
Importância da técnica de transformação:
Obter plantas com características agronômicas
desejáveis, as quais não são possíveis por polinização.
“Fonte adicional de variabilidade genética
incorporada em um programa de melhoramento”.
para
ser
TÉCNICAS DE ENGENHARIA GENÉTICA
Genes de interesse
isolados e clonados em um vetor
Limitação:
Número limitado de genes isolados
caracteres agronômicos relevantes.
que
regulam
Utilização - Plantas resistentes a herbicidas e patógenos
- Melhor qualidade do produto
- Produção de proteínas animais
- Fitorremediação - detoxificação de metais pesados
- Alteração das vias metabólicas - produtos mais
vantajosos
2- ISOLAMENTO DO GENE
Gene:
Sequência de nucleotídeos que compreende um
segmento de DNA cujo produto é um polipeptídeo.
Unidade básica da herança.
Estrutura do gene:
Promotor
Éxon 1
Íntron 1
Éxon 2
Terminador
Processo de transcrição do DNA
Núcleo
Filamento
não molde
Códon de
finalização da
tradução UGA,
UAA ou UAG
Sítio de
iniciação da
Transcrição
5’
3’
Filamento3’
molde
5’
Transcrição
5’
3’
hnRNA
Cap
5’
3’
AAAAA
Splicing ou processamento
5’
3’ mRNA
AAAAA
Isolamento do gene de interesse por
“Differential display”
Ex. Gene de resistência a uma doença
(bacteriose)
Plantas resistentes
Planta inoculada com
bacteriose
Planta não inoculada com
bacteriose
Extração do mRNA total
Planta inoculada
com bacteriose
Planta não inoculada
com bacteriose
mRNA
Extração do mRNA total da planta inoculada e da planta não
inoculada com a bacteriose
Formação do cDNA
5’
AAAAA
Transcriptase reversa
3’ mRNA
Tratamento com alcali
AAAAA
3’
TTTTTT
Alça
DNA polimerase
Primer oligo (dT)
Isolando o gene
5’
AAAAA
3’ mRNA
Transcriptase reversa
AAAAA
TTTTTT
Alça
DNA polimerase
Primer oligo (dT)
Isolando o gene
5’
AAAAA
3’ mRNA
Transcriptase reversa
AAAAA
TTTTTT
Alça
DNA polimerase
Nuclease S1
(específica unifilamentar)
cDNA bifilamentar
Primer oligo (dT)
Identificação do cDNA correspondente ao gene de interesse
Planta inoculada
com bacteriose
Planta não inoculada
com bacteriose
cDNA
cDNA
Extrai o cDNA
do gel
Isolamento do cDNA correspondente ao gene de resistência a
bacteriose por “Differential Display”
Clonagem do cDNA em um vetor
cDNA
Plasmídeo
Amplificação e identificação do cDNA
Bactéria
Vetor
Introdução do vetor contendo o cDNA em uma bactéria
Construção do Cassete de expressão
Inserção de um promotor e um terminador
Promotor: Região de DNA envolvida na ligação da RNA-polimerase
para iniciar a transcrição
Promotor
Promotores constitutivos:
Dicotiledôneas - 35S – vírus do mosaico da couve-flor
Monocotiledôneas - Adh1 - álcool desidrogenase do milho
- Act1 - actina do arroz
- Ubi1 - ubiquitina do milho
Promotores induzidos - expresso quando submetidos a fatores de
indução
ats1A - subunidade menor da ribose 1,6-bifosfato
carboxilase oxigenase da Arabidopsis thaliana – induzido
pela luz
Terminador: Sequencia de DNA, presente na extremidade do
transcrito, que leva a RNA-polimerase a terminar a transcrição
Promotor
Terminador
Clonando o gene em um vetor
Promotor
Terminador
Plasmídeo
Hind III (11076)
Sph I (11074)
Pst I (11068)
Sal I (11058)
Xba I (11052)
BamH I (11046)
Sma I (11043)
Kpn I (11041)
Sac I (11035)
EcoR I (11025)
lacZ alpha
CaMV 35S promoter
Gus first exon
Nco I (1)
Bgl II (8)
Catalase intron
Gus second exon
Bst XI (10782)
CaMV35S promoter
Nhe I (2014)
Xho I (9995)
Histidine tag
Bst EII (2050)
Nos poly-A
T-Border (right)
hygromycin (R)
pCAMBIA1301
Xho I (8901)
Sph I (2455)
11837 bp
CaMV35S polyA
T-Border (left)
Sac II (8383)
pVS1 sta
kanamycin (R)
pBR322 ori
pBR322 bom
Nhe I (5458)
pVS1 rep
Plasmídeo pCambia 1301
3- MÉTODOS DE TRANSFORMAÇÃO
INDIRETO
Agrobacterium
DIRETOS
Biobalística
Eletroporação - Protoplastos e Tecidos íntegros
3.1- TRANSFORMAÇÃO POR Agrobacterium
Agrobacterium - microorganismos tipicamente de solo
- induzem doenças em tecidos injuriados de
dicotiledôneas
Agrobacterium tumefaciens - galha-da-coroa
Formação de galha-da-coroa por Agrobacterium tumefaciens
(www.biologi.uio.no/plfys/ haa/gen/gmo.html)
Indução do tumor - Plasmídeo Ti
Plasmídeo:
-
DNA
circular,
extracromossômico
de
replicação
autônoma, presente em bactérias.
- Geralmente ligado a patogenicidade ou virulência
plasmideo Ti
Agrobacterium tumefaciens
(www.apsnet.org/.../DNA_easy/Images/agrobacterium.jpg)
Esquema de organização estrutural do plasmídeo Ti
(Sluys, 1999)
Processo biológico da infecção
Interação Planta-Agrobacterium (Sheng e
Citovsky, 1996).
Processo biológico da infecção
Interação Planta-Agrobacterium (Sheng e
Citovsky, 1996).
TRANSFORMAÇÃO POR Agrobacterium
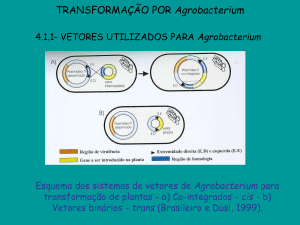
3.1.1- VETORES UTILIZADOS PARA Agrobacterium
Esquema dos sistemas de vetores de Agrobacterium para
transformação de plantas - a) Co-integrados - cis - b)
Vetores binários - trans (Brasileiro e Dusi, 1999).
vetor binario
Hind III (11076)
Sph I (11074)
Pst I (11068)
Sal I (11058)
Xba I (11052)
BamH I (11046)
Sma I (11043)
Kpn I (11041)
Sac I (11035)
EcoR I (11025)
lacZ alpha
CaMV 35S promoter
Gus first exon
Nco I (1)
Bgl II (8)
Catalase intron
Gus second exon
Bst XI (10782)
CaMV35S promoter
Nhe I (2014)
Xho I (9995)
Histidine tag
Bst EII (2050)
Nos poly-A
T-Border (right)
hygromycin (R)
pCAMBIA1301
Xho I (8901)
Sph I (2455)
11837 bp
CaMV35S polyA
T-Border (left)
Sac II (8383)
pVS1 sta
kanamycin (R)
pBR322 ori
pBR322 bom
Nhe I (5458)
pVS1 rep
Agrobacterium tumefaciens
(www.apsnet.org/.../DNA_easy/Images/agrobacterium.jpg)
Hind III (11076)
Sph I (11074)
Pst I (11068)
Sal I (11058)
Xba I (11052)
BamH I (11046)
Sma I (11043)
Kpn I (11041)
Sac I (11035)
EcoR I (11025)
lacZ alpha
CaMV 35S promoter
Gus first exon
Nco I (1)
Bgl II (8)
Catalase intron
Gus second exon
Bst XI (10782)
CaMV35S promoter
Nhe I (2014)
Xho I (9995)
Histidine tag
Bst EII (2050)
Nos poly-A
T-Border (right)
hygromycin (R)
pCAMBIA1301
Xho I (8901)
Sph I (2455)
11837 bp
CaMV35S polyA
T-Border (left)
Sac II (8383)
pVS1 sta
kanamycin (R)
pBR322 ori
pBR322 bom
Nhe I (5458)
pVS1 rep
Mapa de restrição do plasmídeo pCambia 1301
3.1.2- MÉTODOS DE TRANSFORMAÇÃO VIA
Agrobacterium tumefaciens
Co-cultivo
Método de co-cultivo (Brasileiro et al., 1998)
MÉTODOS DIRETOS
3.2 - TRANSFORMAÇÃO POR BIOBALÍSTICA
3.2- TRANSFORMAÇÃO POR BIOBALÍSTICA
- Consiste na aceleração, a velocidade supersônica, de
micropartículas carregando as moléculas de interesse em
direção a um alvo biológico.
Micropartículas - ouro ou tungstênio - 0,4 a 1,5 µm
Partículas de ouro
Partículas de tungstênio
Acelerador de partículas com alta pressão de gás hélio (Biorad).
Esquema de funcionamento.
Vetores - não requerem seqüências especiais
Utilização:
- transformar meristemas e tecidos com alto
potencial de regeneração.
- transformação de organelas e pólens
- transformação de cereais, leguminosas e espécies
arbóreas recalcitrantes a outros métodos.
3.3 - TRANSFORMAÇÃO POR ELETROPORAÇÃO
DE PROTOPLASTOS
protoplastos:
- células desprovidas de sua parede vegetal mediante
tratamento enzimático.
enzimas são capazes de degradar:
- Celulose - Pectina - Hemicelulose
- Outros polissacarídeos que compõem a parede
celular.
Técnica de eletroporação de protoplastos:
-Consiste em submeter os protoplastos e DNA a um campo
elétrico de intensidade controlada
Choque elétrico:
- formação de poros reversíveis na membrana plasmática
permitindo a entrada do DNA
- Fatores importantes
- Duração do pulso
- Voltagem aplicada
Esquema de eletroporação
Cubetas para eletroporação
Eletroporador
Vantagem –
Aumento da freqüência de plantas transformadas
Ex. (Quecini, 1999) - 36% - eficiência de transformação por
eletroporação
- 3,47% - de eficiência de transformação por
biobalística
Desvantagem –
- A regeneração a partir de protoplastos é um processo
longo, podendo induzir variação somaclonal.
4- CULTURA DE TECIDOS COMO PRÉREQUISITO PARA TRANSFORMAÇÃO
- CULTURA DE TECIDOS: É o processo pelo qual pequenos
pedaços de tecido vivo (explantes) são isolados da planta e
crescem assepticamente em meio de cultura nutritivo.
- TOTIPOTÊNCIA CELULAR = toda célula tem a capacidade
de se dividir e regenerar um novo indivíduo (Schleiden e
Schwann, 1938 e 1939), desde que devidamente estimulados.
- Estímulos
- meio nutritivo - sais minerais, vitaminas, fonte de carbono
- condições ambientais - adequadas para o crescimento e
desenvolvimento.
- fitorreguladores
- fitorreguladores
Auxínas
AIA - ácido indol-3-acético
AIB - ácido indol-3-butirico
2,4-D - ácido 2,4-Diclorofenóxiacético
ANA - ácido 1-Naftalenoacético
Citocininas
K - Cinetina
BAP - 6-Benzilaminopurina
ZEA – Zeatina
* Induzem a desdiferenciação e respostas morfogênicas em
tecidos diferenciados
Balanço hormonal
Explantes: discos foliares de tabaco
CONCENTRAÇÃO DE CINETINA (mg/L)
CONCENTRAÇÃO DE AIA (mg/L)
0
0,005
0,03
0,18
1,08
3,0
0
0,02
1,0
(Raven, 1998)
- Protocolos eficientes de regeneração de plantas
Aumenta e eficiência de plantas transformadas
Agrobacterium – Regeneração na extremidade do explante
Biobalística - Regeneração na superfície do explante
- Acompanhamento histológico da formação dos
meristemóides
Eletroporação de protoplastos
- Protocolo eficiente de isolamento, cultura e
regeneração de plantas
5- Cultivo de plantas transgênicas no mundo
Area Global de Plantas Transgênicas Cultivadas em 2008:
por Paises (Milhões de Hectares)
6- Exemplos de plantas transgênicas
Flavr savr Tradicional
Tomate Longa Vida
Etileno
http//www.zoo.utoronto.ca
Síntese do gene
poligalacturonase (pg)
Síntese do gene e do antisense
Transcrição
Transcrição
Tradução
Enzima
Enzima não produzida
http//www.zoo.utoronto.ca
Batata resistente a larva de Lacanobia oleracea
(mariposa do tomate)
Transgênico Controle
http//www.europe.eu.int
Mamão resistente ao PRSV (Vírus da mancha anelar do
mamão)
Transgênico
Controle
http//www.apsnet.org
Arroz Dourado apresentando betacaroteno
http//www.news.bbc.uk
Esquema do processo de transformação do Arroz Dourado
apresentando betacaroteno
http//www.news.bbc.uk
Soja resistente ao herbicida imazapyr
Detalhe de linhas transgênicas (direita) e não-transgênicas
(esquerda) após a aplicação do herdicida
(Abud,S. et al., 2003)
Alimentos Transgênicos
7- CONSIDERAÇÕES FINAIS
-A técnica de transformação nos permite:
- a obtenção de inúmeras espécies vegetais, com diferentes
características:
- resistência ou tolerância a estresse biótico e
abiótico
- melhor capacidade nutricional ou capaz de
produzir fármacos (biorreatores).
- estudos básicos nas áreas de Genética,
Fisiologia, Biologia Celular e Biologia Molecular.
-Superar as barreiras reprodutiva
-Transferir apenas genes de interesse
-Desafios a serem superados:
- Adequação dos processos de cultivo in vitro para
várias espécies recalcitrantes.
- Compreensão das funções da grande maioria de genes.
-
Manipulação
governadas
por
de
características
vários
genes
estão associados a produtividade.
e
complexas
que
que
são
freqüentemente