Doença infecto-contagiosa, mais comum do Sistema Nervoso
Central, causadas por bactérias, fungos e vírus.
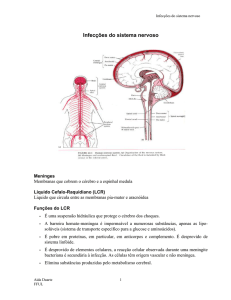
Inflamação das meninges – membranas que recobrem e
protegem o sistema nervoso central (cérebro e coluna
vertebral), podendo ser causada por diversos agentes
infecciosos, tais como, vírus, bactérias e fungos
Os principais patógenos responsáveis pela meningite
bacteriana são:
• Haemophilus influenzae
• Neisseria meningitidis
•Streptococcus pneumoniae
DIAGNÓSTICO LABORATORIAL
•Exame físico:
Cor
Aspecto
•Exame Citológico:
Contagem global de Leucocitos
Contagem Diferencial → citomorfológico
•Exame Bioquímico:
Glicose
proteínas
cloretos
•Exame Bacterioscópico:
Gram → bacterias
Ziehl→ BAAR
Tinta da China: Cryptococcus
•Cultura
Aeróbios
BK
Fungos
•Hemocultura
•Látex
•Reação em Cadeia pela Polimerase
(PCR).
Observação:
O diagnóstico precoce e confiável contribui para o tratamento
eficaz e ação efetiva da Vigilância Epidemiológica.
Casos suspeitos por meningite tuberculosa ou fúngica
realizar coloração por método de Ziehl Neelsen e Tinta da
China.
KIT MENINGITE
•01 tubo de Ágar chocolate
•01 frasco de 30 ml de caldo de TSB para Hemocultura.
•02 lâminas (26X76) para exame bacterioscópico.
•01 frascos estéril para exame quimiocitológico.
•02 frascos estéreis para Látex e PCR
•01 tubo de Ágar Lowenstein Jensen - tuberculose
(verde)
•01 tubo de Ágar Sabouraud - fungos (transparente).
A IMPORTÂNCIA DA COLETA
Evitar resultados falsos positivos (contaminação) e falsos
negativos (tempo oportuno)
LCR e Sangue preferencialmente antes da antibioticoterapia
Além da coleta adequada, o envio da amostra ao
Laboratório deve ser feita em tempo hábil e em
condições satisfatórias, para que não haja
alteração durante o transporte.
IDENTIFICAÇÃO
Toda amostra deve ser rigorosamente identificada e
acompanhada por uma Ficha de encaminhamento
de amostra, preenchida com os seguintes dados:
•Nome completo e legível do paciente
•Idade / sexo
•Tipo de exame solicitado
•Data de coleta da amostra
•Procedência / Município
•Material encaminhado
•Diagnóstico presuntivo
PADRÃO OURO
•Retificar ou Confirmar o exame bacterioscópico do LCR Exame de alto grau de especificidade.
•Identificação do microorganismo
•Teste de Sensibilidade – Monitoramento das resistências
microbianas
•Importância Epidemiológica – controle da doença e de
surtos
•Quimioprofilaxia ( Haemophylus e Neisseria )
BACTERIOSCOPIA (Gram)
Vantagens:
• Rápido/baixo custo
• Visualização da bactéria (até 80%)
• Auxilia na conduta terapêutica
• Quimioprofilaxia (DGN)
• Diagnóstico presuntivo
• Bacterioscopia + diagnóstico clínico:
Confirmação do caso (DGN)
Diplococo GRAM negativo
Pesquisa de BAAR
•Verificada a presença de fibrina no líquor.
•Fazer esfregaço utilizando a fibrina e
o sedimento para pesquisa de BAAR.
•Secar, corar pelo método de ZiehlNielsen.
HEMOCULTURA
Diagnóstico e Isolamento bacteriano
nos casos de Meningococcemia.
IMPORTANTE:
Encaminhar em Temperatura ambiente
LÁTEX
Técnica de aglutinação rápida, para detecção de
antígenos solúveis em fluidos biológicos (LCR,
urina e soro) permite um rápido diagnóstico para:
Neisseria meningitidis soro grupo A; B/E. coli C/w135, Y
Haemophylus influenzae b
Streptococcus pneumoniae
Streptococcus grupo B (S. agalactiae)
Baixa sensibilidade suficiente para detecção dos
agentes em baixa concentração
Reação em Cadeia pela Polimerase (PCR).
•Amplificação “in vitro” de fragmentos de DNA,
que permite a identificação do agente utilizando
primers específicos de regiões conservadas e
variáveis do agente.
•Sensibilidade e especificidade de 100%.
ACONDICIONAMENTO
Tubos de Meio de cultura
• Acondicionar as amostras em sacos plásticos. Não colocá-las soltas na caixa
de isopor.
•Fechar bem os frascos para evitar vazamentos.
•Laminas: Temperatura ambiente
•Hemocultura
Manual: Estufa bacteriologica 35ºC ± 1ºC
Automatizada: Temperatura ambiente
Meios de Cultura:
Agar Chocolate: Estufa bacteriologica 35ºC ± 1ºC
Agar Sabouraund: Temperatura ambiente
Agar Lowentein Jensen: Estufa bacteriologica 35ºC ± 1ºC
Soro e LCR: Temperatura 2ºC a 8ºC
TRANSPORTE
Acondicionar em caixa que suporte
manipulações bruscas ou impactos (ex. caixa
de isopor)
Após lacrar a caixa
deve-se colocar o
remetente e o
destinatário, além do
símbolo de RISCO
BIOLÓGICO.
INSTRUÇÕES PARA O TRANSPORTE
• Meios de cultura - Colocar em isopor, sem gelo
os tubos hermeticamente fechados e protegidos
para evitar acidentes.
• Lâminas - Encaminhar a lâmina analisada,
junto com a outra lâmina apenas fixada. Proteger
com gaze ou papel higiênico.
• LCR e soro – Enviar juntamente com os meios
de cultura.
IMPORTANTE: Encaminhar em temperatura Ambiente
INSTRUÇÕES PARA O TRANSPORTE
•As fichas de encaminhamento, bem como
requisições e relatórios, devem ser colocados
em sacos plásticos.
NOME COMPLETO DO PACIENTE_______________________________________
DATA DE NASCIMENTO________________________________________________
MUNICÍPIO DE RESIDÊNCIA____________________________________________
DATA DA COLETA_____________________________________________________
PROCEDÊNCIA (HOSPITAL / DIRES)_____________________________________
AMOSTRA ENVIADA:
AGAR CHOCOLATE
HEMOCULTURA
LÂMINAS
LÁTEX (LIQUOR)
LÁTEX (SORO)
AGAR SABOURAUD
LOWENSTEIN – JENSEN
RESULTADO DO BACTEROSCÓPICO NO HOSPITAL______________________
PROFISSIONAL RESPONSÁVEL_________________________________________
OBS.: REPRODUZIR ESTA FICHA E GUARDAR NO LABORATÓRIO ONDE
TODOS TENHAM ACESSO
DESCARTE DO MATERIAL UTILIZADO
Todo o material descartável,
utilizado na coleta, deverá ser
acondicionado em saco plástico,
vedado
com
fita
crepe
e
identificado como
RESÍDUO
INFECTANTE.
1º FLUXO DAS AMOSTRAS
PUNÇÃO DO LCR E SANGUE NO HOSPITAL
LABORATÓRIO DO HOSPITAL
SEMEAR O LCR E INOCULAR O SANGUE
NOS MEIOS DE CULTURA DO KIT
REALIZAR
BACTERIOSCOPIA
LACEN/BA
REALIZAR LÁTEX
IDENTIFICAR E SOROGRUPAR CEPA,
CONTROLE DE QUALIDADE DAS LÂMINAS,
TESTE DE SENSIBILIDADE
IAL/SP
2º FLUXO DAS AMOSTRAS
PUNÇÃO DO LCR E SANGUE NO HOSPITAL
LABORATÓRIO LOCAL
LMRR/BA
SEMEAR O LCR E SANGUE
NOS MEIOS DE CULTURA
Tubos de LJ e Agar
Sabouraud semeados
IDENTIFICAR
CEPA
REALIZAR
BACTERIOSCOPIA
REALIZAR LÁTEX
LACEN/BA
Controle de qualidade,
Teste de sensibilidade,
Sorogrupo
IAL/SP
Alteração do LCR nas Meningites
Etiologia Leucócitos/mm3
Tipo
Glicose
Proteínas
Bacteriana
>200
Neutrófilos
<40
>100
Viral
<500
Linfócitos
Normal
<100
Fúngica
<100
Linfócitos
Normal
Tuberculose
<500
Linfócitos
<50
>100
45-100
15-50
LCR Normal
0-5
-
N ou >100
Alteração do LCR nas Meningites
Etiologia
Bacteriana
Viral
Fúngica
Cor
Branco leitoso ou
ligeiramente xantocrômico
Incolor opalescente
Incolor
Aspecto
turvo
límpido
límpido
Tuberculose
Incolor ou
xantocrômico
límpido ou
ligeiramente turvo
LCR Normal
Incolor
límpido
Contatos
Atendimento/Resultados (Rosa Veloso): [email protected]
CIE (Maria de Lourdes): [email protected]
CLAVEP (Cristiane Mota): [email protected]
Bacteriologia (Neide Oliveira): [email protected]
Neide Oliveira Silva/ Marcia Ungar Sá
Bacteriologia/LACEN/BA
(71) 3316-5037