Instituto Superior Técnico Mestrado Integrado em Engenharia Biomédica 2ªano, 2º semestre de 2008/09 Química Orgânica Relatório 2 Separação e Purificação de Compostos Orgânicos Trabalho realizado por: Joana Santos nº62828 Cláudia Carriço nº63947 Grupo 4, Turma B 3ª Feira
Trabalho 2 – Separação e Purificação de Compostos Orgânicos 1. Resumo Neste trabalho, fez‐se a separação e purificação de uma mistura composta por p‐
toluidina, ácido benzóico e naftaleno, recorrendo às suas propriedades ácido base. A p‐toluidina, o ácido benzóico e o naftaleno foram obtidos com um rendimento de respectivamente 2.2%, 36.3%, 34.3%, sendo a pureza dos produtos avaliada por medição dos respectivos ponto de fusão, (respectivamente 51.8⁰C; 126.4⁰C; 81.9⁰C) e comparação com os valores tabelados (45⁰C; 121⁰C; 80⁰C). Concluiu‐se que o rendimento da separação não foi muito eficiente e que os produtos obtidos se encontravam contaminados com os reagentes de partida. 2. Introdução Os compostos orgânicos podem ter propriedades ácidas ou básicas, dependendo da sua estrutura, sendo a partir destas propriedades, passíveis de serem separados. A mistura a separar consiste numa solução, em clorofórmio, de três compostos aromáticos diferentes: uma amina, a p‐toluidina; um ácido carboxílico, o ácido benzóico e um hidrocarboneto, o naftaleno. Trata‐se assim de uma mistura de quatro componentes: o solvente e os três solutos. Assim, tratando a solução inicial com uma solução aquosa básica, no caso NaOH, dá‐se a reacção da base com o ácido benzóico, obtendo‐se deste modo duas fases facilmente separáveis: o benzoato de sódio e uma fase orgânica contendo os restantes componentes dissolvidos em clorofórmio. Tratando agora esta fase orgânica com uma solução de HCl (ácida), dá‐se a reacção do ácido com a base p‐toluidina, obtendo‐se o cloreto de p‐toluidina. Sobra então a fase orgânica, que contém apenas o naftaleno dissolvido em clorofórmio. Para este não se vai fazer nenhuma reacção ácido‐base, visto que o naftaleno não tem propriedades ácido‐base. Os mecanismos de reacção de extracção e purificação correspondentes encontram‐se nas equações (1) a (4). 1 Extracção do ácido benzóico por adição de uma solução de hidróxido de sódio (1) (aq) + NaOH(s) (aq) + H2O(l) (Ácido Benzóico + Hidróxido de Sódio Benzoato de Sódio + Água) 1
Correspondente à 2a questão adicional Química Orgânica 2ºano 2ºsemestre 08/09 2 Trabalho 2 – Separação e Purificação de Compostos Orgânicos Precipitação do ácido benzóico por adição de uma solução de ácido clorídrico (2) (aq) + HCl(aq) (s) + NaCl(aq) (Benzoato de Sódio + Ácido Clorídrico Ácido benzóico + Cloreto de Sódio) Extracção da p‐toluidina por adição de uma solução de ácido clorídrico (3) + HCl(aq) CH3C6H4NH3Cl (aq) Precipitação da p‐toluidina por adição de uma solução de hidróxido de sódio (4)
CH3C6H4NH3Cl (aq) + NaOH(aq)
NaCl (aq) + H2O(l) + 3. Parte Experimental 3.1 Aparelhagem As medidas dos pontos de fusão dos produtos foram efectuadas com uma precisão de 0.1oC, usando um medidos de pontos de fusão Stuart Scientific – Melting Point Apparatus SMP2 . 3.2 Reagentes Usaram‐se como reagentes uma mistura previamente preparada contendo p‐
toluidina, ácido benzóico e naftaleno em clorofórmio; solução aquosa de NaOH, 3M; e solução aquosa de HCl, 3M.[1] 3.3 Método Experimental A separação e purificação dos compostos foi realizada de acordo com o Protocolo das Aulas Laboratoriais de Química Orgânica[1]. Química Orgânica 2ºano 2ºsemestre 08/09 3 Trabalho 2 – Separação e Purificação de Compostos Orgânicos Adicionalmente, na sessão 2, foram ainda medidos os pontos de fusão da p‐
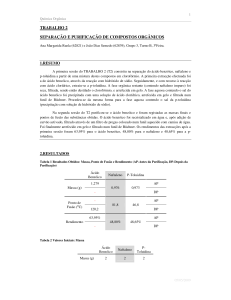
toluidina e do naftaleno. O ponto de fusão do ácido benzóico foi medido posteriormente, dado que na 2a sessão se procedeu à sua recristalização. 4. Resultados Na mistura utilizada, estavam presentes cerca de 2g de cada um dos compostos orgânicos. A massa obtida de cada um dos compostos encontra‐se na tabela 1. Tabela 1: Quantidades dos compostos obtidos Compostos Massa Ácido Benzóico 0.726 g P‐Toluidina 0.044 g Naftaleno 0.686 g É de realçar que a determinação das massas dos compostos não foi directa – mediu‐se a massa dos recipientes sem o produto e com o produto e tomou‐se a diferença. 4.1 Rendimento do processo Dado que a mistura inicial tinha 2g de cada um dos compostos e se considerarmos que a massa obtida para cada composto já não contém de todo impurezas, o rendimento pode ser calculado da seguinte forma: %
. 100 (5) Obtiveram‐se assim os seguintes rendimentos: á
. 100
.
.
ó
.
. 100
. 100
36.3% 2.2% 34.3% Química Orgânica 2ºano 2ºsemestre 08/09 4 Trabalho 2 – Separação e Purificação de Compostos Orgânicos 4.2 Ponto de fusão Os pontos de fusão da p‐toluidina e do naftaleno determinados na segunda sessão foram respectivamente 51.8 oC e 81.9 oC. Já o ponto de fusão do ácido benzóico, determinado posteriormente, foi de 126.4 oC. Os valores obtidos ao fim das duas sessões, encontram‐se sintetizados na tabela 2. Tabela 2 : Valores obtidos no trabalho Produto Ácido Benzóico P‐Toluidina Naftaleno Descrição Valor Valor Tabelado Massa 0.726 g ‐ Rendimento 36.3% ‐ Ponto de Fusão 126.4 oC 121 oC [2] Massa 0.044 g ‐ Rendimento 2.2% ‐ Ponto de Fusão 51.8 oC 45 oC [2] Massa 0.686 g ‐ Rendimento 34.3% ‐ Ponto de Fusão 81.9 oC 80oC [2] 5. Discussão de Resultados e Conclusão Neste trabalho procedeu‐se à separação de compostos orgânicos, tendo sido calculado o rendimento das referidas separações, bem como o ponto de fusão dos composto. Quanto ao rendimento das separações, este foi de 36.3% para o ácido benzóico, 2.2% para a p‐toluidina e de 34.3% para o naftaleno. Estes resultados sugerem‐nos que o processo foi algo ineficiente, especialmente no caso da p‐toluidina. Uma das causas deste rendimento, é o facto de ao longo da actividade experimental terem‐se perdido produtos intermédios – é, por exemplo, o caso das extracções líquido‐
líquido, em que, por precaução, ficava na ampola um pouco da fase orgânica. Outro problema poderá ter sido a etapa de recristalização. De facto, existem perdas inevitáveis associadas a esta técnica. Poderá haver algum produto no estado sólido na mistura Química Orgânica 2ºano 2ºsemestre 08/09 5 Trabalho 2 – Separação e Purificação de Compostos Orgânicos quente – especialmente se esta já tiver arrefecido um pouco quando é transferida para o funil – e, na mistura fria, algum produto dissolvido que dificilmente precipita. Por fim, refiram‐se ainda as inexoráveis perdas que ocorrem quando resíduos dos compostos ficam retidos nos recipientes. Esta dificuldade fez‐se sentir especialmente no caso da p‐toluidina, já que, como esta foi posta a secar durante duas semanas, tendo ficado mais agarrada ao recipiente. Quanto aos pontos de fusão, os valores determinados para o ácido benzóico, p‐
toluidina e naftaleno foram respectivamente 126.4 oC, 51.8 oC e 81.9 oC. A temperatura de fusão de uma substância pura, a uma determinada pressão, é um valor característico dessa substância, pelo que constitui um método de avaliação do seu grau de pureza. Como os valores encontrados na literatura para os pontos de fusão das substâncias no estado puro são de 121 oC, 45 oC, 80 oC(vid. Tabela 2), concluímos que as nossas amostras continham ainda uma quantidade considerável de impurezas. Para além da impureza, outras causas que podem justificar a variação dos pontos de fusão são a possível descalibração do aparelho de medida do ponto de fusão e do termómetro, a quantidade de amostra utilizada na medição, bem como o aquecimento muito rápido que faz com que a temperatura no interior do aparelho suba mais rapidamente que o indicado no termómetro[2]. Deve salientar‐se ainda o facto de ter havido muita dificuldade em conseguir ler os valores de temperatura de fusão. No entanto, este ponto não deverá, em si, ser suficiente para explicar a variação de valores apresentada – não invalidando, portanto, a inferência feita para a existência de impurezas. Para confirmar esta hipótese e obter mais dados sobre a pureza, seria necessário recorrer a outros métodos como a cromatografia ou traçar espectros de IV e 1‐HNMR. Além disso, para uma medição mais correcta do ponto de fusão, deveriam ter sido feitos pelo menos, mais dois ensaios. 6. Bibliografia [1] Simão D et al., 2ºsemestre 2009, Química Orgânica Laboratórios, IST Departamento de Engenharia Química e Biológica [2] A. I. Vogel, 1989, Vogel’s Textbook of Pratical Organic Chemistry, 5th Edition, Longman Scientific and Technical Química Orgânica 2ºano 2ºsemestre 08/09 6