Química
Elementar Orgânica
Material
Didático
Equipe de Química:
(PCNA Fevereiro de 2015)
Shirley Cristina Cabral Nascimento
(Coordenação)
Marlice Cruz Martelli
Ana Rosa C. L. M. Duarte
Marcos Vinícios de Souza Pinto
Monitores:
Fevereiro de 2015
Universidade Federal do Pará
Gustavo Henrique de Souza Chaves
Lucas de Souza Silva
Raylime Louise Tavares Costa
Tárique Samir Bezerra Sena
Nian Iury Ferrão Queiroz
Equipe de Professores
Alexandre Guimarães Rodrigues
(Coordenação Geral)
Matemática:
Rosana Soares (Coordenação)
Alessandra M. de Souza Lopes
Química:
Shirley Cristina Cabral Nascimento
(Coordenação)
Marlice Cruz Martelli
Ana Rosa C.L.M. Duarte
Marcos Vinícius de Souza Pinto
Física:
Alexandre Guimarães Rodrigues
(Coordenação)
José Benício da Cruz Costa
Alexandre Guimarães Rodrigues
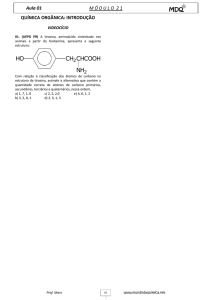
carbono terciário e o carbono 2 é um carbono
quaternário.
ORGÂNICA
1. O ÁTOMO DE CARBONO
O carbono é o elemento químico presente em
qualquer composto orgânico, possui 6 elétrons, e
devido a isso, é conhecido pela sua capacidade de
compartilhar elétrons. Por sofrer hibridação sp, sp2
sp3, estes elétrons efetuam ligações covalentes, cada
ligação é formada por um par de elétrons, um do
átomo de carbono e outro do elemento a ser ligado, é
dessa forma que o átomo de carbono completa o
octeto. Cada par de elétron formará um orbital
molecular que será composto por ligações sigma,
quando existir ligação simples ou PI, quando
existirem dupla ou tripla ligação.
Fig1: etano, dupla ligação
simples ligações
3. CADEIAS CARBÔNICAS
Quanto ao fechamento da cadeia:
Quando o encadeamento dos átomos não
sofre nenhum fechamento, denomina-se a
cadeia como aberta ou acíclica.
Quando há fechamento na cadeia, formandose um ciclo, núcleo ou anel, denomina-se a
cadeia como fechada ou cíclica.
As cadeias aromáticas sofrem ressonância,
rotacionando as ligações PI no anel
aromático.
Fig2: metano,
2. CLASSIFICAÇÃO DO CARBONO:
Carbono primário: Se o átomo de carbono
estiver ligado a um átomo de carbono.
Carbono secundário: se um átomo de
carbono estiver ligado a dois átomos de
carbono.
Carbono terciário: se estiver ligado a três
átomos de carbono.
Carbono quaternário: se estiver ligado a
quatro átomos de carbono.
Ex.:
Quanto à disposição dos átomos:
Onde os carbonos: 1,6,7, 8 e 9 são carbonos
primários, 5 e 3 são carbonos secundários, 4 é um
Quando os átomos se dispõem linearmente,
aparecendo apenas carbonos primários e
secundários, diz-se que a cadeia é normal.
Quando aparecem carbonos terciários ou
quaternários, haverá ramificações, então a
cadeia é considerada uma cadeia ramificada.
Quando na cadeia, alem dos átomos de
carbono, existem outros átomos posicionados
entre carbonos, denomina-se a cadeia como
heterogênea.
1. GRUPOS FUNCIONAIS
Quanto aos tipos de ligação.
Quando só existem ligações simples (sigma)
entre os átomos de carbono, denomina-se a
cadeia como saturada.
Quando ale das ligações simples aparecem
ligações duplas ou triplas, denomina-se a
cadeia como insaturada
.
Quanto à natureza dos átomos.
Quando na cadeia só existem átomos de
carbono, denomina-se a cadeia como
homogênea.
Os hidrocarbonetos são apolares, bastante
insolúveis em água e não muito reativos à
temperatura ambiente. Os insaturados apresentam
maior reatividade do que os saturados, mas sob
muitos aspectos todos são um tanto inertes. A
substituição por outros elementos, tais como o
oxigênio e o nitrogênio (heteroátomos), nas suas
ligações químicas ocasiona alterações importantes na
reatividade química e propriedades físicas desses
compostos. Essas alterações são causadas pela
presença de pares isolados e pela polaridade das
ligações que o oxigênio, o nitrogênio e os não metais
formam com o carbono e com o hidrogênio. Tais
alterações, bastante pronunciadas, podem ser
explicadas quando consideramos os não metais como
sendo parte de um grupo funcional.
GRUPO ALQUILA
São provenientes dos alcanos. Existem para
facilitar a nomenclatura dos compostos. São grupos
que seriam obtidos pela remoção de um átomo de
hidrogênio de um alcano, tabela a seguir.
Frequentemente é utilizado um símbolo (R) que
representa qualquer grupo alquila em um composto
orgânico. Assim a fórmula geral para um alcano é RH.
ÉTERES (R-O-R’)
A ligação característica de um éter é um grupo -Oque conecta dois radicais de hidrocarboneto na
formula geral R-O-R’.
ÁLCOOIS (R-OH)
Na química orgânica, o grupo -OH é conhecido como
grupo hidroxila, e quando ligado a um átomo de C
forma um álcool. Os nomes IUPAC para os álcoois
são semelhantes àqueles dos hidrocarbonetos
principais, com designação ol no final para indicar que
é um álcool.
Exemplo:
CH3OH
CH3 CH2OH
Etanol
Metanol
CH3OCH2CH3
Metoxietano
Uma vez que nos éteres falta o hidrogênio dos álcoois,
eles são muito menos reativos. Porém, apresentam
pares isolados do mesmo modo os álcoois; sendo,
portanto, bases de Lewis e podem aceitar prótons (H +)
de ácidos fortes. Os éteres não podem ser facilmente
oxidados, são menos solúveis em água do que os
álcoois.
CH3 CH2 CH2OH
Propanol
ALDEÍDOS (RCLASSIFICAÇÃO DE ÁLCOOIS:
Os álcoois podem ser classificados segundo alguns
critérios:
1 – número de hidroxilas:
- Monoálcool ou monol: possui uma hidroxila.
- Diálcool ou diol: possui duas hidroxilas.
- Triálcool ou triol: possui três hidroxilas. E assim por
diante.
2 – Posição da hidroxila:
- Álcool primário: hidroxila ligada a carbono primário.
- Álcool secundário: hidroxila ligada a carbono
secundário.
- Álcool terciário: hidroxila ligada a carbono terciário.
-H)
O grupo carbonila, C = O, é muito importante para a
química orgânica. O carbono é híbrido sp2 com uma
ligação, e a ligação C = O é bastante polar. Isto
provoca um forte efeito sobre a reatividade dos átomos
ligados a esse grupo. Como os álcoois, os aldeídos
correspondentes são solúveis em água. Os aldeídos
podem ser facilomente oxidados a ponto de atuarem
como agente redutores. Na verdade, eles são os
produtos de oxidação dos álcoois que contém um
grupo –CH2OH.
Ramificação:
- A cadeia principal é a maior sequência de carbonos
que possui o carbono com o grupo – CHO.
- A numeração começa por esse grupo de forma que
os radicais fiquem com os menores números.
Exemplo:
FENÓIS (Ar – OH)
São compostos orgânicos que possuem a hidroxila
(OH) ligada diretamente ao anel aromático.
Etanal
Fórmula geral: Ar – OH.
CETONAS (RRamificação:
- A numeração começa pela hidroxila no sentido em
que os radicais fiquem com os menores números.
Exemplo:
Hidróxi-Benzeno
-R’)
A ausência do hidrogênio ligado ao grupo carbonila
reduz a reatividade das cetonas, quando comparadas
à dos aldeídos. Os isômeros enólicos ainda existem,
mas as cetonas são suficientemente inertes para
serem frequentemente utilizadas como solventes. No
sistema IUPAC o sufixo ONA é adicionado ao nome do
hidrocarboneto principal para designar uma cetona.
Ramificação: Semelhante a nomenclatura de aldeídos,
substituindo o grupo – CHO pelo grupo – CO - .
Exemplo:
H3 C - - - CH3
ÁCIDO CARBOXÍLICO (R-
AMIDAS
São compostos orgânicos quaternários oxi nitrogenados (C, H, N e O) que possuem como grupo
funcional carboamida.
-OH)
O grupo funcional é conhecido como grupo carboxila
e geralmente é representado por –COOH. Este grupo
forma a base dos ácidos orgânicos, ativando o grupo –
OH de modo que ele apresente propriedades ácidas.
Os álcoois são ácidos muito fracos, mas no grupo –
COOH o O-H tem uma constante de dissociação ácida
que pode ser facilmente determinada. Parte de seu
caráter ácido deve-se a estabilização da base
conjugada, por causa da equivalência dos oxigênios.
Exemplo:
H3 C CH2
CH2
C
O
NH2
Exemplo:
Ácido metanoico
COOH
5. NOMENCLATURA DOS COMPOSTOS
ORGÂNICOS
ÉSTERES (R- -O-R’)
Os ésteres costumam apresentar um odor agradável
de fruta. Podem ser formados a partir de reações de
ácidos (R-COOH) com álcoois (R’-OH), e seus nomes
indicam essa origem simples. Nos nomes IUPAC
acrescenta-se il ao nome básico do álcool,
combinando-o com o sufixo ato ou oato adicionado à
parte ácida.
De forma geral, os nomes oficiais para compostos
orgânicos são formados a partir das seguintes regras
básicas:
1ª) Escolha a cadeia principal.
Esta deve apresentar as seguintes características:
Exemplo:
Possui o grupo funcional;
Consta daquela com o maior número possível
de insaturações;
CH3-
- OCH2CH2CH3
Etanoato de 1- propila
AMINAS
Se considerarmos os álcoois e os éteres como
resultado da substituição dos átomos de H da H2O
por radicais orgânicos, então as aminas resultam de
substituições semelhantes na amônia. Se um
hidrogênio for substituído por um radical, teremos
uma amina primária (RNH2). Se forem substituídos
por dois hidrogênios, teremos uma amina
secundária (RR’NH), enquanto que uma amina
terciária (RR’R’’N) apresenta todos os hidrogênios
substituídos.
Possui a sequência mais longa de átomos de
carbono ligados entre si.
Observações:
Caso a cadeia principal ofereça mais de uma
possibilidade de escolha, deve-se optar por aquela
que fornecer o maior número de ramificações.
Quando a cadeia é mista devemos considerar como
cadeia principal a cadeia fechada (alicíclica) ou a
parte aromática.
Exemplo:
2ª) Deve-se enumerar a cadeia principal.
CH3NH2
Metilamina
A localização das ramificações deve ser informada
pela numeração.
A numeração da cadeia principal deve seguir a
seguinte sequencia:
Grupo funcional > Insaturação > Ramificação
Obedecendo este critério a numeração da cadeia
principal deve seguir a regra dos menores números
possíveis.
Se a cadeia carbônica apresentar duas ou
mais ramificações iguais, devem-se usar os prefixos
indicadores de quantidade di, tri, tetra, penta etc.
mais
Eletronegatividade: Quando átomos com
diferentes eletronegatividades se unem por ligação
covalente, os elétrons são efetivamente mais atraídos
pelo mais eletronegativo deles. Isso dá origem a um
dipolo, ou seja dois polos: um positivo e outro
negativo. Um dipolo é representado pelo vetor
momento dipolo ( )
Geometria
Molecular:
Dependendo
da
geometria molecular, o vetor momento de dipolo
resultante pode ser nulo ou não. Quando ele é nulo
( = 0), a molécula é apolar; caso contrário (
ela é polar.
≠ 0),
Exemplos:
Se a cadeia carbônica apresentar duas ou
ramificações
diferentes,
elas
devem
ser
indicadas em ordem alfabética.
3ª) Nomear o composto de acordo com a estrutura
abaixo:
Prefixo + Infixo + Sufixo
Onde,
Prefixo - que indica o número de átomos de carbono
da cadeia principal;
Infixo - que indica o tipo de ligação principal na cadeia
principal;
Sufixo - que indica a função principal do composto
orgânico.
Em geral as moléculas orgânicas apresentam
polaridade praticamente nula, ou seja, são apolares.
Lembrando que a solubilidade é influenciada pela
polaridade:
“Soluto polar tende a dissolver bem em solvente
polar”.
“Soluto apolar tende a dissolver bem em solvente
apolar”.
Observe o seguinte exemplo, onde misturamos água,
que é uma substância polar, iodo (I2) e ciclo-hexano,
ambos apolares.
'
6. PROPRIEDADES ORGÂNICAS
1.1. Solubilidade
Polaridade
Como vimos anteriormente, para uma molécula ser
polar ou apolar, devemos considerar 2 fatores:
eletronegatividade e geometria molecular.
Tamanho da Cadeia
Observe os dados mostrados na tabela abaixo:
Nota-se que a solubilidade diminui com o aumento da
cadeia. Generalizando, podemos dizer que a cadeia
carbônica de uma molécula, formada por carbono
e hidrogênio, não possui afinidade pela água, pois
é a parte apolar da molécula. Quanto maior for essa
parte apolar, menor a tendência de uma substância
dissolver-se em água. Grupos polares, como – OH –
NH2 e –COOH, possuem afinidade com a água. Sua
presença contribui para que o composto se solubilize
em água.
Massa molecular
Observe as tabelas seguir:
Partes apolares → Grupos Hidrófobos
Partes polares → Grupos Hidrófilos
Note que quanto maior a massa molecular de
alcano não ramificado, maior seu ponto de
ebulição. O gráfico a seguir representa este
comportamento:
1.2. Ponto de ebulição
As forças intermoleculares interferem diretamente no
ponto de ebulição dos compostos orgânicos. Como
visto em ligações químicas, os compostos polares que
realizam pontes de hidrogênio possuem o maior
ponto de ebulição que os compostos polares que
possuem interação dipolo-dipolo. A interação entre
moléculas apolares dipolo-induzido, possuem os
menores pontos de ebulição.
As tabelas abaixo ilustram o efeito do tipo de força
molecular sobre o ponto de ebulição.
Outro fator importante na determinação do ponto de
ebulição de uma molécula orgânica é considerar o
tamanho da molécula. Observe o exemplo abaixo de 2
moléculas com o mesmo peso molecular, porem com
tamanhos diferentes:
ISOMERIA
Isômeros são dois ou mais compostos diferentes
que apresentam a mesma fórmula molecular.
Éter dietilico. C4H8O
b) Álcool aromático, fenol e éter.
Exemplo:
Butanol C4H8O
TIPOS DE ISOMERIA:
KKKKKKKKKKKKKKKKKKKKKKKKKKKK
c) Aldeído e cetona.
Exemplo:
d) Ácido carboxílico e éster.
Exemplo:
ISOMERIA DE FUNÇÃO
Isomeria de função ou química é o caso de
isomeria plana na qual os isômeros pertencem à
funções químicas diferentes. Os principais casos de
isomeria funcional são:
a) Álcool e éter.
Exemplo:
TAUTOMERIA
É um caso particular da isomeria de função,
onde os compostos isômeros estabelecem um
equilíbrio químico dinâmico em solução. Os dois casos
mais importantes são os que ocorrem entre aldeído e
enol e entre cetona e enol.
Exemplo:
a) C2H4O
b) C3H6O
METAMERIA OU ISOMERIA DE COMPENSAÇÃO
ISOMERIA DE CADEIA
Isomeria de cadeia é o caso de isomeria plana
na qual os compostos isômeros pertencem à mesma
função química mas apresentam cadeias carbônicas
diferentes. No caso de compostos cíclicos a isomeria
de cadeia pode ser chamada isomeria de núcleo.
Exemplos:
Isomeria de compensação ou metameria é o
caso de isomeria plana na qual os isômeros
apresentam cadeia carbônica heterogênea e diferem
entre si pela posição do hetero-átomo.
Exemplos:
a)
ISOMERIA DE POSIÇÃO
Isomeria de posição é o caso de isomeria
plana na qual os isômeros pertencem à mesma função
química, apresentam a mesma cadeia carbônica, mas
diferem entre si pela posição de um grupo funcional ou
uma insaturação na cadeia carbônica.
Exemplos:
:
b)
ISOMERIA ESPACIAL
Isomeria espacial ou estereoisomeria é o caso
de isomeria no qual os compostos isômeros não
diferem entre si pelas suas fórmulas estruturais planas
mas sim pelas suas fórmulas estruturais espaciais
(fórmulas de Le Bel e Vant’Hoff).
ISOMERIA GEOMÉTRICA
Isomeria geométrica é um caso de isomeria
espacial que ocorre em compostos que apresentam
duplas ligações e em compostos cíclicos.
Consideremos o ácido butenodióico. Na
molécula deste composto os dois grupos carboxílicos
podem ficar de um mesmo lado ou em lados opostos
em relação ao plano determinado pela ligação pi; por
isto existem duas moléculas diferentes, correspondem
dois compostos diferentes que são os dois isômeros
geométricos do ácido butenodióico.
Nem todos os compostos que apresentam dupla
ligação entre átomos de carbono apresentam
isômeros geométricos. Assim os compostos seguintes
não têm isômeros geométricos ou cis-trans:
Havendo dois átomos ou radicais iguais ligados ao
mesmo átomo de carbono da dupla ligação, está
eliminada a possibilidade de isomeria geométrica.
Representando por a, b, c, e d os átomos ou radicais
ligados aos átomos de carbono da dupla ligação:
a) Compostos
geométricos:
que
não
apresentam
isômeros
b) Compostos que apresentam isômeros geométricos:
O ácido butenodióico cis é chamado ÁCIDO
MALEICO e o trans é chamado ÁCIDO FUMÁRICO.
Ácido butenodióico cis
ÁCIDO MALEICO
Ácido butenodióico trans
ÁCIDO FUMÁRICO
Os isômeros geométricos ou cis-trans de um
composto diferem entre si nas suas constantes físicas
(ponto de fusão, ponto de ebulição, densidade,
solubilidade, etc.), e em certas propriedades químicas.
Como exemplo de diferença de propriedade química
entre o ácido fumárico e malêico, podemos citar a
reação de desidratação por aquecimento. O ácido
malêico facilmente dá o anidrido malêico:
Outro exemplo:
Ácido Maleico
Anidrido Maleico
Por aquecimento do ácido fumárico em
condições enérgicas obtém-se o anidrido malêico (o
ácido fumárico sofre uma transformação em ácido
malêico e este se desidrata).
Por que o ácido butanodióico (ácido succínico), a
exemplo do ácido butenodióico, não apresenta dois
isômeros correspondentes às fórmulas estruturais
seguintes?
de caborno da dupla possuam, em conjunto, mais que
dois ligantes diferentes.
Onde a ≠ b ≠ c ≠ d
Nesses casos o mais correto é usar o sistema de
nomenclatura E-Z, proposto pelos químicos CahnIngold-Prelong. No qual se baseia nos números
atômicos dos ligantes, onde o ligante que tiver o maior
número atômico terá maior prioridade.
No ácido succínico os átomos de carbono 2 e
3 estão ligados entre si por meio de uma simples
ligação, isto é, de uma ligação sigma sp3 - sp3; nestas
condições, há livre rotação dos referidos átomos de
carbono em torno da ligação sp3 - sp3 e, com isto, as
moléculas correspondentes às fórmulas citadas
tornam-se iguais. No caso do ácido butenodióico, os
átomos de carbono estão ligados entre si por uma
ligação sigma sp2 - sp2, e uma ligação pi; esta ligação
pi impede a livre rotação dos átomos de carbono em
torno da ligação sp2 - sp2 e, por isto, as moléculas do
ácido malêico e fumárico são diferentes entre si.
Portanto, dois átomos de carbono ligados por uma
dupla ligação não têm livre rotação em torno da
ligação. Esta é a causa de isomeria geométrica.
Nesse sistema, a letra E vem da palavra
alemã entgegen, opostos (parecido com o trans) e a
letra Z vem da palavra alemã zusammen, juntos
(parecido com o cis).
Exemplos (compostos Acíclicos):
a)
b)
Ácido succínico
Ácido succínico
Exemplos (compostos cíclicos):
Então:
ISOMERIA E-Z
Os termos cis e trans podem se tornar
ambíguos se forem aplicados a alcenos cujos átomos
a)
Exemplo de isomeria cíclica:
Em Química Orgânica só interessa a atividade
óptica causada pela assimetria molecular. Quando a
atividade óptica é causada pela assimetria cristalina, a
substância só é opticamente ativa, quando no estado
cristalizado (estado sólido); pela fusão da substância
ou pela sua dissolução num líquido desaparece a
atividade óptica.
a)
ISOMERIA ÓPTICA
Isomeria óptica é um caso de estereoisomeria
que ocorre em compostos formados por MOLÉCULAS
ASSIMÉTRICAS.
O átomo de carbono que está ligado a quatro
radicais diferentes entre si (a, b, c, d) chama-se
carbono assimétrico ou carbono quiral (comumente
representado por C*).
SUBSTÂNCIAS ÓPTICAMENTE ATIVAS
Substâncias opticamente ativas são as que
têm a propriedade de desviar o plano de vibração da
luz polarizada.
Substâncias dextrógiras são as que desviam
plano de vibração da luz polarizada para
direita.
Substâncias levógiras são as que desviam
plano de vibração da luz polarizada para
esquerda.
o
a
o
a
Toda molécula que apresenta 1C* é assimétrica, e
como tal, produz ao espelho plano uma imagem que
não pode sobrepor ao objeto.
A estas duas moléculas (objeto e imagem ao espelho
plano) correspondem dois isômeros opticamente
ativos, um dextrógiro e outro levógiro, os quais são
denominados antípodas ópticos ou enantiomorfos.
Luz polarizada é a luz cujas ondas vibram em
um único plano. Existem certas substâncias capazes
de polarizar a luz; estas substâncias ao serem
atravessadas pela luz natural deixam passar apenas
as ondas que vibram num determinado plano e
absorvem as demais; a luz ao sair destas substâncias
está polarizada.
A atividade óptica pode ser causada por:
a) ASSIMETRIA CRISTALINA;
b) ASSIMETRIA MOLECULAR.
Há ainda o isômero opticamente inativo,
formado de quantidades equimolares dos dois
antípodas ópticos, o qual é denominado racemado ou
racêmico.
Assim, o ácido láctico racêmico é o isômero
opticamente inativo, formado de quantidades
equimolares dos dois antípodas ópticos (ácido láctico
dextrógiro e ácido láctico levógiro).
Pode-se provar que é a presença do carbono
assimétrico na molécula que produz a atividade óptica:
por meio de uma reação química pode-se fazer
“desaparecer” o C*; verifica-se, então, que o composto
formado não é mais opticamente ativo. Exemplo: por
oxidação do ácido láctico dextrógiro ou levógiro
obtém-se o ácido piroúvico o qual é opticamente
inativo, pois, não apresenta C* na molécula. De fato,
verifica108 se, facilmente, que a molécula do ácido
piroúvico não é assimétrica e, como conseqüência,
produz ao espelho plano, uma imagem que pode
sobrepor-se ao objeto.
Quando a partir de um composto que não
apresente C*, obtém-se outro com C*, obtém-se o
isômero racêmico (d, l), pois, a probabilidade de se
formar o isômero dextrógiro é a mesma de se formar o
isômero levógiro, e, na realidade, formam-se ambos
em quantidades equimolares; obtém-se, assim, o
isômero racêmico, que é opticamente inativo por
compensação externa. Assim, por hidrogenação da
butanona obtém-se o 2-butanol racêmico (d, l).
Outro exemplo: fazendo-se reagir o 2-cloro
butanol-2 dextrógiro ou levógiro com PCl5 obtém-se o
2-2-dicloro
butano
opticamente
inativo
pois
“desaparece” o C* na reação química.
Pela adição de HI ao 2-buteno obtém-se o 2iodo butano racêmico (d, l) pois formam-se
quantidades equimolares dos dois antípodas ópticos.
Consideremos alguns compostos com 2C*
diferentes na molécula.
Os compostos com 2C* diferentes na molécula
apresentam 4 isômeros opticamente ativos formando
dois pares de antípodas ópticos. Existem dois
isômeros dextrógiros (d1 e d2), dois levógiros (l1 e l2)
e dois racêmicos (d1l1 e d2l2). Considerando o 3-cloro
2-butanol teremos as fórmulas espaciais:
Sendo α e β os ângulos de desvio do plano de
vibração da luz polarizada correspondentes a cada C*,
e representando-se pelo sinal (+) o desvio para a
direita, e pelo sinal (-) o desvio para a esquerda, os
ângulos de desvio do plano de vibração da luz
polarizada produzidos pelos quatro isômeros
opticamente ativos, seriam:
Sendo n o número de átomos de C* diferentes
na molécula, já vimos que, para:
Generalizando-se:
À essas fórmulas espaciais correspondem as
seguintes fórmulas de projeção:
Esta generalização foi feita, pela primeira vez,
pelo notável Vant’Hoff. Esta fórmula não vale no caso
de composto apresentar, na molécula, pelo menos
2C* iguais. Por exemplo, o ácido tartárico tem 2C*
iguais pois os quatro diferentes átomos ou radicais
ligados a um dos C* são os mesmos que estão ligados
ao outro C*.
Sendo α o ângulo de desvio do plano de
vibração da luz polarizada produzido pelo C* teremos
as seguintes possibilidades:
Pelo fato de a molécula do ácido meso
tartárico apresentar um plano de simetria, a moléculaimagem no espelho plano é igual à molécula-objeto.
Como o ácido meso tartárico é formado por moléculas
114 simétricas, é claro que é opticamente inativo, pois,
a condição necessária para um composto orgânico ser
opticamente ativo é a sua molécula ser assimétrica.
Outro exemplo de composto orgânico com 2C* iguais:
Existem,
portanto,
4
isômeros,
dois
opticamente ativos (dextrógiro e levógiro) e dois
opticamente inativos; um destes é o racêmico (d,l) e o
outro é o chamado MESO. O isômero racêmico é
opticamente inativo por compensação externa, ou
intermolecular, pois, é formado de quantidades
equimolares dos dois antípodas ópticos (d e l); o
isômero Meso é opticamente inativo por compensação
interna, ou intramolecular (a compensação é dentro da
própria molécula pois um dos C* é dextrógiro e o outro
C* é levógiro).
As fórmulas de projeção dos isômeros ópticos
do composto acima são:
Existem casos de assimetria molecular em
compostos que não tem C*. Estes casos, porém, não
serão estudados no momento.
Diastereoisômeros são os isômeros ópticos
não enantiomorfos entre si; só aparecem em
compostos com mais de um átomo de carbono
assimétrico na molécula. No caso de um composto
com 2C* diferentes na molécula, o isômero d1 é
enantiomorfo do isômero l1, e diastereoisômero dos
isômeros d2 e l2; o isômero l1 é enantiomorfo do
isômero d1, e diastereoisômero dos isômeros d2 e l2;
o isômero d2 é enantiomorfo do 115 isômero l2, e
diastereoisômero dos isômeros d1 e l1, o isômero l2 é
enantiomorfo do isômero d2, e diastereoisômero dos
isômeros d1 e l1.
Dois antípodas ópticos de um composto
apresentam as mesmas constantes físicas (P.F., P.E.,
densidade, etc.) e o mesmo comportamento químico.
Diferem no sentido de rotação da luz polarizada.