Colégio Notre Dame de Campinas
Congregação de Santa Cruz
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
PLANTÕES DE FÉRIAS
QUÍMICA
Nome:
Profª
Nº:
BIANCA RIBEIRO
Série: 3º ANO
Data: JULHO 2016
Roteiro de Estudos
•
Primeiramente, revise em seu caderno alguns conceitos importantes da eletroquímica, como:
o Número de oxidação; oxidação e redução; agente oxidante e redutor; cátodo e ânodo; polo
positivo e negativo; potenciais de redução e oxidação.
o Pilha e Eletrólise: ígnea e aquosa.
•
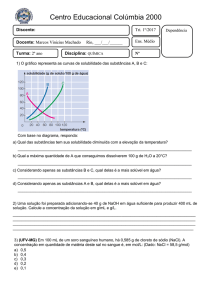
Relembre os aspectos quantitativos da eletrólise, isto é, a estequiometria da eletrólise.
•
Reveja as condições necessárias para uma reação ocorrer e todos os fatores que podem alterar a
velocidade.
•
Recapitule também como fazer o cálculo da velocidade média e montar a equação que mostra os
reagente que interferem na velocidade da reação na etapa determinante da reação.
•
Recorde todos os conceitos relacionados a estequiometria, além de como calcular rendimento e pureza
de uma reação.
•
Resolva os exercícios e venha no plantão para tirar dúvidas e discutir os mais complicados!
Exercícios
1) Ao longo do tempo, os objetos feitos de prata escurecem
e perdem seu brilho, em razão do processo de oxidação da
prata em contato com o oxigênio do ar e também com
compostos que contêm enxofre (compostos sulfurados).
Desse modo, a superfície do objeto fica com uma camada
de cor azul ou ligeiramente violácea, que é o sulfeto de
prata formado nessa reação:
4 Ag(s) + O2(g) + 2 H2S(g) →2 Ag2S(s) + 2 H2O(ℓ)
Analisando essa reação, vemos que há transferência de
elétrons. Sobre ela, é incorreto afirmar:
a. H2S(g) não participa na transferência de elétrons.
b. H2S(g) é o agente redutor
c. A prata é o agente redutor.
d. O oxigênio é o agente oxidante.
e. A prata oxidou-se e o oxigênio reduziu-se.
2) Em 1856, Berthelot preparou metano segundo a reação
representada pela equação abaixo, não balanceada:
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
CS2 + H2S + Cu → Cu2S + CH4
a) Acerte os coeficientes estequiométricos pelo método da
oxidorredução.
b) Indique o elemento que se oxida mostrando a variação dos
números de oxidação.
3) Baseado na lista de potenciais padrões de redução abaixo,
responda qual espécie química entre os íons indicados nas
alternativas é o melhor agente oxidante:
Li+ + e- Li0
a. Li0
Na+ + e- Na0
Zn2+ + 2e- Zn0
2H+ + 2e- H2
Cu2+ + 2e- Cu0
I2 + e- 2 I
b. Na+ c. Zn2+ d. Cu2+
E0 = - 3,0 V
E0 = - 2,7 V
E0 = - 0,76 V
E0 = 0 V
0
E = + 0,34 V
E0 = + 0,53 V
e. I2
4) Considere as seguintes semirreações para uma determinada
pilha:
Ag+ + e- Ag0
E0= +0,80 V
Mg2+ + 2e- Mg0
E0= -2,37 V
a. Qual é a semirreação de cada eletrodo?
b.Identifique o cátodo, o ânodo, o polo negativo e o polo
positivo.
c.Qual é o valor de ∆E0?
d.Qual é o melhor agente oxidante da pilha?
5) Observe a célula eletroquímica na figura a seguir:
Indique a representação correta do ânodo e do cátodo dessa
pilha:
a. Zn2+/Zn//Al/Al3+ b. Zn+/Zn//Al/Al3+
c. Al/Al3+//Zn2+/Zn d. Al/ Al+//Zn+/Zn
e. Al/Al2+//Zn2+/Zn
6) Com respeito aos potenciais-padrão de redução dos metais,
assinale a alternativa incorreta:
a. Um potencial de redução positivo indica que na semicélula
ocorre um processo de redução, enquanto no eletrodo de
hidrogênio ocorre a oxidação.
b. Quanto maior for o potencial de redução, maior será o
caráter oxidante da espécie.
c. Os potenciais-padrão de redução são medidos em
condições-padrão, ou seja, condições que implicam em
concentrações de 1,0 mol/L para as espécies em solução
aquosa e pressão de 1 bar para os gases e eletrodos do
respectivo metal ou de platina — caso não haja metal presente
na reação.
d. A medida da força eletromotriz (ΔE) de uma pilha obtida por
meio da diferença dos potenciais de redução sempre dará um
número negativo.
e. A medida da força eletromotriz (ΔE) de uma pilha não se
altera quando a massa do cátodo é aumentada.
7) (UFPR) A corrosão dos metais é um processo de considerável
importância econômica porque diminui a vida útil dos produtos
metálicos, cuja substituição é de custo elevado.
Durante o processo de corrosão, os metais sofrem oxidação. O
ferro, por exemplo, oxida-se, resultando na ferrugem (Fe2O3 .
H2O). A transformação de ferro metálico em ferrugem só
ocorrerá na presença de um agente oxidante. As semirreações
a seguir estão envolvidas no processo de corrosão do ferro.
I – Fe3+(aq) + 3 e- → Fe(s)
E0 = - 0,04 V
II – 2 H2O(líq) + 2 e → H2(g) + 2 OH (aq)
E0 = - 0,41 V
+
III – O2(g) + 4 H (aq) + 4 e → 2 H2O(líq)
E0 = + 0,82 V
Uma maneira simples de prevenir a corrosão consiste em
proteger a superfície metálica pela pintura. Outra forma de
proteção é a galvanização, que
consiste na aplicação de uma
camada de zinco à superfície do
ferro. Grandes estruturas podem ser
protegidas pela sua conexão a um
bloco de zinco ou magnésio (ver
figura ao lado, em que M representa
Mg ou Zn).
Conforme o caso, as semirreações envolvidas são:
IV – Zn2+(aq) + 2 e- → Zn(s)
E0 = - 0,76 V
V – Mg2+(aq) + 2 e- → Mg(s)
E0 = - 2,36 V
Com base no texto acima, é correto afirmar sobre o processo
de corrosão do ferro:
1. As semirreações I e II indicam que uma película de água
pura sobre a superfície do ferro é um poderoso oxidante desse
metal, resultando na ferrugem.
2. A semirreação III revela que o gás oxigênio favorece o
processo de corrosão.
3. Uma película de tinta previne a corrosão por impedir o
contato do metal com o agente oxidante.
4. Na galvanização, o zinco protege o ferro por ceder elétrons
mais facilmente que este último.
5. O zinco é um melhor redutor que o magnésio.
8) (Unifor-CE) As proposições a seguir estão relacionadas com
eletrólise:
I. As reações de eletrólise ocorrem com consumo de energia
elétrica.
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
II. Soluções aquosas de glicose não podem ser eletrolisadas
porque não conduzem corrente elétrica.
III. Nas eletrólises de soluções salinas, os cátions metálicos
sofrem oxidação.
Podemos afirmar que apenas:
a. I é correta b. II é correta c. III é correta
d. I e II são corretas e. II e III são corretas
9) Julgue como verdadeiras ou falsas as afirmativas abaixo em
relação à eletrólise:
a. A redução acontece no cátodo e a oxidação no ânodo
b. Trata-se de um processo de oxirredução
c. O cátodo fornece elétrons dos cátions do eletrólito e tem sinal
positivo
d. O ânodo recebe elétrons dos ânions do eletrólito e tem sinal
positivo
e. A eletrólise é uma reação de oxirredução espontânea.
f. A eletrólise de sais só é possível quando eles são dissolvidos
em meio aquoso
10) (UFRGS) No cátodo de uma célula de eletrólise sempre
ocorre:
a. Deposição de metais
b. Uma semirreação de redução
c. Produção de corrente elétrica
d. Corrosão química
e. Desprendimento de gás hidrogênio
11) (FEI-SP) Dois alunos de Química realizaram eletrólise do
BaCl2; a primeira aquosa e, a segunda, ígnea. Com relação ao
resultado, podemos afirmar que ambas obtiveram:
a. H2 e O2 nos ânodos b. H2 e Ba nos ânodos
c. Cl2 e Ba nos eletrodos e. Cl2 nos ânodos
12) (UFRS) Na eletrólise de nitrato de ferro II, em solução
aquosa, ocorre:
a. redução no polo negativo com formação de Fe(s)
b. oxidação no polo negativo com liberação de O2(g)
c. redução no polo positivo com liberação de O2(g)
d. oxidação no polo positivo com formação de NO2(g)
e. redução no polo negativo com formação de H2(g)
a. Elétrons da esquerda para a direita
b. Elétrons da direita para a esquerda
c. Cátions da esquerda para a direita e ânions da direita para
a esquerda
d. Cátions da direita para a esquerda e ânions da esquerda
para a direita
e. Cátions e ânions da esquerda para a direita
14) (UFSE) Na eletrólise de uma solução de sulfato cúprico,
tem-se a seguinte redução catódica:
Cu2+(aq) + 2e- → Cu(s)
Quantos mols de íons de Cu2+(aq) são reduzidos por uma
quantidade de eletricidade igual a 1,0 faraday?
a. 0,50
b. 1,0 c. 1,5 d. 2,0 e. 2,5
15) (Unifor-CE) Na obtenção industrial do alumínio, ocorre a
seguinte reação catódica:
Al3+ + 3 e- → Al
Sabendo que 1 F (faraday) é a carga de 1 mol de elétrons,
quantos faradays provocam a deposição de 9 quilogramas de
alumínio? (Dado: MA = 27 u)
a. 3
b. 30 c. 100 d. 300 e. 1000
16) A figura seguinte mostra o diagrama de energia potencial
de uma reação:
A+B→C+D
13) (ITA) A figura a seguir mostra o esquema da aparelhagem
utilizada por um aluno para realizar a eletrólise de uma solução
aquosa ácida, com eletrodos inertes. Durante a realização da
eletrólise, pela secção tracejada (A----B), houve a seguinte
movimentação de partículas eletricamente carregadas através
da solução:
Qual é a energia de ativação para essa reação e qual deve ser
a energia do complexo ativado em kJ/mol?
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
a. 80 e 100 b. 20 e 100 c. 60 e 100 d. 80 e 20
e. 80 e 60
17) Analise o diagrama fornecido a seguir:
A+B→C+D
Assinale a alternativa correta:
a. A energia de ativação do processo é igual a 250kJ
b. A energia do complexo ativado é igual a 120kJ
c. A energia dos reagentes é igual a 120 kJ
d. A energia dos produtos é igual a 120 kJ
e. A reação é endotérmica
20) (VUNESP) A hidrólise do brometo de metila pode ser
representada pela equação abaixo e pelo gráfico a seguir:
CH3Br(ℓ) + 2 H2O(ℓ) → CH3OH(ℓ) + H3O1+(aq) + Br1-(aq)
18) A velocidade em que as reações químicas podem
processar-se varia muito, já que existem fatores que interferem
na ocorrência e na velocidade das reações. Baseando-se nesses
fatores, analise as proposições abaixo e marque a alternativa
falsa:
a. A velocidade de uma reação pode ser determinada pela
relação entre a velocidade de consumo de um reagente e a
unidade de tempo.
b. É necessário haver colisão entre as partículas para que uma
reação ocorra.
c) Energia de ativação é um fator que influencia a velocidade
Com relação a essa reação, assinale a alternativa que contém a
da reação.
afirmação incorreta.
d) A velocidade de uma reação é influenciada pela afinidade
a. O íon I- é catalisador da reação, que se processa com
química entre os reagentes.
liberação de calor
e) A velocidade de uma reação não é influenciada pelo contato a. b. E4 é a energia de ativação do catalisador, que é o I entre os reagentes.
b. c. E3 é o abaixamento de energia de ativação devido ao
catalisador
19) Considere a reação química de decomposição do gás c. d. E5 é a variação de entalpia da reação, que é exotérmica
pentóxido de dinitrogênio:
d. e. E1 é a energia de ativação sem catalisador e E2 é a
2 N2O5(g) → 4 NO4(g) + O2(g)
energia de ativação com catalisador
O gráfico abaixo foi construído com os dados obtidos em um
experimento envolvendo essa transformação a 55ºC e que
21) (UnB) Considere os estudos cinéticos de uma reação
estão descritos na tabela abaixo:
química e julgue os itens abaixo:
(1) Toda reação é produzida por colisões, mas nem toda colisão
gera uma reação.
(2) Uma colisão altamente energética pode produzir uma
reação.
(3) Toda colisão com orientação adequada produz uma reação.
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
(4) A energia mínima para uma colisão efetiva é denominada
energia da reação.
(5) A diferença energética entre produtos e reagentes é
denominada energia de ativação da reação.
22) A temperatura é um fator que controla a velocidade das
reações químicas que ocorrem no organismo. Quando a
temperatura corporal aproxima-se de 41,7 ºC, pode causar
morte, pois acelera todas as reações do corpo, destruindo
substâncias vitais como as enzimas, que atuam como
catalisadores de reações bioquímicas. A partir do que foi
exposto, analise as afirmativas a seguir:
I – O aumento da temperatura provoca o aumento da
velocidade das partículas formadoras de um sistema reacional,
consequentemente, diminui a velocidade das reações
II – Os catalisadores, em qualquer reação química, são
consumidos, aumentando a energia de ativação do processo
III – Enzimas são catalisadores biológicos que diminuem a
velocidade das reações, diminuindo a energia de ativação
IV – Enzimas são catalisadores biológicos que aumentam a
velocidade das reações, diminuindo a energia de ativação
A alternativa que apresenta o item ou itens correto(s) é:
a. III b. IV c. I e II d. I e III e. II e IV
23) O hidrogênio é um gás que pode ser obtido a partir da
reação do zinco (Zn) com solução de ácido clorídrico (HCl).
Essa reação foi realizada várias vezes, modificando-se as
condições do meio reacional, como temperatura, forma do
zinco e concentração da solução ácida. Observe a tabela que
descreve essas condições:
Experiência
I
II
III
IV
V
Temp. (°C)
Zinco
[HCl] (mol/L)
25
Granulado
1
25
Granulado
0,5
30
Em pó
1
30
Em pó
0,5
30
Em raspas
1
Analisando a tabela, em qual caso a velocidade da reação será
maior:
a. I b. II c. III d. IV e. V
24) Qual é a ordem crescente de velocidade das reações
abaixo em que um comprimido efervescente é dissolvido em
uma mesma quantidade de água:
Experimento
Comprimido
Temperatura H2O
1
Inteiro
20 °C
2
Em pedaços
40 °C
3
Inteiro
40 °C
a. 1<2<3 b. 3<2<1 c. 1<3<2 d. 3<1<2 e. 2<3<1
25) (FUVEST) Em solução aquosa ocorre a transformação:
H2O2 + 2 I- + 2 H+ → 2 H2O + I2
Em quatro experimentos, mediu-se o tempo decorrido para a
formação de mesma concentração de I 2, tendo-se na mistura
de reação as seguintes concentrações iniciais de reagentes:
Experimento
Concentrações (mol/L) Tempo (s)
Esses dados indicam que a velocidade da reação considerada
depende apenas da concentração de:
a. H2O2 e I− b. H2O2 e H+
c. H2O2 d. H+ e. I−
26) Quando o ar de uma cidade está muito poluído, várias
reações químicas podem ocorrer na atmosfera do local. Uma
delas é a reação entre o dióxido de nitrogênio e o ozônio, que
forma trióxido de nitrogênio e gás oxigênio, como na equação
a seguir:
NO2(g) + O3(g) → NO3(g) + O2(g)
Utilizando os dados a seguir para a equação fornecida,
determine a expressão da velocidade e o valor da constante
da velocidade desse processo:
V (mol/L.s)
[NO2] (mol/L) [O3] (mol/L)
6,6.10-2
15.10-5
3.10-5
13,2.10-2
15.10-5
6.10-5
-2
-5
6,6.10
7,5.10
6.10-5
7
a. v=k.[NO2] e 2,2.10
b. v=k.[O3] e 4,4.107
c. v=k.[NO2].[O3] e 1,5.107 d. v=k.[NO2].[O3] e 2,0.107
e. v=k.[NO2]+[O3] e 2,2.107
27) (ITA) Uma certa reação química é representada pela
equação:
2A(g) + 2B(g) → C(g)
onde “A”, “B” e “C” significam as espécies químicas que são
colocadas para reagir. Verificou-se experimentalmente, em uma
certa temperatura, que a velocidade dessa reação quadruplica
com a duplicação da concentração da espécie “A”, mas não
depende das concentrações das espécies “B” e “C”.
Assinale a opção que contém, respectivamente, a expressão
CORRETA da velocidade e o valor CORRETO da ordem da
reação.
a. v = k[A] 2.[B]2 e 4 b. v = k[A]2.[B]2 e 3
c. v = k[A] 2.[B]2 e 2 d. v = k[A]2 e 4 e. v = k[A] 2 e 2
28) (PUC-MG) Fosgênio, COCl 2, é um gás venenoso. Quando
inalado, reage com a água nos pulmões para produzir ácido
clorídrico (HCl), que causa graves danos pulmonares, levando,
finalmente, à morte: por causa disso, já foi até usado como gás
de guerra. A equação química dessa reação é:
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
COCl2 + H2O → CO2 + 2 HCl
Se uma pessoa inalar 198 mg de fosgênio, a massa de ácido
clorídrico, em gramas, que se forma nos pulmões, é igual a:
a. 1,09.10-1 b. 1,46.10-1 c. 2,92.10-1 d. 3,65.10-2
e. 7,30.10-2
29) Quantas moléculas de água, H2O(v), são obtidas na
queima completa do acetileno C2H2(g), ao serem consumidas
3,0.1024 moléculas de gás oxigênio?
a. 20.1024 b. 0,12.1023
c. 12.1024
d. 1,2.1023
e. 1,2.1024
30) Quantos moles de clorato de potássio são necessários para
a produção de 33,6 litros de oxigênio (CNTP) na decomposição
térmica do clorato de potássio?
31) Rodando a 60 km/h, um automóvel faz cerca de 10 km por
litro de etanol (C2H5OH). Calcule o volume de gás carbônico
(CO2), em metros cúbicos, emitido pelo carro após cinco horas
de viagem. Admita queima completa do combustível.
Dados: Densidade do etanol: 0,8 kg/L
a. 13 b. 26 c. 30 d. 33 e. 41
32) Um carro pode emitir em cada minuto 600 litros de gases,
dos quais 4% em volume correspondem a CO. A emissão de CO
pode ser diminuída transformando-o em CO2, através da reação
com excesso de ar, em presença de catalisador.
a. Qual a quantidade de CO, em moles, emitida pelo veículo em
uma hora?
I
b. Por que é necessário o uso de catalisador?
II
33) São colocadas para reagir entre si, as massas de 1,00 g de III
sódio metálico e 1,00 g de cloro gasoso. Considere que o
rendimento da reação é 100%.
IV
A afirmação correta é:
a. Há excesso de 0,153 g de sódio metálico
b. Há excesso de 0,352 g de sódio metálico
c. Há excesso de 0,282 g de cloro gasoso
d. Há excesso de 0,153 g de cloro gasoso
e. Nenhum dos dois elementos está em excesso
34) O inseticida DDT (MM = 354,5g/mol) é fabricado a partir
de clorobenzeno (MM = 112,5g/mol) e cloral, de acordo com
equação:
2 C6H5Cl + C2HCl3O C14H9Cl5 + H2O
Partindo-se de uma tonelada de clorobenzeno e admitindose
rendimento de 80%, a massa de DDT produzida é igual a:
a. 1,575t b. 1,206t c. 800,0kg d. 354,5kg e. 160,0 kg
35) O nitrogênio pode ser obtido pela decomposição térmica do
nitrito de amônio.
a) Escreva a equação de decomposição do nitrito de amônio.
b) Calcule o volume de nitrogênio obtido, nas condições
normais de pressão e de temperatura, pela decomposição de
12,8g de nitrito de amônio, supondo que o rendimento da
reação seja de 80% (em massa).
36) O acetileno, substância de grande aplicação, é um gás
menos denso do que o ar, empregado especialmente como
combustível, uma vez que, quando queima em atmosfera de
oxigênio puro, fornece uma chama azul de elevada
temperatura. O processo industrial de obtenção de acetileno
pode ser demonstrado pela equação:
CaC2 + 2 H2O C2H2 + Ca(OH)2
Sabendo-se que 100g de carbeto de cálcio reagem com
quantidade suficiente de água para a obtenção de 24,6g de
acetileno, qual o rendimento porcentual dessa reação?
37) Fazendo-se reagir 3,4 g de NH3 com quantidade
suficiente de O2, segundo a reação
4 NH3 + 3 O2 2 N2 + 6 H2O
obteve-se 2,1 g de N2. O rendimento dessa reação foi
aproximadamente:
a. 75% b. 70% c. 50% d. 25% e. 20%
38) A combustão completa de um mol de um alcano gastou
179,2 litros de oxigênio nas condições normais de temperatura
e pressão. Esse alcano é o:
a. pentano b. hexano c. heptano d. octano e. nonano
39) (UFMG) Considere as seguintes reações químicas, que
ocorrem em recipientes abertos, colocados sobre uma balança:
– Reação de bicarbonato de sódio com vinagre, em um copo
– Queima de álcool, em um vidro de relógio
– Enferrujamento de um prego de ferro, colocado sobre um
vidro de relógio
– Dissolução de um comprimido efervescente, em um copo com
água
Em todos os exemplos, durante a reação química, a balança
indicará uma diminuição da massa contida no recipiente, exceto
em:
a. III b. IV c. I d. II
40) (FUVEST) Quando 96 g de ozônio se transformam
completamente, a massa de oxigênio comum produzida é igual
a:
a. 32 g
b. 48 g c. 64 g d. 80 g e. 96 g
41) (VUNESP) Foram analisadas três amostras (I, II e III) de
óxidos de enxofre, procedentes de fontes distintas, obtendo-se
os seguintes resultados:
Amostra Massa de Massa
Massa da
S (g)
de O2 (g) amostra (g)
I
0,32
0,32
0,64
II
0,08
0,08
0,16
III
0,32
0,48
0,8
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
a.
b.
c.
d.
e.
Esses resultados mostram que:
as amostras I, II e III são do mesmo óxido
apenas as amostras I e II são do mesmo óxido
apenas as amostras II e III são do mesmo óxido
apenas as amostras I e III são do mesmo óxido
as amostras I, II e III são de óxidos diferentes
42) (Cesgranrio-RJ) Em um processo de obtenção de ferro a
partir da hematita (Fe2O3(s)), considere a equação não
balanceada:
Fe2O3(s) + C(s) → Fe(s) + CO(g)
Utilizando-se 4,8 t de minério e admitindo-se um rendimento
de 80% na reação, a quantidade de ferro produzida será de:
a. 2688 kg b. 3360 kg c. 1344 t d. 2688 t e. 3360 t
43) O calcário é um minério constituído principalmente de
carbonato de cálcio (CaCO3). Quando esse minério é aquecido,
são produzidos cal viva (óxido de cálcio) e dióxido de carbono.
Se forem produzidos 52,5 g de gás carbônico a partir de 128,19
g de carbonato de cálcio, qual será o rendimento aproximado
dessa reação?
a. 70% b. 80% c. 84% d. 93% e. 94%
44) Uma das formas de produção da amônia é a partir da
reação entre a cal viva (óxido de cálcio) e o cloreto de amônio.
Veja essa reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10,5 g de uma amostra de cal viva foram colocados para reagir
com excesso de cloreto de amônio e foram produzidos 5,1 g de
amônia. Qual é o grau de pureza em óxido de cálcio dessa
amostra de cal viva usada?
45) O dióxido de titânio é um pó branco, sendo o pigmento
mais utilizado no mundo em tintas para superfícies metálicas e
em plásticos. Ele apresenta muitas vantagens, como alta
durabilidade e resistência ao calor. Esse composto passa por
análises de pureza, e uma delas consiste em reagir uma
amostra sua com trifluoreto de bromo com a formação de
oxigênio como um dos produtos, como mostra a reação logo
mais abaixo. A massa de oxigênio produzida é determinada e,
com isso, pode-se verificar a pureza do dióxido de titânio.
3 TiO2(s) + 4 BrF3(l) → 3 TiF4(s) + 2 Br2(l) + 3 O2(g)
50 g de uma amostra de dióxido de titânio foram analisados
dessa forma, tendo sido produzidos 14 g de gás oxigênio. Qual
é a porcentagem, em massa, de dióxido de titânio nessa
amostra?
Colégio Notre Dame de Campinas
Congregação de Santa Cruz
GABARITO
1)
2)
b
a. 2 CS2 + 4 H2S + 16 Cu 8 Cu2S + 2 CH4
b. Cu0 Cu+
3) e
4)
a. Cátodo (redução): Ag+ + e- Ag0 Ânodo (oxidação): Mg 2e- + Mg2+
b. Cátodo (pólo +): Ag Ânodo (pólo -): Mg
c. ∆E = + 3,17 V
d. Ag+
5) c
6) d
7) 1, 2, 3 e 4.
8) d
9) V, V, F, V, F, F
10) b
11) e
12) a
13) c
14) a
15) e
16) a
17) b
18) e
19) e
20) b
21) V, V, F, F, F
22) b
23) III
24) c
25) a
26) c
27) e
28) b
29) e
30) 1 mol
31) b
32) a) 64,3 mol b) Diminui a poluição, já que o CO é uma substância tóxica.
33) c
34) b
35) a) NH4NO2 N2 + 2 H2O b) 3,58L de N2
36) 60%
37) a
38) a
39) a
40) e
41) b
42) a
43) d
44) d
45) b