CPV seu pé direito também na Medicina
UNESP – 19/dezembro/2010
QUÍMICA
16. Um paciente infectado com vírus de um tipo de herpes toma, a cada 12 horas, 1 comprimido de um medicamento que contém
125 mg do componente ativo penciclovir.
Dados: Massa molar (g . mol–1): H = 1; C = 12; N = 14; O = 16.
Constante de Avogadro: N = 6,02 x 1023 mol–1.
Dê a fórmula molecular e a massa molar do penciclovir e calcule o número de moléculas desse componente que o paciente
ingere por dia.
Resolução:
Fórmula molecular:
C10 H15 N5 O3
Massa molar:
253 g / mol
Por dia:
2 comprimidos Þ
2 x 125 mg = 250 mg =
= 0,25 g de penciclovir
1 mol – 253 g ____________6,02 . 1023 moléculas
0,25 g
____________x
x @ 6,00 . 1020 moléculas
CPV
UNESP2011
1
2
UNESP – 19/12/2010
CPV seu pé direito também na Medicina
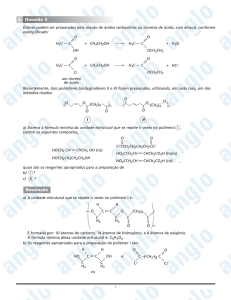
17. O folheto de um óleo para o corpo informa que o produto é preparado com óleo vegetal de cultivo orgânico e óleos essenciais
naturais. O estudo da composição química do óleo vegetal utilizado na fabricação desse produto permitiu identificar um éster
do ácido cis,cis-9,12-octadecadienoico como um de seus principais componentes.
Escreva a fórmula estrutural completa do ácido cis,cis-9,12-octadecadienoico e indique como essa substância pode ser obtida
a partir do óleo vegetal.
Resolução:
Ácido cis, cis – 9,12 – octadecadienoico
O
C – CH2 – CH2 – CH2 – CH2 – CH2 – CH2 – CH2
CH2
CH2 – CH2 – CH2 – CH2 – CH3
HOC —
C—
— C
— C
H
H H
H
O ácido acima pode ser obtido a partir da reação de hidrólise do óleo vegetal (basicamente constituído de triésteres).
Reação genérica:
hidrólise
triéster + 3 H2O ←
→
3 ácido graxo + glicerol
(óleo)
ou
O
||
R – C – O – CH2
O OHO – CH2
|
|
|| |
hidrólise
R – C – O – CH + 3 HOH ←
→
3 R – C – OH + HO – CH
|
O
águaácido HO – CH2
|
|
graxo
glicerol
R – C – O – CH2
triéster (óleo)
CPV
R Þ radical orgânico de cadeia longa
UNESP2011
CPV seu pé direito também na Medicina
UNESP – 19/12/2010
3
18. A quantidade de oxigênio dissolvido em um reservatório com 10 000 L de água foi determinada pela dosagem do hidróxido
de manganês III, formado segundo a reação descrita pela equação:
xMn(OH)2(aq) + yO2(aq) + wH2O(aq) → zMn(OH)3(s)
Conhecidas as massas molares (g . mol–1) do Mn(OH)3 = 106 e do O2 = 32, e sabendo que o tratamento de 1 L dessa água
com excesso de Mn(OH)2(aq) produziu 0,103 g de Mn(OH)3, determine os coeficientes da equação e calcule a massa total,
em gramas, de O2 dissolvido no reservatório de água.
Resolução:
Mn +2 − 1e− → Mn +3 ( x 4)
+2
− 4e− → 4 Mn +3
4 Mn
⇒
0
−
−2
O02 + 4e− → 2 O−2
O 2 + 4e → 2 O
Logo:4 Mn (OH)2 + 1 O2 + 2 H2O → 4 Mn(OH)3
:
:
1 mol
4 mols
32 g
___________ 424 g
*
x
___________ 0,103 g / L
x = 0,00777 g / L (gramas O2 / litro de água no reservatório)
*
1 L
____________________
0,00777 g O2
10.000 L____________________y
y @ 77,7 g O2
COMENTÁRIO DA PROVA DE QUÍMICA UNESP 2011
Prova simples, exigindo conceitos básicos do conteúdo lecionado no Ensino Médio. Foram cobrados assuntos relacionados à
Química Geral (Teoria Atômico-Molecular, Oxirredução e Cálculo Estequiométrico) e Química Orgânica (Montagem de Fórmulas
e Reação de Hidrólise de ésteres).
DISTRIBUIÇÃO DOS CONTEÚDOS
Química Geral – Teoria Atômico-Molecular: 33%
Química Geral – Oxirredução:17%
Química Geral – Cálculo Estequiométrico: 17%
Química Orgânica – Fórmulas e Reações Orgânicas: 30%
CPV
UNESP2011