Nome:
ENS. MÉDIO
Professor: RICARDO
2ª SÉRIE
2014
DEPENDÊNCIA
TRABALHO
QUÍMICA
30,0 pts
- Fazer o trabalho manuscrito.
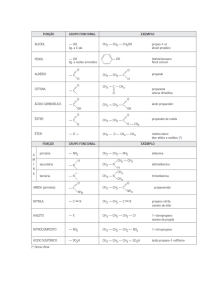
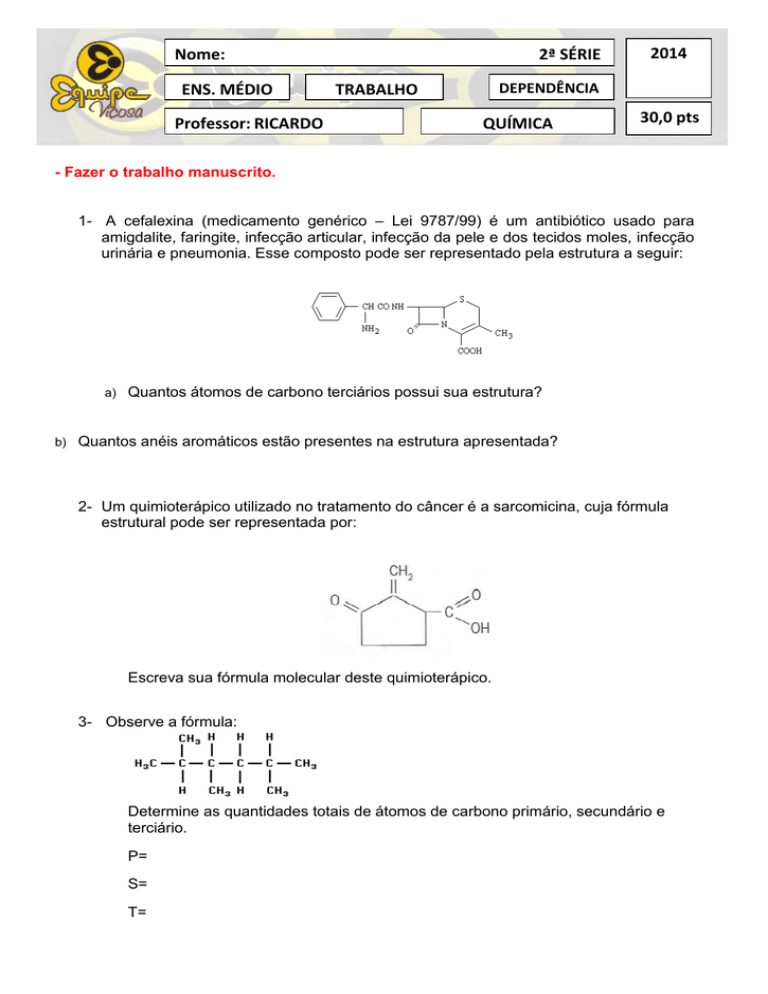
1- A cefalexina (medicamento genérico – Lei 9787/99) é um antibiótico usado para
amigdalite, faringite, infecção articular, infecção da pele e dos tecidos moles, infecção
urinária e pneumonia. Esse composto pode ser representado pela estrutura a seguir:
a)
b)
Quantos átomos de carbono terciários possui sua estrutura?
Quantos anéis aromáticos estão presentes na estrutura apresentada?
2- Um quimioterápico utilizado no tratamento do câncer é a sarcomicina, cuja fórmula
estrutural pode ser representada por:
Escreva sua fórmula molecular deste quimioterápico.
3- Observe a fórmula:
Determine as quantidades totais de átomos de carbono primário, secundário e
terciário.
P=
S=
T=
4- A partir das figuras abaixo, responda:
Indique o número de carbonos
primários (P), secundários (S), terciários (T) e quaternários (Q) existentes na
estrutura II.
P=
S=
T=
Q=
5- Classifique as cadeias de acordo com:
Aberta, fechada ou aromática
Natureza (Homogênea ou heterogênea)
Disposição (Normal ou Ramificada)
Tipo de ligação (saturado ou insaturado)
a)
b)
c)
d)
6- Considere o composto abaixo e responda:
a) Qual a hibridização do carbono 2?
b) Qual a hibridização do carbono 7?
c) Qual a hibridização do carbono 8?
7- Dê o nome dos seguintes hidrocarbonetos:
a) CH3CH2CH2CH2CH2CH3
→
b) H3C - CH2 - CH = CH2
→
c) H2C = CH - CH = CH - CH3
→
d) HC ≡ C – CH3
e)
→
→
8- Dê o nome das seguintes substâncias abaixo:
a)
b)
c)
9-
CH3 – CH = CH– CH2 – CO– CH3
HC C– CH2 – COOH
CH2 = CH – CH2 – CH2 – CHO
Dê o nome das seguintes substâncias abaixo:
10- Monte a estrutura dos seguintes compostos
a) Anilina (fenilamina)
b) Metilfenilamina
c) Cloreto de etila
11- As figuras abaixo representam moléculas constituídas de carbono, hidrogênio e
oxigênio.
Quais os nomes dos compostos representados na figura, respectivamente.
12- A novocaína é um anestésico de fórmula representada a seguir.
Este composto apresenta quais grupos funcionais:
13- A cortisona é um esteróide que possui efeito antiinflamatório e é importante no
tratamento da asma e da artrite.
A partir de sua estrutura, podemos afirmar que a cortisona apresenta quais funções
orgânicas:
14- Considere o esquema a seguir e responda:
a) Em qual eletrodo ocorre redução? E a oxidação?
Redução:
Oxidação:
b) Qual é o cátodo? E o ânodo?
Cátodo:
Ânodo:
c) Qual é o pólo positivo? E o pólo negativo?
Pólo positivo:
Pólo negativo:
d) Em qual eletrodo ocorre deposição? E corrosão?
Deposição:
Corrosão:
e) Qual solução se dilui? E qual solução se concentra?
Se dilui:
Se concentra:
f) Qual é o sentido de fluxo dos elétrons?
g) Qual é a semirreação de redução? Qual é a semirreação de oxidação?
Redução =
Oxidação =
15- Uma solução foi preparada misturando-se 20 g de um sal com 80 g de água, originando
uma solução cujo volume é 100 mL. Determine:
a) sua densidade
b) sua concentração
obs = (os dois em g/L).
16- Considere duas latas do mesmo refrigerante, uma na versão "diet" e outra na versão
comum. Ambas contêm o mesmo volume de líquido (300mL) e têm a mesma massa
quando vazias. A composição do refrigerante é a mesma em ambas, exceto por uma
diferença: a versão comum contém certa quantidade de açúcar, enquanto a versão
"diet" não contêm açúcar (apenas massa desprezível de um adoçante artificial).
Pesando-se duas latas fechadas do refrigerante, foram obtidos os seguintes resultados:
Por esses dados, determine a concentração, em g/L, de açúcar no refrigerante
comum.
17- A água boricada é uma solução de ácido bórico (H3BO3) usada medicinalmente para
fins anti-sépticos em pequenas feridas e queimaduras. Considerando que esta
solução tem concentração igual a 30 g/L de ácido bórico, a massa aproximada de
soluto em 500mL de solução é:
18- Ao ser ingerido, o cianeto se distribui rapidamente pelos tecidos do corpo humano,
ligando-se à hemoglobina. Um dos antídotos utilizados é o nitrito de sódio. Em uma
pessoa intoxicada por cianeto, foram administrados intravenosamente 10 mL de nitrito
de sódio 3% p/v. A quantidade de nitrito de sódio administrada a essa pessoa, foi de:
19- No rótulo de uma garrafa de água mineral, lê-se:
Nessa água mineral, determine a concentração de nitrato de sódio (NaNO 3) em
mol/L.
Dados: Na = 23; N = 14; O = 16
(dica: cuidado com a unidade da massa)
20- No gráfico a seguir estão representadas cinco transformações:
Quais dessas transformações estão representadas corretamente? Justifique sua resposta.
OBS: só existe água na forma: sólida, líquida e vapor
21- Dada a reação:
H2O(l) H2(g) + ½ O2(g)H = + 68,3 kcal
Responda:
a) A reação é exotérmica ou endotérmica?
b) Represente esse processo num gráfico entalpia x caminho da reação
22-Atualmente, a indústria automobilística busca o desenvolvimento de motores que utilizam
combustíveis alternativos (GNV, álcool, biodiesel, gás hidrogênio). Dentre esses, o H 2 é
considerado o combustível que não causa poluição. O gráfico abaixo representa a
combustão do gás hidrogênio.
Analise, quanto à veracidade (V) ou falsidade (F), as proposições abaixo, com base na
reação química de combustão do gás hidrogênio.
( ) Ocorre liberação de calor, ou seja, o processo é exotérmico.
( ) Ocorre absorção de calor, ou seja, o processo é endotérmico.
( ) Os reagentes ganham calor ao se converter em água.
( ) O calor envolvido na formação de 180 g de água é de 2.416 kJ.
23- Uma reação química processa-se conforme o gráfico abaixo:
Qual dos processos a reação acontece mais rápido?
25 - Numa experiência de obtenção do gás hidrogênio provoca-se a reação entre zinco
metálico e solução de ácido clorídrico. A reação ocorrerá com maior velocidade em qual das
seguintes condições.
Zinco metálico
Molaridade da solução
ácida
Pó
0,50 M
Raspa
0,50 M
Lâmina
0,50 M
Pó
0,050 M
Raspa
0,050 M
25- O diagrama de energia refere-se a reação direta
A+BC+D
Determine:
a)
b)
c)
d)
e)
Esta reação é endotérmica ou exotérmica?
Qual o valor do H desta reação?
Qual o valor da energia de ativação da reação?
Qual o valor do H da reação inversa?
Qual o valor da energia de ativação da reação inversa?
26- Um visitante, ao entrar em um laboratório depara-se com dois frascos, que estão
mostrados abaixo.
HCl
0,01 mol/L
NaOH
0,1 mol/L
Deseja-se saber os valores de pH e pOH, para as soluções contidas nos dois frascos.
Frasco de HCl
Frasco
NaOH
[H+] =
[OH-] =
de
Indústria
Concentração no
efluente
X
10–3 mol/L de H+
Y
10–4 mol/L de H+
Z
10–6 mol/L de OH–
pH =
pOH =
pOH =
pH =
[OH-] =
[H+] =
27- As leis de proteção ambiental de certas cidades não permitem o lançamento em rios,
entre outros, de efluentes com pH inferior a 5 ou superior a 9. No que se refere à acidez, os
efluentes aquosos das indústrias X, Y e Z apresentam as seguintes concentrações:
(a) Com base na tabela acima, que indústria(s) poderia(m) lançar em rios seus efluentes
sem tratamento prévio? Justifique.
(b) Como você faria para tratar os efluentes que teoricamente não pode(m) ser lançado(s)?
28- Sabendo que uma solução de ácido clorídrico (HCl) é de 0,01 M, determine a
concentração de [H+] e de [OH–] nessa solução.
29- Um comprimido antiácido, que contém bicarbonato de sódio (NaHCO3), origina uma
solução em que a concentração de íons OH- é igual a 1,0 . 10-5 M, a 25ºC. Classifique esta
solução em ácida, básica ou neutra.
30- Um alvejante de roupas, do tipo “água de lavadeira”, apresenta [OH-] aproximadamente
igual a 1,0 10-4M. Nessas condições, a concentração de H+ será da ordem de: