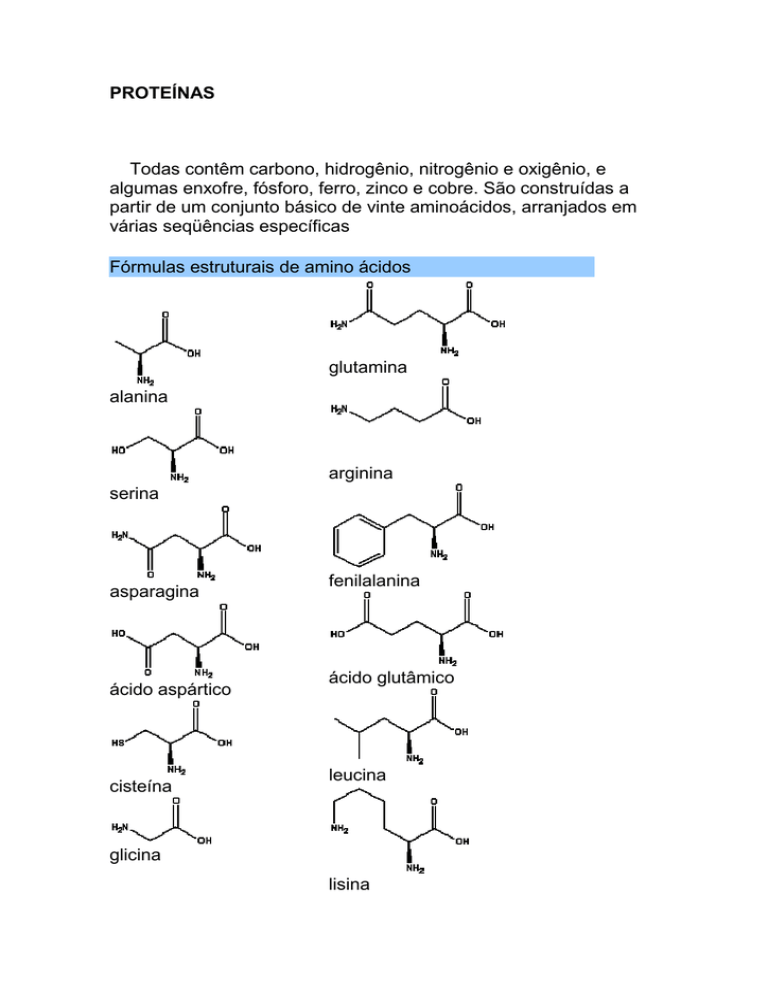
PROTEÍNAS
Todas contêm carbono, hidrogênio, nitrogênio e oxigênio, e
algumas enxofre, fósforo, ferro, zinco e cobre. São construídas a
partir de um conjunto básico de vinte aminoácidos, arranjados em
várias seqüências específicas
Fórmulas estruturais de amino ácidos
glutamina
alanina
arginina
serina
asparagina
ácido aspártico
cisteína
fenilalanina
ácido glutâmico
leucina
glicina
lisina
histidina
serina
tirosina
valina
metionina
triptofano
Ligação Peptídica:
União do grupo amino (-NH 2 ) de um aminoácido com o grupo
carboxila (-COOH) de outro aminoácido, através da formação de
uma amida.
A ligação peptídica é rígida, formada por uma ligação covalente.
Existe ressonância nas interações das cadeias, o que limita a
deformação.
FUNÇÃO DAS PROTEÍNAS
- Catalisadores (enzimas);
- Elementos estruturais (colágeno) e sistemas contráteis;
- Armazenamento (ferritina);
- Veículos de transporte (hemoglobina);
- Hormônios;
- Proteção (imunoglobulina);
- Nutricional (caseína);
- Transporte (albumina)
CLASSIFICAÇÃO DAS PROTEÍNAS
Quanto a Composição:
- Proteínas Simples - Por hidrólise liberam apenas
aminoácidos.
- Proteínas Conjugadas - Por hidrólise liberam aminoácidos
mais um radical denominado grupo prostético. Ex: metaloproteínas,
hemeproteínas, lipoproteínas, glicoproteínas, etc.
Quanto ao Número de Cadeias Polipeptídicas:
- Proteínas Monoméricas - Formadas por apenas uma
cadeia polipeptídica.
- Proteínas Oligoméricas - Formadas por mais de uma
cadeia polipeptídica; São as proteínas de estrutura e função mais
complexas.
Quanto à Forma:
- Proteínas Fibrosas - Na sua maioria, as proteínas fibrosas
são insolúveis nos solventes aquosos e possuem pesos
moleculares muito elevados. São formadas geralmente por longas
moléculas mais ou menos retilíneas e paralelas ao eixo da fibra. A
esta categoria pertencem as proteínas de estrutura, como colágeno
do tecido conjuntivo, as queratinas dos cabelos, as esclerotinas do
tegumento dos artrópodes, a conchiolina das conchas dos moluscos,
ou ainda a fribrina do soro sanguíneo ou a miosina dos músculos.
Algumas proteínas fibrosas, porém, possuem uma estrutura
diferente, como as tubulinas, que são formadas por múltiplas
subunidades globulares dispostas helicoidalmente.
- Proteínas Globulares - De estrutura espacial mais
complexa, são mais ou menos esféricas. São geralmente solúveis
nos solventes aquosos e os seus pesos moleculares situam-se
entre 10.000 e vários milhões. Nesta categoria situam-se as
proteínas ativas como os enzimas, transportadores como a
hemoglobina, etc.
Esquemas de proteínas globulares e fibrosas
Conformação/Solubilidade/Função:
Globulares - usualmente solúveis
- função móvel ou dinâmica
- ex.: hemoglobina
Fibrosas - usualmente insolúveis
- função estrutural
- ex.: queratina
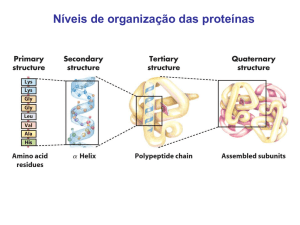
Níveis de Organização Estrutural das Proteínas
As proteínas possuem complexas estruturas espaciais, que
podem ser organizadas em quatro níveis, crescentes em
complexidade:
> estrutura primária: aminoácidos ligados entre si na cadeia
> estrutura secundária: padrão de enrolamento de secções (por
exemplo, em hélice)
> estrutura terciária: dobramento das estruturas secundárias
> estrutura quaternária: não são todas as proteínas que possuem
esse tipo de estrutura; é a interação de estruturas terciárias, ou seja,
a interação de subunidades monoméricas (um exemplo de
subunidade é uma cadeia alfa)
1 - Estrutura Primária
- Dada pela seqüência de aminoácidos e ligações
peptídicas da molécula.
- É o nível estrutural mais simples
2 - Estrutura Secundária
- É dada pelo arranjo espacial de aminoácidos próximos
entre si na seqüência primária da proteína.
- É o último nível de organização das proteínas fibrosas,
mais simples estruturalmente.
Tipos:
* Alfa-hélice: - segmentos de aminoácidos giram para a direita em
formato de hélice;
- os aminoácidos não podem permitir o enrolamento;
- exceção: colágeno (hélice para a esquerda)
É bom observar que o plano das ligações peptídicas é paralelo ao
plano do eixo, com uma média de 3,6 aminoácidos a cada volta. Os
radicais (grupos R) projetam-se para o lado de fora da hélice.
A estabilidade dessa hélice depende de: pontes de hidrogênio;
atração ou repulsão eletrostática entre os radicais; tamanho dos
grupos R adjacentes; e resíduos de prolina e hidroxiprolina (estes
geralmente colocam fim à alfa-hélice).
* Beta-conformação:
Ao contrário da alfa-hélice, a beta-conformação consiste de uma
cadeia em ziguezague, que possui uma certa flexibilidade. As
cadeias apresentação pontes de hidrogênio entre si. A cadeia de
beta-conformação é representada por uma seta.
Esse tipo de conformação costuma ter algumas alças entre uma
cadeia e outra, sendo que a prolina é muito comum nessas alças.
3 - Estrutura Terciária
- Dada pelo arranjo espacial de aminoácidos distantes entre
si na seqüência polipeptídica.
- É a forma tridimensional como a proteína se "enrola".
- Ocorre nas proteínas globulares, mais complexas
estrutural e funcionalmente.
- A estabilidade depende de:
- interações hidrofóbicas entre os grupos R apolares
- pontes de H
- pontes dissulfeto
- alfa-hélice
- beta-conformação
- interações complementares
4 - Estrutura Quaternária
- Surge apenas nas proteínas oligoméricas.
- União de 2 ou mais estruturas terciárias
Desnaturação: perda dos níveis estruturais, e se for em uma
situação drástica poderá perder até a estrutura primária.
A desnaturação de uma proteína pode ser promovida pelos
seguintes agentes:
- calor
- pH (alto e baixo)
- agentes desnaturantes (etanol / uréia / sulfato de amônio /
hidrocloreto de guanidina)