UNIVERSIDADE DA BEIRA INTERIOR
Ciências da Saúde
Estatinas e Fitoterapia em Dislipidémias:
Efeitos Secundários e Interacções Medicamentosas
Catarina Teixeira Ferreira
Dissertação para obtenção do Grau de Mestre em:
Ciências Farmacêuticas
(Ciclo de Estudos Integrado)
Orientador: Prof. Doutor Samuel Martins Silvestre
Covilhã, Outubro de 2011
Agradecimentos
Ao meu orientador, sem o seu apoio, aconselhamento e disponibilidade não seria possível a
realização deste trabalho.
A todas as pessoas que de uma forma ou de outra contribuíram para tornar este trabalho
melhor, em especial à Prof. Doutora Luíza Granadeiro, ao Dr. Carlos Tavares, à Dra. Isabel Coelho e
ao Dr. Miguel Freitas.
Aos meus pais, os meus verdadeiros heróis, que sempre estiveram presentes e nunca me
deixaram desistir.
À minha irmã, apesar de longe fisicamente, está sempre por perto.
Aos meus avós, em especial ao meu avô Mário, sei que nunca deixaram de acreditar em mim.
Ao Pedro, pela paciência, pelo apoio, pela motivação, pela força, por estar sempre ao meu
lado.
Às minhas meninas, amigas que ajudaram a construir a pessoa que sou hoje e da qual me
orgulho.
Aos colegas de curso e verdadeiros amigos, nunca esquecerei estes anos nem estas pessoas
que foram indispensáveis para mim neste percurso.
i
ii
Resumo
Introdução: As Doenças Cardiovasculares (DCV) têm cada vez mais impacto na mortalidade e
morbilidade mundiais. Sendo a dislipidémia um dos principais factores de risco para o surgimento ou
agravamento das mesmas, torna-se importante actuar na prevenção ou na implementação de uma
farmacoterapia eficaz e segura. As estatinas são o grupo de fármacos considerado como primeira
linha no que diz respeito ao tratamento farmacológico da dislipidémia, pela sua grande capacidade
de reduzir os níveis de colesterol total e colesterol LDL. Embora sejam muito eficazes, há pessoas
que não as toleram e não aderem à terapêutica, permanecendo ainda dúvidas acerca dos efeitos das
estatinas no organismo. A fitoterapia tem surgido actualmente como opção às terapias
convencionais. Apesar do interesse actual, a fitoterapia tem a desvantagem de, em muitos casos,
não haver evidência científica de eficácia e segurança dos produtos, não sendo o controlo de
qualidade assegurado pelos mesmos padrões dos fármacos obtidos por síntese química. Ao nível da
dislipidémia, várias são as plantas utilizadas na hipercolesterolémia, como é o caso do alho,
alcachofra, farelo de aveia, extracto fosfolipídico de soja, goma-de-guar, arroz fermentado
vermelho e policosanol.
Objectivo: Este estudo tem como principais objectivos avaliar a utilização das estatinas,
nomeadamente a adesão à terapêutica, a presença de efeitos secundários, interacções e limitações
e analisar o uso de fitoterápicos concomitantemente com estatinas, investigando potenciais
interacções.
Métodos: A população-alvo deste estudo é constituída por 100 utentes da farmácia comunitária que
utilizam uma estatina. A recolha de dados foi feita através de um inquérito realizado entre Março de
2011 e Maio de 2011 e a sua análise estatística foi efectuada através do software SPSS. Para testar
relações entre as variáveis utilizou-se o teste do Qui-quadrado, considerando um nível de
significância de 5% e calculando-se o Odds Ratio para medir essa associação.
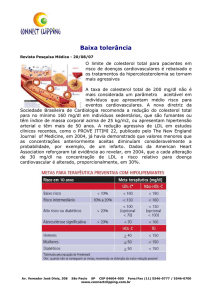
Resultados: 13% da amostra populacional não adere à terapêutica, na medida em que não cumpre a
posologia recomendada pelo médico. Dos 100 indivíduos inquiridos, 22 referiram efeitos secundários,
dos quais a dor muscular foi a mais citada, seguida pela azia, flatulência e espasmos. 7% da
população revelou recorrer aos produtos naturais e nenhuma das pessoas informou o médico dessa
utilização. Verificou-se existir uma relação entre a não adesão à terapêutica e a existência de
efeitos secundários, assim como entre a presença de efeitos secundários e a toma de fitoterápicos.
Conclusões: Conclui-se que é necessário continuar a investigar os efeitos das estatinas e o seu
potencial de interacção, não só com fármacos sintéticos ou semi-sintéticos mas também com plantas
que possam ser utilizadas na dislipidémia. É de notar que o uso concomitante de fitoterápicos e
estatinas pode dar origem a efeitos secundários. O farmacêutico pode ter um papel essencial no que
diz respeito à promoção da adesão à terapêutica e na detecção de potenciais interacções estatinafitoterápico.
Palavras-chave
Doenças Cardiovasculares, dislipidémia, estatinas, fitoterapia, efeitos secundários, interacções
medicamentosas
iii
iv
Abstract
Introduction: Cardiovascular Diseases (CD) have a great impact on mortality and morbidity
worldwide. Being one of the major risk factors for the emergence or worsening of CD, it is important
to prevent or to implement an effective and safe pharmacotherapy in the treatment of
dyslipidaemia. Statins are the first line drugs with respect to the pharmacological treatment of
dyslipidaemia, due to its great ability to reduce the levels of total cholesterol and LDL cholesterol.
Although very effective, there are people who do not tolerate statins or do not adhere to therapy,
remaining doubts about the effects of statins in the human body. The phytotherapy has emerged as
an option to conventional therapies. Despite the current interest, phytotherapy has the
disadvantage that in many cases, there is no scientific evidence of efficacy and safety of products,
the quality control is not ensured by the same standards of drugs obtained by chemical synthesis.
There are several plants used in hypercholesterolaemia, such as garlic, artichoke, oat bran, soybean
phospholipid extract, guar gum, red yeast rice and policosanol.
Goal: These study´s main goals are to evaluate the use of statins, including adherence to therapy,
the presence of side effects, interactions and analyze the use of phytotherapy concomitantly with
statins, investigating potencial interactions.
Methods: The target population for this study consists of 100 users of community pharmacies that
were taking a statin. Data collection was done through a survey conducted between March 2011 and
May 2011, the statistical analysis was performed using the SPSS program. To test relationships
between variables we used the Chi-square test, considering a significance level of 5% and calculating
the Odds Ratio to measure the associations.
Results: 13% of the sample population does not adhere to therapy, as people does not follow the
correct posology. Of the 100 individuals surveyed, 22 reported side effects, muscle pain was the
most cited, followed by heartburn, bloating and cramping. 7% of the population revealed the use of
natural products and none of them informed the doctor of such use. There was found a relationship
between the non-compliance and the presence of side effects, as well as between the presence of
side effects and the use of natural products.
Conclusions: It was concluded that it is necessary to further investigate the effects of statins and
potential for interactions, not only with synthetic or semi-synthetic drugs but also with plants
possibly used in dyslipidaemia. It is interesting to note that the concomitant use of herbal medicines
and statins may lead to side effects. The pharmacist has an essential role with regard to the
promotion of adherence to therapy and in detecting possible drug-herbal interactions.
Keywords
Cardiovascular Diseases, dyslipidaemia, statins, phytotherapy, side effects, drug interactions
v
vi
Índice
Agradecimentos
i
Resumo
iii
Abstract
v
Índice
vii
Lista de Figuras
x
Lista de Tabelas
xii
Lista de Acrónimos
xiv
1. Introdução
1
1.1. Doenças Cardiovasculares
1
1.1.1. O que são DCV
1
1.1.2. Epidemiologia das DCV
1
1.1.3. Factores de risco cardiovascular
2
1.2. Dislipidémia
4
1.2.1. Definição e relevância
4
1.2.2. Biossíntese e função do colesterol no organismo humano
4
1.2.3. Lipoproteínas: estrutura e classificação
5
1.2.4. Classificação das dislipidémias
7
1.2.5. Avaliação laboratorial e valores recomendados para o perfil lipídico
8
1.3. Tratamento Antidislipidémico
10
1.3.1. Tratamento não farmacológico
10
1.3.2. Tratamento farmacológico
11
1.3.2.1.
Inibidores da HMG-CoA redutase: estatinas
11
1.3.2.1.1.
Mecanismo de acção
12
1.3.2.1.2.
Efeitos adversos
13
1.3.2.1.3.
Interacções medicamentosas
14
1.3.2.2.
FIbratos
16
1.3.2.3.
Ezetimibe
17
1.3.2.4.
Niacina
17
1.3.2.5.
Resinas permutadoras de iões
18
1.4. Fitoterapia
19
1.4.1. Definição e evolução da fitoterapia
19
1.4.2. Controlo de qualidade e validação dos produtos fitoterápicos
20
1.4.3. Entidades reguladoras
20
1.4.4. Plantas com acção a nível da aterosclerose
21
1.4.4.1.
Alho
22
vii
1.4.4.2.
Extracto fosfolipídico de soja
24
1.4.4.3.
Farelo de aveia
25
1.4.4.4.
Goma-de-guar
25
1.4.4.5.
Arroz fermentado vermelho (Red yeast rice)
26
1.4.4.6.
Alcachofra
27
1.4.4.7.
Policosanol
27
2. Objectivos
30
3. Material e Métodos
32
3.1. Tipo de estudo e selecção da população a estudar
32
3.2. Recolha de dados
32
3.3. Análise dos dados
33
4. Resultados
35
4.1. Análise estatística descritiva
35
4.2. Análise estatística inferencial
43
5. Discussão
48
6. Conclusão
55
7. Bibliografia
57
8. Anexos
69
8.1. Anexo I - Inquérito
69
viii
ix
Lista de Figuras
Figura 1: Síntese endógena do colesterol.
5
Figura 2: Representação de uma lipoproteína.
6
Figura 3: Principais constituintes activos do alho.
22
Figura 4: Esquema representativo da metabolização das aliinas pela aliinase.
23
Figura 5: Esquema que representa a amostra populacional utilizada no presente estudo.
32
Figura 6: Distribuição da amostra populacional relativamente ao sexo.
35
Figura 7: Distribuição de idades na amostra populacional.
36
Figura 8: Distribuição das patologias existentes na amostra, concomitantemente
com a dislipidémia.
36
Figura 9: Representação do número de fármacos utilizado pela amostra populacional,
para além da estatina.
37
Figura 10: Representação da utilização de estatinas na amostra populacional.
38
Figura 11: Representação da utilização de estatinas no Grupo I.
38
Figura 12: Representação da utilização de estatinas no Grupo II.
39
Figura 13: Percentagem de indivíduos que cumprem ou não a posologia prescrita pelo
médico para a estatina.
39
Figura 14: Percentagem de indivíduos que mencionam efeitos secundários após
a toma da estatina.
40
Figura 15: Percentagem de indivíduos que referem efeitos secundários no Grupo I e no Grupo II.
40
Figura 16: Distribuição dos efeitos secundários mencionados pela amostra populacional.
41
x
xi
Lista de Tabelas
Tabela 1: Factores de risco cardiovascular não lipídicos modificáveis e não modificáveis.
3
Tabela 2: Classificação das dislipidémias primárias.
7
Tabela 3: Valores recomendados para o perfil lipídico.
9
Tabela 4: Características farmacocinéticas das várias estatinas.
12
Tabela 5: Possíveis interacções de cada estatina com fármacos co-administrados.
16
Tabela 6: Fármacos mais utilizados pela população amostral para além da estatina.
37
Tabela 7: Número de fármacos utilizados para além da estatina pelos indivíduos que
referiram efeitos secundários.
41
Tabela 8: Número de indivíduos que tomam fitoterápicos e os respectivos produtos utilizados.
42
Tabela 9: Número de indivíduos que referem efeitos secundários vs estatina que utilizam e
respectivo teste do Qui-quadrado.
43
Tabela 10: Número de indivíduos que referem efeitos secundários vs adesão ou não à terapêutica
e respectivo teste do Qui-quadrado.
44
Tabela 11: Número de indivíduos que referem efeitos secundários vs utilização ou não de fitoterapia
e respectivo teste do Qui-quadrado.
45
Tabela 12: Valores de p obtidos no Teste do Qui-quadrado realizado para as respectivas
variáveis independentes e dependentes.
46
xii
xiii
Lista de Acrónimos
Acetil-CoA
Acetil-coezima A
AIT
Acidente isquémico transitório
AVC
Acidente vascular cerebral
CEFAR
Centro de Estudos e Avaliação em Saúde
CPK
Creatinafosfocinase
CT
Colesterol total
DCV
Doenças Cardiovasculares
EMEA
Agência Europeia de Validação do Medicamento
HDL
Lipoproteína de elevada densidade
HMG-CoA
3-hidroxi-3-metil-glutaril-coenzima A
INFARMED
Instituto Nacional da Farmácia e do Medicamento
INR
Índice internacional normalizado
IPP
Pirofosfato de isopentenilo
LDL
Lipoproteína de baixa densidade
LRC
Lipid research clinics
MRFIT
Multiple risk factor intervention trial
PAI-1
Inibidor do activador do plasminogénio
PCR
Proteína-C reactiva
SPSS
Statistical Package for the Social Sciences
TG
Triglicéridos
VLDL
Lipoproteína de muito baixa densidade
xiv
xv
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1. Introdução
1.1.
Doenças Cardiovasculares (DCV)
1.1.1. O que são DCV
As DCV englobam um conjunto de desordens que afectam o sistema cardiovascular,
nomeadamente o coração e os vasos sanguíneos (World Health Organization, 2011; Mayo Clinic,
2011). Estas incluem:
● Doença Cerebrovascular: doença das artérias que irrigam o cérebro, tal como o AIT
(perda temporária de irrigação de uma parte do cérebro), AVC hemorrágico (se houve
ruptura da parede de um vaso sanguíneo debilitada por aterosclerose) ou AVC isquémico
(oclusão permanente de uma artéria ou várias devido a trombo ou êmbolo, que leva a
perda da integridade do tecido cerebral).
● Doença Coronária Cardíaca: afecta as artérias coronárias que irrigam o músculo
cardíaco - miocárdio, o fluxo sanguíneo que chega ao miocárdio é diminuído ou mesmo
impossibilitado.
● Doença Reumática: lesões no músculo cardíaco e válvulas cardíacas devido a febre
reumática.
● Doença Vascular Periférica: afecta artérias que irrigam outros órgãos que não o coração
e cérebro, sendo as artérias que irrigam os membros inferiores e a artéria aorta as mais
afectadas. Ocorre porque há oclusão ou diminuição do lúmen das artérias.
● Doença Cardíaca Congénita: má-formação da estrutura cardíaca existente após o
nascimento.
● Trombose Venosa Profunda e Embolismo Pulmonar: formação de um coágulo sanguíneo
nas veias das pernas, o qual se pode deslocar para o coração ou pulmões.
1.1.2. Epidemiologia das DCV
De acordo com a Direcção Geral de Saúde, 40% das mortes em Portugal são causadas por
DCV (Portal da Saúde, 2009). Para além disso, as DCV são uma importante causa de incapacidade,
o que representa custos muito elevados para o Estado.
1
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
As DCV são a primeira causa de morte, doença, incapacidade e custos em saúde em
Portugal (Portal da Saúde, 2009). As estatísticas de DCV do ano 2008 da European Heart Network,
informam que 48% das mortes ocorridas na Europa devem-se a DCV, matando por ano 4,3 milhões
de pessoas na Europa. Dentro das DCV, a Doença Coronária Cardíaca é a responsável por mais
mortes por ano (1,92 milhões de mortes), seguida pelo AVC (1,24 milhões de mortes) (European
Heart Network, 2008).
A Organização Mundial de Saúde atribui às DCV a principal causa de morte mundial e
prevê que em 2030, aproximadamente 23,6 milhões de pessoas morrerão devido a DCV,
continuando a ser a principal causa de morte no Mundo (World Health Organization, 2011).
1.1.3. Factores de risco cardiovascular
Um factor de risco define-se como uma condição ambiental, uma característica ou um
comportamento que aumenta a probabilidade da ocorrência de uma determinada doença. Sendo
um dos temas centrais deste trabalho, pode-se dizer que a dislipidémia é um dos principais
factores de risco para as DCV. Considera-se que é o colesterol LDL que mais contribui para esta
condição, tornando-se, por isso, como o primeiro alvo da terapêutica antidislipidémica (Third
report of the expert panel on detection, evaluation and treatment of high blood cholesterol in
adults, 2002).
Vários estudos têm confirmado a relação directa entre um maior risco de ocorrência de
DCV em ambos os sexos e o colesterol LDL, como é o exemplo do Framingham Heart Study
(WILSON et al, 1998), do estudo MRFIT - Multiple Risk Factor Intervention Trial (STAMLER et al,
1986) e do estudo LRC - Lipid Research Clinics (Lipid Research Clinics Program, 1984). Para além
disso, há evidência de que populações com níveis mais elevados de colesterol têm maior
propensão a desenvolver aterosclerose e DCV do que populações com níveis inferiores (McGILL,
1986; KEYS et al, 1984).
Os níveis de triglicéridos, de colesterol não-HDL e de colesterol HDL e a dislipidémia
aterogénica (caracterizada por três alterações nos níveis lipídicos: aumento dos triglicéridos, de
partículas LDL de pequena dimensão e diminuição do colesterol HDL) fazem ainda parte dos
factores de risco lipídicos (Third report of the expert panel on detection, evaluation and
treatment of high blood cholesterol in adults, 2002). No entanto, existem outros factores de
risco, que se podem dividir em factores de risco modificáveis e factores de risco não modificáveis
(Tabela 1).
2
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 1: Factores de risco cardiovascular não lipídicos modificáveis e não modificáveis.
Factores de risco modificáveis
Hipertensão (STAESSEN et al, 1997; FRANKLIN et
Factores de risco não modificáveis
Idade (WILSON et al, 1998)
al, 1999; VAN DEN HOOGEN et al, 2000)
Sexo Masculino (WILSON et al, 1998)
Tabagismo (PYORALA et al, 1994; McBRIDE, 1992)
História familiar de DCV precoce (LI et al,
Diabetes (WINGARD et al, 1995; BIERMAN, 1992)
2000; WILLIAMS et al, 2001)
Obesidade (CALLE et al, 1999)
Inactividade Física (FLETCHER et al, 1996)
Dieta Aterogénica (KRAUSS et al, 2000)
Uma dieta pouco saudável, o tabagismo e a falta de exercício físico são responsáveis por
80% das doenças coronárias cardíacas e das doenças cerebrovasculares (World Health
Organization, 2011). Relativamente à idade, o maior risco reside nos homens com idade superior
ou igual a 45 anos e em mulheres com idade superior ou igual a 55 anos. No caso da história
familiar, é particularmente importante a ocorrência de morte súbita antes dos 55 anos no pai ou
antes dos 65 anos na mãe (DIPIRO et al, 2008).
Para além destes factores de risco principais têm surgido outros determinantes que se
julga estarem relacionados com o risco cardiovascular, principalmente como factores preditivos,
cuja determinação é feita laboratorialmente. É o caso da lipoproteína (a), do fibrinogénio, do
PAI-1 (inibidor do activador do plasminogénio), da homocisteína e de marcadores da inflamação,
como por exemplo, a proteína C-reactiva (JALLINGER et al, 2002).
3
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.2.
Dislipidémia
1.2.1. Definição e relevância
A dislipidémia define-se como uma elevação do colesterol total, uma elevação do
colesterol LDL ou uma elevação dos triglicéridos, ou ainda como uma diminuição do colesterol
HDL (DIPIRO et al, 2008). A dislipidémia está associada ao aparecimento da aterosclerose, que,
por sua vez, é a acumulação de gordura nas paredes das artérias, podendo ocorrer obstrução
total ou parcial do fluxo sanguíneo e, consequentemente, levar ao desenvolvimento de Doença
Cardiovascular (SILVA et al, 2009; TYROLER, 2000).
Nos países desenvolvidos, 60% dos casos de Doença Coronária Cardíaca e 40% dos casos de
AVC isquémico são resultado de níveis de colesterol elevado. O aumento dos níveis de colesterol
sérico é responsável por 8% de todas as doenças (The World Health Report, 2002).
1.2.2. Biossíntese e função do colesterol
O colesterol é uma substância lipídica essencial para a formação das membranas
celulares, para a síntese de hormonas esteróides e que actua como precursor dos ácidos biliares.
O colesterol pode ser produzido no organismo pela via endógena ou pode ser obtido pela absorção
das fontes de colesterol presentes na dieta, denominada via exógena (DIPIRO et al, 2008).
A síntese endógena de colesterol envolve várias reacções enzimáticas e é realizada no
fígado e intestino delgado. Na síntese endógena de colesterol existem vários passos fundamentais
(Figura 1):
Conversão de acetil-CoA em 3-hidroxi-3-metil-glutaril-CoA (HMG-CoA)
Conversão de HMG-CoA em mevalonato
Conversão de mevalonato em pirofosfato de isopentenilo (IPP)
Conversão de IPP em esqualeno
Conversão de esqualeno em colesterol
4
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Figura 1: Síntese endógena do colesterol. (Fonte: KING, 2010)
1.2.3. Lipoproteínas: estrutura e classificação
Os principais lípidos que existem no organismo humano são o colesterol, os triglicéridos e
os fosfolípidos. Estes são transportados no plasma em complexos conhecidos como lipoproteínas,
que não são solúveis em meio aquoso. As lipoproteínas são partículas esféricas cuja superfície é
constituída maioritariamente por fosfolípidos, colesterol livre e proteínas e o seu interior é
composto por triglicéridos e ésteres de colesterol (Figura 2).
5
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Figura 2: Representação de uma lipoproteína. (Fonte: PEPROTECH, 2005)
As lipoproteínas são classificadas de acordo com a sua composição, densidade, tamanho e
mobilidade electroforética em quatro classes: quilomícrons, VLDL, LDL e HDL.
Os quilomícrons são lipoproteínas ricas em triglicéridos, são uma fonte de triglicéridos
para o músculo-esquelético e para o tecido adiposo. Estas lipoproteínas são formadas a partir da
gordura proveniente da dieta, solubilizada pelos sais biliares no intestino delgado. Os
quilomícrons são metabolizados pela lipoproteína lipase, pelo que após 12 a 14 horas de jejum
não estão presentes no plasma.
A VLDL é sintetizada no fígado e depois convertida em LDL. A sua síntese é regulada pela dieta,
por hormonas e pela captação de quilomícrons remanescentes no fígado.
Num indivíduo saudável, a maioria do colesterol é transportado pela LDL. Esta é captada pelo
fígado para ser metabolizada. Após a ligação da LDL ao seu receptor membranar, a LDL é
internalizada e degradada. O catabolismo da LDL vai inibir a actividade da HMG-CoA redutase,
enzima indispensável à síntese endógena de colesterol.
O transporte reverso do colesterol é feito pela HDL, ou seja, a HDL capta o colesterol e
transformam-no em VLDL ou LDL ou transporta-o até ao fígado para a síntese de ácidos biliares
(DIPIRO et al, 2008).
É importante referir a preponderância que as lipoproteínas têm na aterosclerose, visto
esta iniciar-se com a retenção do colesterol LDL na parede das artérias. Uma vez na parede
arterial, o colesterol LDL é oxidado o que leva à recruta de monócitos para a artéria. Os
monócitos transformam-se em macrófagos que vão acelerar o processo de oxidação do colesterol
LDL e alterar a captação do mesmo pelos seus receptores. A oxidação do colesterol LDL
6
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
desencadeia uma resposta inflamatória, leva ao aumento da coagulação devido ao aumento dos
níveis de plasminogénio, induz a produção de endotelina que causa vasoconstrição e inibe a
síntese de óxido nítrico (vasodilatador e inibidor plaquetar) (SILVA, 2006).
1.2.4. Classificação das dislipidémias
As dislipidémias podem ser primárias ou secundárias. As desordens primárias dizem
respeito às alterações genéticas e podem ser classificadas em seis tipos - Tabela 2 (JALLINGER et
al, 2002).
Tabela 2: Classificação das dislipidémias primárias.
CLASSIFICAÇÃO DE FREDRICKSON
Tipo
Lipoproteínas elevadas
I
Quilomícrons
IIa
LDL
IIb
LDL e VLDL
III
IDL
IV
VLDL
V
Quilomícrons e VLDL
A dislipidémia secundária pode ter origem noutra situação patológica, como o
hipotiroidismo, obesidade ou Diabetes mellitus, ou ser uma consequência da utilização de
determinados fármacos que elevem os níveis lipídicos, como por exemplo, glucocorticóides,
isotretinoína, ciclosporina, mirtazapina, progestinas, diuréticos tiazidícos, bloqueadores β,
estrogénios e antifúngicos azólicos (DIPIRO et al, 2008). O primeiro passo na terapêutica de uma
dislipidémia secundária é obviamente, tratar a causa subjacente, caso se trate de uma patologia
ou ajustar doses ou fazer substituições no caso de fármacos.
7
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.2.5. Avaliação laboratorial e valores recomendados para o perfil
lipídico
A avaliação do perfil lipídico deve incluir o doseamento do colesterol HDL e dos
triglicéridos, após um jejum de 12 horas. Com os valores obtidos para estes parâmetros, é
possível calcular o valor do colesterol LDL através da fórmula de Friedewald:
LDL CT (VLDL HDL)
Como,
VLDL
TG
5
Normalmente utiliza-se a seguinte fórmula:
LDL CT HDL
TG
5
As unidades são em mg/dL, esta fórmula não é aplicável se houver uma dislipidémia de tipo III ou
se os triglicéridos forem superiores a 400 mg/dL (SILVA et al, 2009).
Todos os adultos com mais de 20 anos devem ser aconselhados a fazer uma avaliação do
perfil lipídico. No entanto, é aconselhável uma determinação por volta dos 10 anos no caso de
indivíduos obesos, nos indivíduos com dislipidémia primária (causa genética) ou com história
familiar de aterosclerose precoce (no caso de mulheres com idade inferior a 65 anos e nos
homens com idade superior a 55 anos). Se houver alteração dos níveis normais lipídicos, a
determinação do perfil lipídico deve ser repetida dentro de 1 ou 3 anos, quando não for
necessário monitorizar intervenções terapêuticas. Relativamente a um perfil lipídico com valores
dentro dos limites tidos como referência a determinação do perfil lipídico deve ser repetida de 5
em 5 anos (DIPIRO et al, 2008; SILVA et al, 2009). Na tabela 3 estão os valores recomendados para
o colesterol total, LDL, HDL e triglicéridos (Third report of the expert panel on detection,
evaluation and treatment of high blood cholesterol in adults, 2002).
8
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 3: Valores recomendados para o perfil lipídico.
Colesterol Total
(mg/dL)
• Desejável: <200
• Ligeiramente elevado: 200-239
• Elevado: ≥240
Colesterol LDL
(mg/dL)
• Óptimo: <100
• Próximo do óptimo: 100-129
• Ligeiramente elevado: 130-159
• Elevado: 160-189
• Muito elevado: ≥190
Colesterol HDL
(mg/dL)
• Baixo: <40
• Elevado: ≥60
Triglicéridos
(mg/dL)
• Normal: <150
• Ligeiramente elevado: 150-199
• Elevado: 200-499
• Muito elevado: ≥500
9
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.3.
Tratamento antidislipidémico
1.3.1. Tratamento não farmacológico
O tratamento não farmacológico de uma dislipidémia baseia-se na modificação do estilo
de vida, actuando a vários níveis. Sendo a dislipidémia uma situação que se pode despoletar ou
agravar associada a factores de risco cardiovascular modificáveis, a intervenção que se pode
fazer a este nível tem uma grande influência na prevenção do desenvolvimento de Doenças
Cardiovasculares.
É importante uma consciencialização das pessoas sobre a relevância da alimentação na sua saúde
e sobre a adopção de uma alimentação saudável, equilibrada e variada. Nomeadamente, deve ser
reduzida a ingestão de gorduras, principalmente saturadas, de sal, de álcool e de açúcares de
absorção rápida (World Health Organization, 2011; JALLINGER et al, 2002; Fundação Portuguesa
de Cardiologia, 2011). Deve ser aumentada a ingestão de frutas, vegetais, legumes e cereais
(World Health Organization, 2011).
Para além da alimentação, tem que se ter em conta a importância da perda de peso (caso
seja em excesso) e do aumento de actividade física. No caso da actividade física deve ser
encorajada uma actividade de intensidade moderada durante 30 minutos, se possível todos os
dias (Fundação Portuguesa de Cardiologia, 2011).
Adicionalmente, devem ser controlados regularmente os níveis de pressão arterial, glicémia,
colesterol total e colesterol LDL. Relativamente ao tabagismo, deve ser aconselhado um
programa de cessação tabágica. O tabagismo está relacionado com aproximadamente 50% das
causas de morte evitáveis, tornando-se o factor de risco mais importante na União Europeia
(World Health Organization, 2011).
O farmacêutico tem um papel fulcral neste âmbito, pois pode salientar e relevar a importância
destas modificações de estilo de vida. Pela relativa disponibilidade e acessibilidade que
apresenta, o farmacêutico é facilmente deparado com situações nas quais pode fomentar uma
alimentação saudável, prática de exercício físico e cessação tabágica, pontos-chave na prevenção
de DCV.
10
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.3.2. Tratamento farmacológico
A escolha de um fármaco antidislipidémico deve ter em conta alguns critérios e ser
fundamentada. É necessário analisar o tipo de dislipidémia que está em causa, o fármaco que
melhor se adapta de acordo com a sua acção sobre os lípidos e lipoproteínas plasmáticas, o perfil
de segurança e efeitos adversos do fármaco, a sua via de administração, a sua eficácia
relativamente aos efeitos na morbilidade e mortalidade e as possíveis interacções com fármacos
utilizados concomitantemente ou até com alimentos (SILVA et al, 2009).
Apesar das medidas não farmacológicas aconselhadas, nem sempre se consegue uma
redução significativa das concentrações de colesterol, pelo que frequentemente é recomendável
o recurso a fármacos. Caso existam dislipidémias mistas ou situações complicadas podem ser
usadas combinações de fármacos, havendo vantagem no sentido em que os mecanismos de acção
dos vários fármacos são aditivos pois actuam em etapas diferentes da biossíntese, absorção e
metabolismo do colesterol (LIPSY et al, 2003).
1.3.2.1. Inibidores da HMG-CoA redutase: estatinas
As estatinas são um grupo de fármacos dotados de grande interesse no tratamento das
dislipidémias, sendo o grupo farmacológico antidislipidémico com maior evidência científica
relativamente à eficácia.
Quando usadas em monoterapia, as estatinas são os fármacos mais potentes em relação a outros
agentes antidislipidémicos, no que respeita à diminuição do colesterol total e LDL. Para além
disso, vários estudos defendem que são os fármacos antidislipidémicos mais bem tolerados e mais
custo-efectivos em doentes com doença coronária ou com múltiplos factores de risco (DAVIDSON
et al, 2007).
As estatinas, na maior parte dos casos, são seguras, eficazes e bem toleradas,
principalmente em baixas doses (LIPSY et al, 2003). Vários estudos têm demonstrado
indubitavelmente que as estatinas são eficazes na diminuição de eventos cardiovasculares, tais
como enfarte do miocárdio e mesmo na mortalidade total (Scandinavian simvastatin survival
study group, 1994; West of Scotland coronary prevention study group, 1998; DOWNS et al, 1998;
SACKS et al, 1998).
A prescrição de estatinas vai muito para além do tratamento da dislipidémia isoladamente, pois
verifica-se que a sua prescrição a indivíduos com um risco cardiovascular global elevado,
11
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
independentemente dos valores de colesterol, resulta na prevenção de mais eventos vasculares
do que tratar só os indivíduos com colesterol elevado (SILVA et al, 2009).
As estatinas actualmente disponíveis em Portugal são a sinvastatina, a atorvastatina, a
rosuvastatina, a lovastatina, a fluvastatina e pravastatina (Prontuário Terapêutico, 2010). As
estatinas diferem entre si, como por exemplo, nas características farmacocinéticas - Tabela 4
(DIPIRO et al, 2008).
Tabela 4: Características farmacocinéticas das várias estatinas (DIPIRO et al, 2008).
Parâmetro
Lovastatina
Sinvastatina
Pravastatina
Fluvastatina
Atorvastatina
Rosuvastatina
Isoenzima
3A4
3A4
Nenhuma
2C9
3A4
2C9/2C19
Sim
Sim
Não
Sim
Sim
Não
> 95
95-98
50
>90
96
88
Sim
Sim
Não
Não
Sim
Sim
3
2
1,8
1,2
7-14
13-20
Metabolizadora
Lipofilicidade
Ligação às proteínas
plasmáticas (%)
Metabolitos activos
Semi-vida de
eliminação (horas)
1.3.2.1.1.
Mecanismo de acção
As estatinas pertencem ao grupo de fármacos com acção no aparelho cardiovascular e são
classificados como antidislipidémicos e actuam pela inibição da HMG-CoA redutase, uma enzima
essencial na síntese endógena do colesterol, interrompendo a conversão da HMG-CoA a
mevalonato, que é o passo limitante da biossíntese de colesterol (Figura 1). Ao interromper a sua
síntese, as estatinas diminuem a produção de colesterol hepático, o que resulta num aumento de
receptores LDL. Os receptores LDL são proteínas que medeiam a endocitose do colesterol LDL e
existem em maior quantidade nas células hepáticas. O aumento de receptores leva a uma maior
12
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
captação de colesterol LDL pelo fígado e consequentemente, à diminuição da sua concentração
(Third report of the expert panel on detection, evaluation and treatment of high blood
cholesterol in adults, 2002).
As estatinas têm acção principalmente sobre os níveis plasmáticos de colesterol total e o
colesterol LDL, os quais diminui, ocorrendo também uma ligeira diminuição dos níveis de
triglicéridos e um aumento de HDL. De uma forma dependente da dose, as estatinas diminuem
em 18 a 55% a concentração de colesterol LDL, 7 a 30% a concentração de triglicéridos e
aumentam em 5 a 15% a concentração de colesterol HDL (Third report of the expert panel on
detection, evaluation and treatment of high blood cholesterol in adults, 2002; LIPSY et al, 2003).
1.3.2.1.2.
Efeitos adversos
Os efeitos secundários são frequentes durante o tratamento com estatinas, podendo levar
à descontinuação das mesmas (VANDERBERG et al, 2010).
Os efeitos adversos mais frequentes são dores abdominais, náuseas, obstipação, anorexia,
flatulência, dispepsia e sintomas musculares (Prontuário Terapêutico, 2010). As estatinas podem
ainda provocar eritema multiforme, perturbações psíquicas e aumento dos valores das
transaminases (Prontuário Terapêutico, 2010). A obstipação ocorre em menos de 10% dos doentes
que utilizam estatinas (DIPIRO et al, 2008). A elevação das transaminases hepáticas ocorre em 1 a
1,3% dos doentes que usem doses moderadas a elevadas de estatinas (DIPIRO et al, 2008).
A American Heart Association definiu quatro tipos de danos musculares causados pelas
estatinas: a miopatia, como sendo qualquer tipo de desconforto muscular; a mialgia, no caso de
haver dor muscular sem elevação da enzima creatinafosfocinase (CPK); a miosite, quando os
sintomas musculares se associam a um aumento da CPK e a rabdomiólise, quando há uma
marcante elevação da CPK (normalmente 10 vezes superior ao considerado normal) associada a
um aumento da creatinina sérica, mioglobinúria e insuficiência renal aguda (MAGALHÃES, 2005).
A CPK é uma enzima que serve de marcador bioquímico para identificar danos musculares e,
neste contexto, o seu aumento está normalmente associado à administração concomitante de
estatinas com certos fármacos inibidores do citocromo P450, tais como eritromicina, ciclosporina,
gemfibrozil (e outros fibratos), ácido nicotínico, anti-retrovirais e antifúngicos azólicos. Apenas
se recomenda suspender o tratamento com estatinas se a elevação de CPK for cinco vezes
superior ao nível normal (ECKEL, 2010).
13
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Cerca de 1 a 3% dos pacientes em tratamento com estatinas apresenta sintomas
musculares relacionados com estes fármacos (VANDERBERG et al, 2010). A miopatia ocorre em
0,01 a 0,1% da população que utiliza estatinas e a rabdomiólise ocorre em 0,002% (VANDERBERG
et al, 2010; MARON et al, 2000). A rabdomiólise, apesar de ser pouco frequente, é o efeito
adverso mais grave que o uso de estatinas pode despoletar. As mialgias são o efeito secundário
mais frequentemente referido com o uso das estatinas. Vários estudos demonstraram um risco
baixo de ocorrência de miopatia durante a utilização de estatinas (McKENNY et al, 2006).
Há determinadas condições que aumentam a susceptibilidade aos efeitos secundários das
estatinas, como é o caso da disfunção hepática, insuficiência renal, hipotiroidismo, infecção ou
idade avançada (MARON et al, 2000).
Os efeitos secundários das estatinas têm sido estudados, tendo sido propostas várias
hipóteses de mecanismos para a ocorrência dos mesmos. Entre elas estão o bloqueio da síntese
de ubiquinona, da coenzima Q-10 e de isoprenóides (estes metabolitos são provenientes da via da
HMG-CoA redutase e são necessários ao normal funcionamento do miócito esquelético) ou a
alteração das vias de sinalização que aumentam a susceptibilidade da fibra muscular ao stress
mecânico (VANDERBERG et al, 2010).
Apesar de todos os estudos feitos sobre os possíveis efeitos secundários das estatinas e
mesmo alguns referindo que as estatinas são bem toleradas, ainda permanecem muitas dúvidas e
existem doentes que não aderem à terapêutica devido aos efeitos que experienciam após a sua
toma.
1.3.2.1.3.
Interacções medicamentosas
Relativamente às interacções entre estatinas e fármacos co-administrados é preciso ter
em conta as características farmacocinéticas dos mesmos, nomeadamente as enzimas
metabolizadoras.
Como já foi referido, é necessário não esquecer que no caso da lovastatina, da sinvastatina e da
atorvastatina o metabolismo fica a cargo do CYP-3A4. A fluvastatina é metabolizada pelo CYP-2C9
e a rosuvastatina é metabolizada pelo CYP-2C9 e CYP-2C19. É de salientar que a pravastatina não
sofre metabolismo por nenhuma das isoenzimas do citocromo P450, isso vai corroborar o facto de
o número de interacções da pravastatina com outros fármacos ser significativamente inferior ao
das restantes estatinas (VANDERBERG et al, 2010; MARON et al, 2000).
14
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Ao administrar concomitantemente fármacos inibidores do CYP-3A4, como é o caso do
itraconazol e ritonavir, as concentrações plasmáticas das estatinas metabolizadas por este
citocromo aumentam, aumentando consequentemente o risco de miotoxicidade e outros efeitos
secundários. Com a administração de rifampina, um potente indutor do CYP 3A4, a concentração
sérica da estatina é inferior à necessária para o fármaco ser eficaz, pois é
degradado mais
rapidamente (NEUVONEN et al, 2006).
Outro tipo de interacções a ter em conta são aquelas mediadas por transportes
membranares. No caso da interacção estatina-gemfibrozil, há uma inibição da proteína
transportadora que medeia a passagem da estatina para o fígado. A não passagem da estatina
para o fígado não permite a sua degradação, pelo que permanece durante mais tempo no
organismo e como tal, pode originar efeitos secundários que normalmente não ocorreriam
(SHITARA et al, 2004).
A ciclosporina é um fármaco inibidor de determinadas proteínas membranares
transportadoras e também do CYP3A4, pelo que a sua utilização em simultâneo com estatinas
poderá aumentar consideravelmente as concentrações séricas destas (ASBERG, 2003). Com este
aumento na concentração, é compreensível que se tenham verificado vários casos de
rabdomiólise durante o uso concomitante de estatinas e ciclosporina, excepto com a fluvastatina
que é a menos afectada pela ciclosporina (BALLANTYNE et al, 2003). Apesar das possíveis
interacções, o uso de ciclosporina ao mesmo tempo que uma estatina é praticável, mas com a
adequada monitorização dos doentes.
Adicionalmente, pode haver aumento das transaminases e de CPK com a administração
concomitante de estatinas com ciclosporina, ácido nicotínico, eritromicina, gemfibrozil (e outros
fibratos) e antifúngicos azólicos. As estatinas podem também potenciar o efeito da varfarina,
sendo aconselhável um maior controlo do INR no início ou fim do tratamento (Prontuário
Terapêutico, 2010). Os fibratos e a niacina aumentam o risco de miopatia causada por estatinas
através de mecanismos não relacionados com o aumento da concentração sérica de estatinas
(MARON et al, 2000).
Como as estatinas seguem farmacocinéticas diferentes, também há interacções
diferenciadas para cada uma ou várias delas (Tabela 5).
15
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 5: Possíveis interacções de cada estatina com fármacos co-administrados (Prontuário Terapêutico,
2010).
ESTATINA
INTERACÇÕES
Lovastatina
A eritromicina aumenta as concentrações da atorvastatina e os antiácidos reduzem-na. A
Atorvastatina
Sinvastatina
atorvastatina pode aumentar as concentrações séricas de digoxina. Evitar o uso concomitante
com anti-retrovirais. Deve ser tida em conta a interacção com a ciclosporina, eritromicina,
claritromicina, nefazondona, antifúngicos azóis, inibidores das proteases ou mibefradil. Também
estão descritas interacções entre a sinvastatina e a amiodarona.
Fluvastatina
A rifampicina administrada concomitantemente reduz as concentrações plasmáticas de
fluvastatina; a cimetidina, a ranitidina e o omeprazol aumentam-nas.
Pravastatina
A pravastatina não é significativamente metabolizada através das isoenzimas do citocromo P450,
tal facto minora as interacções com os inibidores ou indutores do citocromo P450.
A administração concomitante de eritromicina pode provocar redução das concentrações séricas
Rosuvastatina
de rosuvastatina. O hidróxido de alumínio e o hidróxido de magnésio reduzem em cerca de 50%
as concentrações séricas desta estatina, quando usados concomitantemente. Com a ciclosporina
pode observar-se um aumento significativo das concentrações desta estatina.
1.3.2.2. Fibratos
Este grupo de fármacos leva ao estímulo da lipoproteína lipase, ao aumento da clearance
e à diminuição da síntese de colesterol VLDL, o que reduz a quantidade de colesterol VLDL
circulante e aumenta a captação de LDL (DIPIRO et al, 2008).
16
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Os fibratos são o tipo de fármacos mais usado para tratar a hipertrigliceridémia e a
hipocolesterolémia HDL (as concentrações do colesterol HDL podem aumentar entre 10 a 15%)
(HUTTUNEN et al, 1991).
Fazem parte desta família de fármacos o gemfibrozil, o fenofibrato, o etofibrato, o
ciprofibrato e o bezafibrato. Em 3 a 5% dos indivíduos que utilizam fibratos podem ocorrer
queixas gastrointestinais (DIPIRO et al, 2008). Pode ocorrer também como efeito adverso rash
cutâneo, tonturas, aumento das transaminases e fosfatase alcalina hepáticas. O uso de fibratos
pode também causar miopatia e cálculos biliares (Third report of the expert panel on detection,
evaluation and treatment of high blood cholesterol in adults, 2002).
1.3.2.3. Ezetimibe
O ezetimibe é um fármaco que inibe especificamente a absorção intestinal do colesterol
proveniente da dieta e do colesterol biliar, o que leva a uma diminuição da absorção intestinal de
colesterol para cerca de metade. Este agente antidislipidémico liga-se a uma proteína existente
na membrana dos enterócitos, impedindo assim a absorção de colesterol pelos mesmos
(KISHIMOTO et al, 2011). A utilização de ezetimibe associado a uma estatina permite atingir
reduções superiores a 50% nos níveis de colesterol LDL relativamente à utilização de estatina
isoladamente (LIPSY et al, 2003). E usando a terapia combinada evita-se o aumento da dose da
estatina e, consequentemente, os efeitos adversos dependentes da dose (KISHIMOTO et al, 2011).
O ezetimibe é bem tolerado, havendo apenas referência a problemas gastrointestinais
(DIPIRO et al, 2008). No entanto, sendo este fármaco recente ainda carece de estudos e
informação segura sobre a sua eficácia, como tal, deve ser reservado para doentes intolerantes a
estatinas ou que não atinjam os objectivos terapêuticos apenas com uma estatina (LIPSY et al,
2003).
1.3.2.4. Niacina
A niacina, também conhecida como ácido nicotínico, diminui a síntese hepática de
colesterol VLDL, diminuindo assim a síntese de colesterol LDL. A diminuição da produção de
colesterol VLDL inclui a inibição da lipólise com consequente diminuição dos ácidos gordos livres
17
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
no plasma e diminuição hepática da esterificação dos triglicéridos (DIPIRO et al, 2008). O
mecanismo pelo qual isto acontece ainda não está bem esclarecido (MARKEL, 2011).
A niacina também aumenta a concentração de colesterol HDL pela redução do seu catabolismo e
é, por isso, usada na dislipidémia do tipo IIa, IIb, III, IV e V (DIPIRO et al, 2008).
Relativamente a efeitos adversos, a niacina pode causar rubor, prurido ou irritação
cutânea e intolerância gástrica. Pode também aumentar as concentrações plasmáticas das
enzimas hepáticas, do ácido úrico e da glicemia, quando utilizado em doses elevadas. Algumas
pessoas podem desenvolver toxicidade hepática severa (Coronary drug project research group,
1975). Com o objectivo de diminuir os efeitos secundários foram desenvolvidas novas formulações
de niacina de libertação prolongada (MARKEL, 2011).
1.3.2.5. Resinas permutadoras de iões
As resinas permutadoras de iões são uma possível opção para o tratamento da
dislipidémia mas são pouco usadas, principalmente devido à sua falta de palatabilidade e aos
seus efeitos secundários gastrointestinais (obstipação, inchaço, náuseas, flatulência) (SILVA et al,
2009; DIPIRO et al, 2008).
O seu mecanismo de acção consiste na ligação aos ácidos biliares presentes no intestino,
o que leva ao estímulo da sua síntese hepática, sendo precursor o colesterol. Aumentando o
catabolismo de colesterol, diminui o colesterol LDL. Devido ao seu modo de actuação, estas são
eficazes na dislipidémia do tipo IIa. No entanto, o aumento da biossíntese de colesterol pode
levar à produção paralela de VLDL e, consequentemente, ao aumento dos triglicéridos. Outro
facto que as torna pouco atractivas é a consequente diminuição da absorção de vitaminas
lipossolúveis durante a sua utilização (Third report of the expert panel on detection, evaluation
and treatment of high blood cholesterol in adults, 2002).
As resinas permutadoras de iões podem ainda diminuir a biodisponibilidade de alguns
fármacos como a varfarina, niacina, tiroxina, paracetamol, hidroclorotiazida, loperamida e ferro
(DIPIRO et al, 2008). Estas interacções podem ser evitadas, alternando as administrações com
intervalos de 6 horas ou mais (DIPIRO et al, 2008). Como exemplo de resinas temos a
colestiramina.
18
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.4.
Fitoterapia
1.4.1. Definição e evolução da Fitoterapia
A fitoterapia é a ciência que estuda a utilização de produtos de origem vegetal, as
chamadas plantas medicinais, com finalidade terapêutica de prevenir, aliviar ou curar doenças.
O uso de plantas na terapêutica está muito longe de ser recente pois, na Antiguidade a
Fitoterapia era a principal arma terapêutica. Os produtos designados “naturais” têm uma longa
história de utilização com fins terapêuticos. A utilização das plantas começou de forma empírica
mas com o acumular de experiência foram-se seleccionando as plantas ideais para cada “mal”. Os
primeiros escritos sobre a medicina pelas plantas têm cerca de 5000 anos e são obra da
Civilização Suméria (3000 a.C.). Desde sempre o Homem utilizou plantas, quer como alimento,
quer para fins curativos (CUNHA et al, 2010).
Vários autores desenvolveram compilações sobre plantas, como por exemplo, Dioscórides,
Scribónio Largo, Oribásio e Plínio (CUNHA et al, 2009). Hoje, os métodos científicos, juntamente
com a tecnologia de ponta existente, permitem, com maior facilidade, a identificação dos
princípios activos das plantas, descobrir novas propriedades terapêuticas e desenvolver novas
apresentações farmacêuticas para uma utilização mais eficaz, mais simples e mais adequada à
vida actual.
O século XIX viu desenvolver a medicina dita “química”. Estes medicamentos, obviamente
indispensáveis, mostraram limites relativamente aos efeitos secundários e à ineficácia
terapêutica. Isto leva as pessoas a procurarem outras alternativas, sendo a fitoterapia uma das
opções mais procuradas, pois é vista como uma terapêutica natural.
A Fitoterapia torna-se atractiva na medida em que, as pessoas podem encontrar uma solução
para alguns problemas de saúde sem recorrer ao uso de medicamentos. No entanto, a
problemática das plantas medicinais é complexa, devido à potencial variação da concentração
dos princípios activos, à sua estabilidade e conservação. Assim, o controlo de qualidade e toda a
regulamentação destes produtos até à comercialização assumem elevada importância. Deste
modo, existe uma tendência, bastante lógica, para que os medicamentos à base de plantas se
apoiem cada vez mais em ensaios farmacológicos e clínicos semelhantes aos dos medicamentos
ditos “químicos”. (CUNHA et al, 2009).
Deve ser promovida uma fitoterapia que fundamente os seus princípios na evidência
científica, na qualidade, na segurança e nas fontes de informação rigorosas e fidedignas, o que
nem sempre se verifica.
19
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.4.2. Controlo de qualidade e validação dos produtos fitoterápicos
Para que a prescrição e dispensa de produtos fitoterápicos seja a mais adequada,
correcta e segura, é necessário que existam estudos científicos onde se aprofundem os potenciais
efeitos adversos, interacções e contra-indicações e se avalie a eficácia e segurança dos produtos
naturais.
O mercado da Fitoterapia em Portugal tem evoluído ao longo dos anos. Mas, para que consolide
um espaço sólido no mercado, é preciso que haja legislação específica com um maior controlo de
tudo o que existe à venda, isto irá aumentar a credibilidade destes produtos face aos doentes e
profissionais de saúde (CUNHA et al, 2009).
Um dos factores que potencia ainda mais a necessidade de conhecimento sobre as plantas
medicinais é, o facto de estas terem um número elevado de outros compostos para além dos
constituintes activos. E para que exista qualidade no produto final, tem que se exigir qualidade
nas matérias-primas vegetais. Este controlo faz-se através da avaliação de aspectos
macroscópicos e microscópicos, pesquisa de impurezas e de falsificações, análise dos
constituintes activos e controlo de contaminantes (CUNHA et al, 2009). As matérias-primas usadas
em fitoterapia também são controladas em vários pontos-chave do processo da elaboração dos
fitoterápicos, destacando-se a obtenção, a qualificação e quantificação dos constituintes activos,
a determinação das acções farmacológicas e reacções adversas, assim como a elaboração de
preparações galénicas.
A existência da menor variabilidade possível nos constituintes activos, entre outras
características, é fundamental para que as plantas medicinais possam ter uso na medicina
tradicional ou na indústria farmacêutica (CUNHA et al, 2010).
A principal questão inerente aos medicamentos à base de plantas é a comprovação da sua
eficácia, pois esta só pode ser demonstrada com estudos clínicos bem desenhados e só assim se
pode dar ao produto a classificação de medicamento. É um dado adquirido haver uma maior
exigência quanto aos ensaios farmacodinâmicos pré-clínicos, ensaios toxicológicos pré-clínicos e
ensaios farmacocinéticos pré-clínicos (no caso de administração oral) (CUNHA et al, 2009).
1.4.3. Entidades Reguladoras
A Organização Mundial de Saúde é a entidade que regula a fitoterapia a nível mundial.
Esta Organização está atenta ao crescente interesse por esta terapia alternativa e como tal, tem
20
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
promovido várias reuniões internacionais com o objectivo de criar melhores condições de fabrico
destes produtos. Como consequência elaborou Directivas que permitem ao consumidor ter uma
maior garantia ao adquirir fitoterápicos (CUNHA et al, 2009)
A União Europeia também quis ter um papel na regulamentação dos medicamentos à base
de plantas, daí ter elaborado a Directiva 91/507/CEE, na qual são enumerados pontos cujos
medicamentos à base de plantas têm que respeitar. Em 2003, uma nova Directiva foi aprovada na
União Europeia sobre medicamentos de uso humano onde são também referenciados os
medicamentos à base de plantas (Directiva 2003/63/CE de Junho de 2003), e esta sofre algumas
emendas com o aparecimento da Directiva 2004/24/CE (CUNHA et al, 2009). Estas Directivas
tiveram origem num grupo de trabalho criado pela Agência Europeia de Validação do
Medicamento (EMEA) designado Working Group on Herbal Medicinal Products.
As Directivas da União Europeia foram transpostas para a legislação portuguesa pelo
Decreto-Lei n.º 176/2006 de 30 de Agosto. Com este Decreto-Lei tornam-se legais os
medicamentos à base de plantas que cumpram todos os requisitos dos medicamentos tradicionais
e os medicamentos à base de plantas de uso tradicional que obedeçam às indicações referidas
nesse mesmo Decreto-Lei. No Estatuto do Medicamento, Secção VI, Artigo 141º, está exposta toda
a regulamentação que os medicamentos tradicionais à base de plantas têm que respeitar perante
o INFARMED (Estatuto do Medicamento, 2006). Em Portugal, a regulação, supervisão e fiscalização
do sector dos medicamentos, incluindo fitomedicamentos, está a cargo do INFARMED, associado
ao Ministério da Saúde.
1.4.4. Plantas com acção a nível da aterosclerose
Têm sido tradicionalmente usadas determinadas plantas no tratamento sintomático e na
prevenção da aterosclerose. Entre elas o alho, o extracto fosfolipídico de soja, o farelo de aveia,
a goma-de-guar, o arroz fermentado vermelho, a alcachofra e o policosanol. O alho é a planta
para a qual existe o maior número de estudos farmacológicos e clínicos.
21
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1.4.4.1. Alho
O alho é uma planta bolbosa, possivelmente originária da Ásia Central e Ocidental. São
utilizados os bolbos de alho, constituídos pelos bolbilhos (dentes de alho), para a obtenção dos
produtos usados na terapêutica. A transformação do alho pode dar origem a alho em pó, ao
extracto de alho envelhecido, ao macerado em óleo vegetal e ao óleo essencial. O pó é
geralmente utilizado na obtenção de comprimidos e o extracto, relativamente recente, tem sido
alvo de múltiplos ensaios farmacológicos e clínicos (CUNHA et al, 2010). São vários os
constituintes activos do alho, estando os principais esquematizados na figura 3.
Principais constituintes activos do alho
Compostos Orgânicos de
Enxofre
Outros Compostos
Aliina
Isoaliina
Metilaliina
Cicloaliina
γ-glutamilcisteína
S-alil-cisteína
Aminoácidos livres
Frutosanas
Saponinas
Sais minerais
Oligoelementos (Selénio)
Figura 3: Principais constituintes activos do alho.
As aliinas dão origem aos produtos voláteis odoríferos característicos do alho, após
sofrerem hidrólise pela aliinase. Um dos produtos resultantes é a alicina (Figura 4) (CUNHA et al,
2009).
22
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
ALIINAS
Aliinase
Ácido alilssulfénico
Ácido aminoacrílico
Alicina
Ácido pirúvico
Figura 4: Esquema representativo da metabolização das aliinas pela aliinase.
O alho fez parte do top 10 de plantas mais vendidas nos Estados Unidos da América no
ano 2000, apesar de nem todos os ensaios clínicos serem concordantes relativamente à sua
eficácia (BORCHERS et al, 2000). Isto pode ocorrer devido à diversidade de preparações e
protocolos que podem ser usados nos ensaios clínicos. Na maior parte deles não há uma
padronização relativamente aos compostos activos.
Os primeiros ensaios farmacológicos sobre o possível efeito antidislipidémico do alho, realizados
em animais, foram efectuados na década de 70 do século XX (CUNHA et al, 2010).
Vários estudos realizados em hepatócitos de rato e coelho evidenciaram um marcado
efeito na redução da biossíntese do colesterol e dos ácidos gordos e na diminuição do número de
placas lipídicas nas artérias, usando o extracto total ou parcial de alho (SOVOVÀ et al, 2004). Em
estudos realizados in vitro foi também demonstrada uma interacção entre os compostos
sulfurados do alho e a enzima HMG-CoA redutase, existindo assim interferência na síntese
endógena de colesterol por aqueles compostos (MATHEW et al, 2004; YU-YAN et al, 2001). Neste
contexto foi observada a formação de pontes de dissulfureto que levam à inactivação do grupo
tiol (-SH) de várias enzimas, entre elas, a HMG-CoA redutase (MATHEW et al, 2004). Num ensaio
em ratos Wistar com uma dieta hipercolesterolémica foi observada uma diminuição notável do
colesterol e lípidos plasmáticos, após a administração de pó de alho liofilizado e alho fervido
durante 30 dias (GORINSTEIN et al, 2006). Foi também proposto como mecanismo de acção dos
compostos organossulfurados a inibição da oxidação das LDL (passo importante para a formação
de placas ateroscleróticas) (LAU, 2006).
23
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
No entanto, há também estudos que referem a fraca ou inexistente acção do alho na
hipercolesterolémia. É exemplo disso um estudo clínico no qual foi utilizado o pó de alho seco
padronizado em alicina (1,3%) administrado durante 12 semanas a doentes com dislipidémia,
tendo-se demonstrado que a administração de alho foi ineficaz na diminuição dos níveis de
colesterol (ISAACSOHN et al, 1998).
Uma meta-análise de 13 ensaios clínicos randomisados, duplamente cegos e controlados com
placebo concluiu que o efeito do alho é apenas modesto e que o seu uso na hipercolesterolémia é
questionável (STEVINSON et al, 2000).
Segundo uma análise crítica efectuada à literatura científica existente até 2002 sobre os
efeitos do alho, foi referido que a maioria dos estudos com dupla ocultação e controlados com
placebo não sugere uma conclusão clara em relação à redução do colesterol sérico e que são
necessários mais estudos em humanos, visto a maior parte ser realizada em animais (BRACE,
2002). Num estudo prospectivo duplamente cego e controlado por placebo em que foi
administrado alho sob a forma de comprimidos a treze doentes durante dezasseis semanas, não
se verificaram diferenças nos níveis de colesterol total, colesterol LDL, colesterol HDL ou
triglicéridos no final das dezasseis semanas (PELEG et al, 2003).
Relativamente a possíveis interacções medicamentosas, a informação disponível também
não é conclusiva. De acordo com um estudo realizado em 14 indivíduos saudáveis, não se
verificaram alterações no metabolismo de fármacos coadministrados que dependem do CYP2D6
ou CYP3A4 para serem biotransformados (MARKOWITZ et al, 2003). Mas, a Natural Medicines
Comprehensive Database diz que algumas preparações de alho podem induzir a isoenzima CYP3A4 do citocromo P450. Ao induzir este citocromo vai aumentar a sua capacidade de metabolizar
os fármacos que lhe são substrato, diminuindo assim as concentrações de fármaco disponível para
actuar no organismo (Natural medicines in the clinical management of hyperlipidemia, 2011).
1.4.4.2. Extracto fosfolipídico de soja
O extracto de soja obtido a partir do óleo de sementes de soja é constituído por
fosfolípidos que se pensa diminuírem os níveis de colesterol. A fosfatidilcolina constitui 73 a 79%
do extracto e é hidrolisada no fígado, formando ácidos gordos, colina e glicerina-3-fosfato
(CUNHA et al, 2009; CUNHA et al, 2010).
24
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Os estudos realizados são muito poucos, logo a informação credível sobre o uso desta
planta em qualquer patologia é mínima. Contudo, um estudo clínico randomisado, com duplaocultação e controlado com placebo que incluiu 121 indivíduos adultos dos dois sexos comparou
preparações com uma constituição diferente durante oito semanas. Uma das formulações
continha apenas proteínas de soja e a outra continha fibra de soja e fosfolípidos. Concluiu-se que
a segunda formulação teve um efeito duas vezes superior na redução dos lípidos plasmáticos, em
relação à que continha só proteínas de soja (HOIE et al, 2005).
É importante fazer aqui também referência à lecitina de soja, que se obtém pela
moagem do grão de soja. A lecitina é indispensável para a síntese de acetilcolina
(neurotransmissor essencial para o bom funcionamento cerebral) e faz parte da composição das
lipoproteínas. Um estudo recente com 30 indivíduos com dislipidémia, aos quais foi administrado
uma cápsula diária de lecitina de soja durante dois meses, evidenciou reduções de 42,6% no
colesterol total e 56,11% no colesterol LDL após os dois meses de administração (MOURAD et al,
2010). Crê-se que a lecitina de soja modifica a homeostase do colesterol no fígado, diminui a
absorção intestinal do colesterol e aumenta a excreção de ácidos biliares (LeBLANC et al, 2003).
1.4.4.3. Farelo de Aveia
O farelo de aveia é constituído por fibras que provém das sementes de aveia (CUNHA et
al, 2010). Num estudo realizado com o objectivo de determinar os efeitos nos lípidos plasmáticos
do farelo de aveia, foi observada uma redução de 5,3% nos níveis de colesterol total e de 8,7%
nos níveis de colesterol LDL (GOLD et al, 1988). Foi também efectuada uma meta-análise de 67
estudos para quantificar o efeito das fibras solúveis na redução do colesterol sérico e concluiu-se
que o efeito não é relevante tendo em conta a quantidade de fibras que cada pessoa ingere
normalmente no dia-a-dia (BROWN et al., 1999).
1.4.4.4. Goma-de-guar
A goma-de-guar é obtida a partir de uma planta cuja parte utilizada é o albúmen das
sementes em pó. Os seus principais constituintes são polissacáridos, predominantemente Dgalacto-D-manana. Estes polissacáridos, uma vez no estômago, dão uma sensação de saciedade,
sendo esta planta usada também para controlo do apetite.
25
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tal como no caso do farelo de aveia, também a goma-de-guar tem fibras na sua constituição. A
sua acção baseia-se no facto de impedirem a absorção do colesterol a nível do intestino. Num dos
poucos estudos existentes sobre a goma-de-guar demonstrou-se que a goma-de-guar é efectiva na
redução do colesterol sérico e dos triglicéridos (YAMADA et al., 1999).
1.4.4.5. Arroz fermentado vermelho (Red yeast rice)
O nome deste composto provém do facto de o arroz poder ser fermentado com o fungo
vermelho denominado Monascus purpureus, daí ser também designado como levedura de arroz
vermelho.
A maior parte dos estudos existentes sobre o arroz fermentado vermelho são provenientes da
China, visto este ter sido inserido primeiro numa Farmacopeia Chinesa, com indicação
terapêutica na melhoria da circulação sanguínea.
O arroz fermentado vermelho é constituído por muitas substâncias, entre elas a
monacolina K, a principal responsável pela acção hipocolesterolemiante. Para além desta, possui
ainda outras monacolinas também com capacidade para inibir a HMG-CoA redutase, glicéridos,
sais minerais, proteínas e pigmentos na sua composição (CUNHA et al, 2010).
A monacolina K é uma molécula cuja estrutura química é igual à da lovastatina, sendo
importante referir que esta estatina é um produto isolado do fungo Aspergillus terreus. Dito isto,
é fácil concluir que o mecanismo de acção, as possíveis interacções e os efeitos secundários da
monacolina K são similares aos referidos para a lovastatina (Monascus purpureus Monograph,
2004). A eficácia deste fitoterápico vai ser também similar à desta estatina, diminuindo a síntese
hepática de colesterol e reduzindo assim os níveis de colesterol total, colesterol LDL e
triglicéridos (LIU et al., 2006; HEBER et al., 1999; LIN et al., 2005). Um dos efeitos secundários
mais preocupantes das estatinas é a miopatia, que ocorre também, como seria de esperar, com a
utilização do arroz fermentado vermelho (SMITH et al., 2003).
Todas as estatinas são submetidas a vários ensaios, testadas em animais e humanos e só
depois comercializadas. Nos fitoterápicos, contudo, no processo de autorização para a
comercialização não há obrigatoriedade de padronização nem de quantificação das doses
comercializadas. O conteúdo em monacolinas não é uniforme em todas as preparações que estão
comercializadas, o que também torna difícil a análise e comparação dos resultados nos estudos
efectuados, pois as doses utilizadas nesses estudos variam conforme a preparação utilizada. Foi
efectuado um estudo em que se analisaram nove preparações de arroz fermentado vermelho que
26
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
estão disponíveis comercialmente e constatou-se que o conteúdo em monacolina K variava de
0,15 mg até 3,37 mg por cápsula nas várias preparações. Verificou-se ainda que apenas uma das
preparações continha as dez monacolinas que definem um arroz fermentado vermelho de
qualidade (KLIMEK et al., 2009).
Entre 2002 e 2007 foram reportados sete casos de desordens musculares devido à toma de
Monascus purpureus em Itália, neste estudo é referido também que na maioria dos casos este
produto é tomado por decisão pessoal, sem consultar um médico ou farmacêutico (LAPI et al.,
2008). É importante referir que, como a substância activa no arroz fermentado vermelho é a
monacolina K (estrutura igual à lovastatina), o doente intolerante a estatinas não deverá tomar
este fitoterápico.
1.4.4.6. Alcachofra
As folhas da alcachofra são a parte mais utilizada. Vários compostos fazem parte da sua
constituição, no entanto, a cinarina, os ácidos aromáticos e os flavonóides são os responsáveis
pela acção colerética, hepatoprotectora e hipocolesterolemiante. Outra das suas acções neste
âmbito é a redução dos triglicéridos (CUNHA et al, 2009).
Certos ensaios com animais constataram existir uma inibição indirecta da HMG-CoA
redutase. Pelo facto de esta inibição ser indirecta, poder-se-ão evitar os problemas decorrentes
da inibição directa a longo-termo que ocorre com as estatinas (GEBHARDT et al., 1998).
1.4.4.7. Policosanol
O policosanol é um composto que tem origem na cana de açúcar e verificou-se que o
policosanol tem capacidade para aumentar a ligação do colesterol LDL e a sua degradação (SINGH
et al., 2006). Há ainda evidência de que possa existir uma diminuição da actividade da enzima
HMG-CoA redutase pelo policosanol em cultura de células de hepatoma de rato McARH7777
(SINGH et al, 2006).
Contudo, em estudos randomisados com dupla ocultação e controlados com placebo
verificou-se que a alteração nos níveis de colesterol foi insignificante no grupo de pessoas que
tomaram policosanol comparativamente ao grupo placebo (KASSIS et al., 2008; BERTHOLD et al.,
2006).
27
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Também é possível encontrar estudos que defendem o efeito positivo do policosanol nos
níveis de colesterol mas é importante referir que grande parte desses estudos foram realizados
com policosanol de Cuba, não havendo esse mesmo policosanol disponível noutros locais para
possível análise (JANIKULA, 2002).
28
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
29
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
2. Objectivos
Esta dissertação tem como objectivo alertar para as Doenças Cardiovasculares e o seu
impacto em termos de morbilidade e mortalidade na Sociedade, para a importância da
dislipidémia como factor de risco cardiovascular e aprofundar o conhecimento sobre o
tratamento farmacológico de primeira linha nas dislipidémias – estatinas – especialmente no que
respeita ao seu perfil de efeitos adversos e de interacções medicamentosas com outros
medicamentos e produtos fitoterápicos usados neste contexto. É também dada ênfase à
fitoterapia, na medida em que é uma terapêutica alternativa cada vez mais procurada, apesar da
fraca informação ou evidência científica existente sobre a sua utilização.
Sendo assim, os objectivos específicos deste trabalho são:
Revisão
bibliográfica
da
informação
disponível
actualmente
sobre
estatinas,
principalmente o perfil de efeitos adversos e interacções e sobre os produtos naturais
usados no tratamento dislipidémia;
Avaliação básica em farmácia de oficina da utilização de estatinas em duas cidades da
Beira Interior;
Analisar o perfil de efeitos adversos, interacções medicamentosas e limitações das
estatinas;
Avaliar a adesão à terapêutica antidislipidémica com estatinas;
Conhecer os produtos de fitoterapia que poderão ter acção benéfica a nível da
hipercolesterolémia;
Avaliação da utilização concomitante de produtos fitoterápicos com estatinas e
potenciais interacções;
Alertar para a necessidade dos profissionais de saúde terem conhecimento sobre
fitoterapia, devido ao aumento da procura desta terapia alternativa.
30
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
31
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
3. Material e Métodos
3.1.
Tipo de estudo e selecção da população a estudar
Foi realizado um estudo descritivo através da aplicação de inquéritos estatísticos a
qualquer indivíduo com dislipidémia que adquirisse uma estatina em duas farmácias comunitárias
da Beira Interior, uma situada na Covilhã e a outra situada em Gouveia. Caso a pessoa adquirisse
a estatina para iniciar o tratamento antidislipidémico não se faria inquérito.
Amostra
Populacional
n = 100
Grupo I:
Farmácia da
Covilhã
Grupo II:
Farmácia de
Gouveia
Individuos que
utilizam uma
estatina
n = 50
Indivíduos que
utilizam uma
estatina
n = 50
Figura 5: Esquema que representa a amostra populacional utilizada no presente estudo.
3.2.
Recolha de dados
A recolha de dados foi efectuada através de um inquérito (Anexo 1) durante dois meses,
entre Março de 2011 e Maio de 2011. Todas as pessoas consentiram a realização do mesmo após
esclarecimento de que se tratava de um inquérito anónimo cujo único objectivo era recolha de
dados para posterior tratamento estatístico.
Os inquéritos foram feitos a pessoas que estavam a utilizar estatinas, tendo sido
recolhidos dados sobre o doente como o sexo, idade, patologias (para além da dislipidémia) e
32
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
farmacoterapia mencionadas pelo próprio. Relativamente à utilização de estatinas é registada a
estatina utilizada, a sua dose, a posologia, a adesão à terapêutica, tempo de utilização deste
fármaco e a possível existência de efeitos secundários potencialmente relacionáveis com a
utilização dos mesmos.
Também é avaliada a utilização ou não de produtos fitoterápicos com acção a nível do colesterol
concomitantemente com a estatina. Questiona-se que produto é consumido, a sua forma
farmacêutica, tempo de utilização e a possível presença de efeitos secundários.
3.3.
Análise dos dados
A análise estatística foi efectuada usando o software SPSS e os gráficos representados
pelo Software Microsoft Office Excel 2007. Foi efectuada uma análise estatística para descrever,
comparar, associar e estabelecer medidas quantificadoras de associação e efeito entre as
variáveis em estudo.
Foram definidas como variáveis qualitativas nominais o sexo (feminino ou masculino), a
estatina utilizada (atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina ou
sinvastatina), a adesão ou não à terapêutica, a presença ou não de efeitos secundários e a
utilização ou não de produtos fitoterápicos. A idade foi definida como variável quantitativa e
verificou-se a sua normalidade com o teste de Kolmogorov-Smirnov e a homogeneidade das
variâncias pelo teste de Levene. Concluiu-se que a idade é uma variável quantitativa com
distribuição Gaussiana.
Fez-se uma análise estatística descritiva na qual, para as variáveis qualitativas foram
usadas tabelas de distribuição de frequências com contagens e percentagens e a variável
quantitativa foi analisada com medidas de tendência central (média) e medidas de dispersão
(desvio-padrão, valor mínimo e valor máximo).
A análise inferencial bivariada para testar diferenças entre as variáveis foi efectuada com o teste
do Qui-quadrado, assumindo um nível de significância de 5%. A medida de efeito utilizada foi o
Odds Ratio, com o respectivo intervalo de confiança a 95%.
33
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
34
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
4. Resultados
4.1. Análise estatística descritiva
Foram inquiridos 48 homens e 52 mulheres, verificando-se que 48% da amostra
populacional é do sexo masculino e 52% do sexo feminino (Figura 6).
No Grupo I – Covilhã, inquiriram-se 30 indivíduos do sexo masculino e 20 do sexo
feminino, e portanto, uma percentagem de 60% para o sexo masculino e 40% para o sexo
feminino. No Grupo II – Gouveia, 18 indivíduos do sexo masculino responderam ao inquérito e 32
do sexo feminino, ou seja, 36% correspondem ao sexo masculino e 64% ao sexo feminino.
Feminino
52%
Masculino
48%
Figura 6: Distribuição da amostra populacional relativamente ao sexo.
A média de idades global foi de 67,67 ± 11,328 anos, sendo o valor mínimo de 38 anos e o
valor máximo de 87 anos. Na Figura 7 está representada a distribuição de idades da amostra
populacional.
Relativamente aos dois grupos, a média de idades no Grupo I foi de 64,94 ± 9,688 anos.
Sendo o valor mínimo de 44 anos e o máximo de 85 anos. No Grupo II a média de idades foi
superior, de 70,40 ± 12,256 anos.
35
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Distribuição de Idades
7
6
5
4
3
2
1
0
38 41 44 47 51 52 53 55 56 57 58 59 60 61 62 63 64 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87
Figura 7: Distribuição de idades na amostra populacional.
Verificou-se
que
67
dos
100
indivíduos
da
amostra
populacional
referem
concomitantemente hipertensão, o que representa 67% da população estudada. Verificou-se
também que 22% dos indivíduos inquiridos dizem ter Diabetes mellitus tipo 2. As patologias
mencionadas pelos indivíduos inquiridos estão representadas na Figura 8.
Entre os grupos, constata-se que o número de casos de hipertensão e Diabetes mellitus
tipo 2 concomitantemente com dislipidémia é maior no Grupo II.
70
67
Legenda:
D.M. – Diabetes mellitus
E. R. – Esofagite de refluxo
HBP – Hiperplasia benigna da próstata
A. R. – Artrite reumatóide
DPOC – Doença pulmonar obstrutiva crónica
60
50
40
30
22
20
10
8
7
7
6
2
2
2
1
1
1
1
0
Figura 8: Distribuição das patologias existentes na amostra, concomitantemente com a dislipidémia.
36
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Os fármacos utilizados para além da estatina mais referidos pela população amostral
foram: clopidogrel, varfarina, trimetazidina, omeprazol, metformina, gliclazida e bisoprolol
(Tabela 6).
Tabela 6: Fármacos mais utilizados pela população amostral para além da estatina.
FÁRMACO
NÚMERO DE INDIVÍDUOS
Clopidogrel
16
Varfarina
12
Trimetazidina
11
Omeprazol
10
Metformina
10
Gliclazida
9
Bisoprolol
9
Na farmacoterapia utilizada concomitantemente com a estatina, foi avaliado o número de
fármacos usado por cada pessoa (Série 1 da Figura 9, em que n = 100). Verificou-se que a maioria
utiliza entre 0 a 2 fármacos para além da estatina e o número de indivíduos é menor à medida
que aumenta o número de fármacos utilizados. Está também representado o número de fármacos
utilizado pelos indivíduos que referiram efeitos secundários (Série 2 da Figura 9, em que n = 22).
50
Número de indivíduos
45
45
40
35
35
Série1
Série2
30
25
20
15
10
15
10
10
2
5
0
0a2
3a5
6a8
5
0
9 a 12
Número de fármacos
Figura 9: Representação do número de fármacos utilizado pela amostra populacional e pelos indivíduos que
referiram efeitos secundários, para além da estatina.
37
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Na utilização de estatinas verificou-se que a estatina mais utilizada pela população
amostral é a sinvastatina, seguida pela rosuvastatina e pela atorvastatina, sendo as menos
utilizadas a fluvastatina, a pravastatina e a lovastatina (Figura 10).
Sinvastatina
Rosuvastatina
Pravastatina
Lovastatina
Fluvastatina
Atorvastatina
0
10
20
30
40
50
Número de Indivíduos
Figura 10: Representação da utilização de estatinas na amostra populacional.
No Grupo I a estatina mais utilizada é a rosuvastatina, apesar de o número de indivíduos
que a utilizam ser bastante semelhante ao da sinvastatina (Figura 11). No Grupo II a sinvastatina
é a mais utilizada, verificando-se que mais de metade dos indivíduos a utilizam (Figura 12). No
Grupo I existe uma maior distribuição das estatinas utilizadas, como se pode verificar nas figuras
11 e 12.
Grupo I
Sinvastatina
Rosuvastatina
Pravastatina
Lovastatina
Fluvastatina
Atorvastatina
0
5
10
15
20
Número de indivíduos
Figura 11: Representação da utilização de estatinas no Grupo I.
38
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Grupo II
Sinvastatina
Rosuvastatina
Pravastatina
Lovastatina
Fluvastatina
Atorvastatina
0
10
20
30
40
Número de indivíduos
Figura 12: Representação da utilização de estatinas no Grupo II.
Relativamente à adesão terapêutica, foi avaliado o facto de o doente tomar o
medicamento segundo a posologia que o médico prescreveu. Dos 100 indivíduos inquiridos, 87%
cumprem a posologia prescrita mas 13% não aderem à terapêutica, no sentido de a utilizar
correctamente (Figura 13). Verificou-se que no Grupo I a percentagem de indivíduos que não
segue a posologia correctamente é de 20%, sendo superior à do Grupo II que foi 6%.
Adesão à terapêutica
Não
13%
Sim
87%
Figura 13: Percentagem de indivíduos que cumprem ou não a posologia prescrita pelo médico para a
estatina.
39
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
No âmbito dos efeitos secundários, constatou-se que 22% da população referiu sentir pelo
menos um dos efeitos secundários questionados. Os restantes 78% não mencionaram nenhum
efeito adverso durante a utilização de uma estatina (Figura 14).
Efeitos Secundários
90
80
70
60
50
40
30
20
10
0
Sim
Não
Figura 14: Percentagem de indivíduos que mencionam efeitos secundários após a toma da estatina.
O grupo que refere mais efeitos secundários é o Grupo I. Neste grupo 36% da população
diz ter experienciado algum efeito secundário após o início da utilização da estatina. No Grupo II
apenas 8% dos indivíduos disse sentir efeitos secundários (Figura 15).
Grupo II
Grupo I
100%
80%
64%
60%
40%
92%
100%
80%
60%
36%
40%
20%
20%
8%
0%
0%
Sim
Não
Sim
Não
Figura 15: Percentagem de indivíduos que referem efeitos secundários no Grupo I e no Grupo II.
40
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
O efeito secundário mais citado na amostra foi a dor muscular, seguido da azia e da
flatulência (Figura 16). É de referir que no Grupo II apenas foram relatados dores musculares,
boca seca, náuseas, flatulência, dores abdominais e urticária e apenas um indivíduo referiu cada
um deles.
1
1
1
1
Dores abdominais
Urticária
Boca seca
Fraqueza
Obstipação
Tonturas
Náuseas
Perturbação do sono
Cãibras
Dores de cabeça
Espasmos
Flatulência
Azia
Dores musculares
2
2
3
3
3
3
4
7
9
12
0
2
4
6
8
10
12
Figura 16: Distribuição dos efeitos secundários mencionados pela amostra populacional.
Observou-se que, dos 22 indivíduos que referiram efeitos secundários, a maioria toma 3
fármacos para além da estatina (Tabela 7).
Tabela 7: Número de fármacos utilizados para além da estatina pelos indivíduos que referiram efeitos
secundários.
Número de indivíduos que
referiram efeitos secundários
Número de fármacos utilizados
para além da estatina
4
0
4
1
2
2
6
3
3
4
1
5
2
7
41
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Apenas 7% da amostra populacional revela utilizar um produto natural com o objectivo de
baixar os níveis de colesterol sérico. Os produtos usados consistem em alho, lecitina de soja e
casca de abacaxi (Tabela 8).
É necessário mencionar que apenas no Grupo I houve pessoas que utilizam a fitoterapia. No Grupo
II nenhum dos inquiridos disse usar a fitoterapia como terapêutica alternativa.
Tabela 8: Número de indivíduos que tomam fitoterápicos e os respectivos produtos utilizados.
FITOTERAPIA UTILIZADA
Produto
Forma farmacêutica
Número de indivíduos que referem o seu uso
Alho
Cápsulas
4
Lecitina de soja
Cápsulas
2
Casca de abacaxi
Chá
1
Dos indivíduos que usam estes produtos, 100% referiu que não comunicam a sua toma ao médico.
42
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
4.2. Análise estatística inferencial
Nesta análise foi efectuado o teste do Qui-quadrado para testar a relação entre as
variáveis. Nos casos em que o resultado do teste do Qui-quadrado revelou diferenças
estatisticamente significativas, o que é considerado para um valor de p<0,05, foi calculado o
Odds Ratio para medir essa associação.
Ao testar a relação entre as diferentes estatinas e a presença ou não de efeitos
secundários mencionados pelo doente, conclui-se que não havia uma diferença estatisticamente
significativa entre a toma de cada estatina e a presença ou não de efeitos secundários (Tabela 9).
Os efeitos secundários referidos pelos indivíduos que constituem a amostra populacional não se
relacionam com nenhuma estatina especificamente. Em todas elas houve, pelo menos, um doente
a citar efeitos secundários. No entanto, dos 22 casos de presença de efeitos secundários
observou-se que 9 eram relativos à toma da sinvastatina.
Tabela 9: Número de indivíduos que referem efeitos secundários vs estatina que utilizam e respectivo teste
do Qui-quadrado.
EFEITOS SECUNDÁRIOS
ESTATINA
Sim
Não
Atorvastatina
2
13
Fluvastatina
2
14
Lovastatina
1
1
Pravastatina
1
3
Rosuvastatina
7
19
Sinvastatina
9
38
Sig.
p = 0,757
Teste Qui-quadrado
Obteve-se uma diferença estatisticamente significativa entre a não adesão à terapêutica
e a presença de efeitos secundários, verificando-se que dos 13 indivíduos que não cumprem a
posologia que foi prescrita pelo médico, 7 referem a presença de efeitos secundários aquando da
toma da estatina (Tabela 10). É importante referir que todos os inquiridos que mencionaram
efeitos secundários tinham iniciado a terapêutica com uma estatina há relativamente pouco
tempo (entre 2 e 6 meses).
43
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 10: Número de indivíduos que referem efeitos secundários vs adesão ou não à terapêutica e
respectivo teste do Qui-quadrado.
EFEITOS SECUNDÁRIOS
ADESÃO À TERAPÊUTICA
Sim
Não
Sim
15
72
Não
7
Teste Qui-quadrado
6
Sig.
p = 0,003
Ao calcular o Odds Ratio, obteve-se um valor de 0,178, o que significa que os indivíduos
que não aderem à terapêutica têm uma probabilidade 0,178 vezes maior de experienciarem
efeitos adversos do que aqueles que cumprem a posologia. Foram calculados o limite inferior e o
limite superior do Odds Ratio pelo que, na população o Odds Ratio pode variar entre 0,052 e
0,605 com uma confiança de 95%.
Constatou-se também que há diferenças estatisticamente significativas na toma ou não
de fitoterápicos e a presença ou não de efeitos secundários.
É possível desconfiar deste facto na medida em que das 7 pessoas que disseram tomar
fitoterápicos, 6 referem a presença de efeitos secundários (Tabela 11).
Houve uma pessoa que disse que já sentia efeitos secundários antes de utilizar o
fitoterápico e as restantes cinco pessoas disseram que só após começarem a tomar a estatina ao
mesmo tempo do fitoterápico sentiram efeitos secundários.
É necessário referir que todas as pessoas disseram que a toma de fitoterápicos era recente
(variou entre semanas a meses).
44
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 11: Número de indivíduos que referem efeitos secundários vs utilização ou não de fitoterapia e
respectivo teste do Qui-quadrado.
EFEITOS SECUNDÁRIOS
FITOTERAPIA
Sim
Não
Sim
6
1
Não
16
Teste Qui-quadrado
77
Sig.
p = 0,000
O Odds Ratio obtido para esta associação foi de 28,875, pelo que as pessoas pertencentes
à amostra populacional que recorre à fitoterapia e que está a utilizar uma estatina
concomitantemente têm uma probabilidade 28,875 vezes maior de sentir efeitos secundários.
Foram calculados o limite inferior e o limite superior do Odds Ratio pelo que, na população o
Odds Ratio pode variar entre 3,249 e 256,569 com uma confiança de 95%.
Como a amostra de indivíduos que recorrem a fitoterápicos é pequena, o intervalo de confiança
obtido para o Odds Ratio não tem utilidade prática.
Averiguou-se a relação entre o sexo e a presença ou não de efeitos secundários, a adesão
à terapêutica e a toma de fitoterápicos, verificando-se que o sexo não influencia nenhum destes
factores na amostra populacional (Tabela 12). Também foi testada a relação entre a idade dos
inquiridos e a presença ou não de efeitos secundários, a adesão à terapêutica e a toma de
fitoterápicos, concluindo-se que a idade não se relaciona com estas variáveis (Tabela 12).
45
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Tabela 12: Valores de p obtidos no Teste do Qui-quadrado realizado para as respectivas variáveis
independentes e dependentes.
Variável Independente
Variável Dependente
Teste Qui-quadrado
Sig.
Sexo
Efeitos secundários
p = 0,487
Sexo
Adesão à terapêutica
p = 0,295
Sexo
Fitoterapia
p = 0,778
Idade
Adesão à terapêutica
p = 0,265
Idade
Efeitos secundários
p = 0,153
Idade
Fitoterapia
p = 0,050
Como a idade é uma variável quantitativa, foi transformada em qualitativa para poder ser
usada no teste do Qui-quadrado através da formação de dois grupos etários, indivíduos com
menos de 65 anos e indivíduos com mais de 65 anos.
46
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
47
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
5. Discussão
De acordo com os resultados preliminares dos Censos 2011, a população a residir em
Portugal consiste em 10.555.853 indivíduos. Deste total, 47,87% diz respeito ao sexo masculino e
52,13% ao sexo feminino (Instituto Nacional de Estatística, 2011). Perante estes números, pode-se
constatar que a população amostral deste estudo é representativa da população total, visto que
52% da população amostral é constituída por mulheres e os restantes 48% constituídos por homens
(INE, 2011).
Relativamente à idade, em ambos os grupos se verificou uma média de idades igual ou
superior a 65 anos. Isto significa que a maioria da população amostral é idosa. Não é
surpreendente, pois a população que mais utiliza e necessita de medicamentos é a população
idosa, sendo muito comum a polifarmácia (LIN, 2003).
A hipertensão e a Diabetes mellitus tipo 2 são as duas patologias mais referidas pela
população amostral. Este é um dos problemas das pessoas com dislipidémia, normalmente há
mais do que uma patologia ou factor de risco que contribui para um maior risco de Doença
Cardiovascular (TYROLER, 2000).
A maioria dos inquiridos (45%) apenas tomava um, dois ou mesmo nenhum fármaco, para
além da estatina. O mesmo acontece com os indivíduos que referiram efeitos secundários, 20 dos
22 indivíduos utilizam até 5 fármacos para além da estatina. Isto torna menor o risco de
interacções da estatina com fármacos utilizados concomitantemente, pelo que é com maior
segurança que se poderão atribuir os efeitos secundários referidos pelos indivíduos à toma de
uma estatina ou à toma concomitante de estatina e fitoterápico hipocolesterolemiante. No
entanto, o risco de interacções, como seria de esperar, aumenta com o aumento do número de
fármacos utilizados. Sabe-se que com o uso de dois medicamentos o risco de ocorrer interacção é
de 6%, aumentando para 50% caso se utilizem cinco medicamentos (LIN, 2003).
Observando a farmacoterapia referida pela população amostral, apenas é de mencionar o
facto de a varfarina, o clopidogrel e a digoxina serem utilizados ao mesmo tempo da estatina em
vários doentes (Tabela 6). Não pelo facto de ser totalmente contra-indicada a toma concomitante
de qualquer um destes fármacos com uma estatina, mas pelo facto de ser necessário precaução e
vigilância nestes doentes, pois podem ocorrer alterações na eficácia da terapêutica. No caso da
varfarina, a sua administração com estatinas inibidoras do CYP 3A4 leva a um aumento do risco
48
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
de hemorragia, pois há uma inibição do metabolismo da R-varfarina (SCHELLEMAN et al, 2010).
Tanto o clopidogrel como as estatinas requerem activação hepática pelo citocromo P450, o que
pode diminuir a actividade do clopidogrel, limitando a sua eficácia (JÚNIOR, 2010).
Quando a digoxina é utilizada em simultâneo com uma estatina, pode ocorrer rabdomiólise.
Pensa-se que isso se deve ao facto de a digoxina ser um substrato/inibidor da glicoproteína-P e
de as estatinas interferirem com essa ligação, aumentando a exposição sistémica à digoxina,
sendo, naturalmente, necessário haver monitorização dos níveis de digoxina (BELLOSTA et al,
2004). É o médico que tem que ter estas interacções em conta quando prescreve a terapêutica,
no entanto, o farmacêutico, no acto da dispensa, é também responsável por detectar possíveis
interacções que possam resultar dos fármacos prescritos.
A sinvastatina é a estatina mais utilizada pela amostra populacional. Pelos resultados de
um estudo realizado pelo CEFAR em 2009 (Farmácia Observatório, 2010), a sinvastatina foi o
genérico mais vendido em Portugal. Apesar do estudo do CEFAR apenas contabilizar genéricos,
pode-se verificar que, na população amostral, a sinvastatina é a estatina mais utilizada como
primeira linha hipocolesterolemiante. No entanto, é de notar que a rosuvastatina também se
destaca. A crescente utilização da rosuvastatina poderá estar relacionada com a realização do
estudo JUPITER (Justification for the Use of Statins in Primary Prevention: An Intervention Trial
Evaluating Rosuvastatin). Neste estudo demonstrou-se que existe um risco cardiovascular
substancial no caso de homens e mulheres com níveis de colesterol LDL normais mas níveis
elevados de PCR de elevada sensibilidade. Contudo, este risco passa a metade com a utilização
de rosuvastatina (RIDKER, 2009).
Apesar de não se ter obtido neste estudo nenhuma diferença estatisticamente significativa
entre cada estatina e a presença ou não de efeitos secundários, há um maior registo de casos de
efeitos adversos associados à sinvastatina (BELLOSTA et al, 2004).
Visto ser comum haver uma fraca adesão dos doentes à terapêutica quando se trata de
patologias que cursam assintomaticamente (SILVA, 2006), como é o caso da dislipidémia, é
notável a elevada percentagem de pessoas (87%) que seguem as recomendações do seu médico
e/ou farmacêutico neste estudo. A não adesão à terapêutica é um factor de risco para ocorrerem
problemas relacionados com medicamentos, como é o caso de interacções, efeitos secundários ou
ineficácia terapêutica (AHMAD et al, 2010).
Num estudo em que se analisou a adesão de 562 doentes à terapêutica com estatinas verificou-se
que a persistência diminui de 56% em 9 meses para 35% em 12 meses. No final do estudo apenas
41%
dos
indivíduos
com
idade
superior
a
65
anos
continuava
com
a
terapêutica
hipocolesterolemiante (HUSER et al, 2005).
49
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Um outro estudo retrospectivo realizado nos Estados Unidos da América descreveu os padrões da
persistência a longo-termo na terapêutica com estatinas, analisando 34.501 indivíduos com idade
igual ou superior a 65 anos. Concluíram que a adesão à terapêutica dos idosos diminui
substancialmente ao longo do tempo, verificando-se uma maior desistência nos primeiros 6 meses
de tratamento (BENNER et al, 2002).
No presente estudo, a não adesão apenas foi avaliada questionando os indivíduos sobre a
posologia, verificando-se se a posologia realizada tinha sido a recomendada pelo médico
prescritor. Isto significa que, o fármaco continua a ser utilizado, não havendo descontinuação tal
como nos estudos acima mencionados mas, no entanto, é utilizado de forma incorrecta. Nesta
situação podem ocorrer interacções com outros fármacos utilizados concomitantemente ou haver
diminuição da eficácia da estatina. Das 13 pessoas que não aderem à terapêutica, 9 referiram
uma posologia diferente da que o médico tinha recomendado, revelando fazê-lo apenas por “dar
mais jeito” tomar noutra altura ou por se esquecerem de tomar na altura devida, não tendo
questionado se essa acção teria alguma consequência na sua saúde. O esquecimento é um dos
factores apontados para a não adesão à terapêutica (FUNG et al, 2010).
É indispensável que os profissionais de saúde dêem informação adicional e mais detalhada
sobre as estatinas, das razões da sua prescrição e, principalmente, da sua importância para uma
melhor qualidade de vida e das possíveis consequências da sua descontinuação ou utilização
incorrecta.
Na população amostral 22% dos indivíduos referiram pelo menos um efeito secundário após
o início da toma da estatina. As dores musculares foram o efeito secundário mencionado mais
vezes, o que está de acordo com a evidência científica existente sobre o significativo potencial
que as estatinas têm para causar dores musculares. Está descrita a ocorrência de miopatia em
10% dos indivíduos que tomam estatinas, sendo a mialgia a situação mais comum (ECKEL, 2010).
Os sintomas musculares são mais habituais durante os primeiros seis meses de terapia
(VANDERBERG et al, 2010) e todos os inquiridos que referiram efeitos secundários tinham iniciado
a terapêutica há pouco tempo (entre dois e seis meses). Além disso, como foi referido, apenas 2
dos 22 indivíduos tomavam entre 6 a 8 fármacos. Assim, a relação efeito secundário-estatina
torna-se mais evidente.
Em termos de frequência, a seguir às dores musculares foram mencionados a azia, a flatulência e
os espasmos musculares. No caso da azia e da flatulência, há imensas causas possíveis e muita
gente experiencia estes sintomas pelo que se torna mais complicado associar estes efeitos à toma
de estatinas. No caso da azia ou dispesia é um sintoma bastante comum, principalmente no que
50
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
diz respeito à doença de refluxo gastroesofágico (OLAFSDOTTIR et al, 2011) e a flatulência é
também um sintoma de várias condições, exemplo da intolerância à lactose (SAVAIANO et al,
2006). Mas, o facto é que foram referidos. No caso dos espasmos, trata-se de um dos mais
comuns sintomas musculares associados à utilização de estatinas, como já foi referido
anteriormente.
Os efeitos adversos preocupam os doentes que utilizam estatinas, sendo uma das razões
para a sua descontinuação, assim como a dúvida acerca do seu efeito benéfico (McGINNIS et al,
2010). Cabe aos profissionais de saúde, nomeadamente médicos e farmacêuticos, explicarem a
vantagem de utilizar estatinas e esclarecerem as pessoas relativamente aos efeitos secundários,
pois isto contribuirá para uma maior adesão à terapêutica e como tal, para mais ganhos em
saúde.
Para além dos efeitos adversos mais conhecidos das estatinas, têm-lhe sido apontados
outros, tais como, perturbações do sono (SILVA, 2010) e problemas na cavidade oral (CRUZ et al,
2008). Neste estudo houve 3 pessoas a referirem perturbações do sono e apenas um indivíduo
referiu boca seca, pelo que talvez sejam necessários mais estudos com amostras maiores para
realmente se analisar a influência das estatinas nestes dois aspectos.
A utilização terapêutica das estatinas tem uma taxa de abandono de 5% (VANDERBERG et al,
2010) devido a efeitos adversos, o que demonstra que apesar da vasta informação disponível
sobre estatinas, mais investigação deve ser efectuada.
O número de pessoas que afirma recorrer à fitoterapia com o objectivo de ajudar a
reduzir os níveis de colesterol é muito baixo (7%). Contudo, não se pode desprezar o facto de
este estudo ter sido desenvolvido em duas cidades relativamente pequenas da Beira Interior e
com uma população maioritariamente idosa.
Nos dados obtidos através deste estudo, no Grupo I – Covilhã verifica-se que a média de
idades é inferior à do Grupo II – Gouveia, a adesão à terapêutica pelo Grupo I é também menor
que a do Grupo II, há mais referência a efeitos secundários no Grupo I do que no Grupo II e é
apenas no Grupo I que é feita alusão à fitoterapia como terapia complementar à terapêutica
convencional. Provavelmente, todos estes factores estão relacionados.
A Covilhã é uma cidade maior que Gouveia, mais desenvolvida, mais urbana e as pessoas
possivelmente estarão tendencialmente mais informadas, condições que podem aumentar a
procura de fitoterápicos. Contudo, um maior acesso a informação pode nem sempre significar um
acesso apenas a informação de confiança. Nos meios mais pequenos as pessoas, não tendo tanto
51
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
acesso a informação, têm maior tendência a seguir à risca o que é dito pelo profissional de
saúde.
Ao nível do acesso à informação é de notar que o contacto com outras terapias alternativas ou
com outros tipos de estabelecimento de saúde, como é o caso das para-farmácias é maior na
Covilhã. A localização das duas farmácias tem provavelmente influência, assim como os produtos
disponíveis em cada uma.
Como foi verificado no tratamento estatístico dos dados, há diferenças estatisticamente
significativas entre o grupo de pessoas que adere à terapêutica e o grupo que não adere
relativamente à presença de efeitos secundários e entre o grupo de pessoas que toma
fitoterápicos e o grupo que não toma também relativamente à presença de efeitos secundários.
Isto permite-nos concluir que há uma maior probabilidade de existência de efeitos
secundários caso não haja compliance e/ou se recorra à fitoterapia hipocolesterolemiante ao
mesmo tempo que se utiliza uma estatina.
Os produtos fitoterápicos utilizados consistem
essencialmente em alho e lecitina de soja. A utilização da casca de abacaxi neste contexto foi
também referenciada, contudo não é conhecida por nós qualquer evidência científica que ligue o
abacaxi a qualquer acção na diminuição dos níveis de colesterol.
Apesar do elevado número de artigos e estudos realizados sobre o alho, ainda não existe
uma informação conclusiva acerca do seu efeito benéfico na dislipidémia. Muitos dos benefícios
atribuídos ao alho não são suportados por estudos científicos bem desenhados, pois foram
referidos estudos com amostras pequenas, observando-se também inconsistência de resultados.
Como tal, o seu uso na terapêutica deve ser efectuado com prudência, pois o conhecimento
baseado na evidência é ainda relativamente fraco. Há suspeita de que o seu mecanismo de acção
seja similar ao das estatinas, por inibição da enzima HMG-CoA redutase. Se assim for, a utilização
de uma estatina e cápsulas de alho concomitantemente deverá ter um efeito aditivo. Se se
equacionarem os potenciais efeitos secundários que advêm desse mecanismo de acção é fácil
concluir que o risco de ocorrência desses mesmos efeitos é superior. Ao nível de interacções
medicamentosas, há a possibilidade de o alho ser indutor da isoenzima 3A4 do citocromo P450.
Como já foi referido, podemos constatar que a lovastatina, a sinvastatina e a atorvastatina são
metabolizadas por esta isoenzima. Isto significa que, caso haja toma concomitante de uma destas
estatinas e de alho, em concentrações propícias, pode haver diminuição das concentrações
séricas da estatina e consequentemente, diminuição da eficácia.
Em relação à lecitina de soja não existem dados que permitam concluir se a sua utilização
interfere com a toma concomitante de estatinas.
52
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Neste estudo todas as pessoas que referiram recorrer a produtos naturais referiram que
não comunicaram ao médico a sua utilização. Nos Estados Unidos, dois em cada três doentes que
tomam medicação prescrita pelo médico e suplementos alimentares não informam o médico da
sua utilização porque não consideram que a sua ingestão possa acarretar riscos (GARDINER et al,
2008) e cerca de uma em quatro pessoas para além de tomar medicação com prescrição médica
também toma um suplemento alimentar, no qual está incluída a fitoterapia (GARDINER et al,
2008). Isto é importante na medida em que o farmacêutico passa a ter um papel preponderante
no aconselhamento e promoção da auto-medicação informada e ainda na sensibilização do doente
para informar o seu médico caso consuma produtos fitoterápicos.
A procura de produtos naturais tem origem no facto de haver a ideia de que não
envolvem riscos para a saúde, associada a campanhas publicitárias apelativas que têm como alvo
as necessidades em saúde mais comuns. Para além disso, são produtos que, muitas vezes, se
encontram posicionados no espaço da farmácia de forma diferente dos medicamentos, estando
mais acessíveis ao público. São cada vez mais usados, mas nem sempre adequados a todas as
pessoas e a todas as patologias. O farmacêutico deve ter sempre em atenção os rótulos e
aconselhar produtos cuja composição refira a presença de constituintes padronizados, com a
mínima garantia de segurança.
Assim, é essencial aumentar o conhecimento sobre os produtos, sobre as substâncias que
os constituem, suas características e implicações, evidenciando a mais-valia no aconselhamento
prestado sobre estes produtos de saúde e na detecção e prevenção de possíveis riscos associados
à sua toma. Pois tal como refere o Artigo 72º do Estatuto da Ordem dos Farmacêuticos (Estatuto
da Ordem dos Farmacêuticos, 2001) o objectivo essencial da actividade farmacêutica é a pessoa
do doente, levanta-se então a questão: se por um lado é conhecida e defendida a expressão “uso
racional do medicamento” porque não promover também o “uso racional da fitoterapia”?
53
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
54
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
6. Conclusão
Deste estudo pode concluir-se, designadamente, que:
A sinvastatina é das estatinas mais utilizadas como agente antidislipidémico.
As mialgias são o efeito secundário mais frequentemente relacionado com a utilização de
estatinas.
A não adesão à terapêutica e a toma de determinados produtos fitoterápicos
concomitantemente
com
estatinas
poderão
despoletar
efeitos
secundários
que
normalmente não ocorreriam com a utilização da estatina unicamente ou levar a uma
diminuição da eficácia da terapêutica hipocolesterolmiante.
Podemos ainda efectuar as seguintes conclusões mais gerais:
Se por um lado há imensa informação sobre estatinas e sua potencialidade na prevenção
e tratamento de DCV, ainda há um caminho a percorrer no que diz respeito aos efeitos
adversos e interacções.
É fundamental que se promova uma adesão à terapêutica com o objectivo de retirar o
máximo benefício da mesma no que diz respeito à eficácia e para que se evitem possíveis
interacções com outros fármacos.
A fitoterapia é uma ciência em expansão, no entanto, mais credibilidade e segurança são
necessárias nos estudos desenvolvidos para que o seu uso seja efectuado com bases
científicas evidentes.
É necessário que os profissionais de saúde, nomeadamente médicos e farmacêuticos,
tenham formação nesta área para que possam saber que tipo de acções e interacções
podem ocorrer com os chamados produtos naturais e a farmacoterapia utilizada
cronicamente por cada doente.
55
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
56
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
7. Bibliografia
AHMAD, A; HUGTENBURG, J.; WELSCHEN, L.; DEKKER, J. et al (2010). Effect of medication review
and cognitive behaviour treatment by community pharmacists of patients discharged from the
hospital on drug related problems and compliance: design of a randomized controlled trial. BMC
Public Health, 10, pp. 1-10.
ÅSBERG, A. (2003). Interactions between cyclosporin and lipid lowering drugs: implications for
organ transplant recipients. Drugs, 63, pp. 367-378.
BALLANTYNE, C.; CORSINI, A.; DAVIDSON, M.; HOLDAAS, H. et al (2003). Risk for myopathy with
statin therapy in high-risk patients. Archives of Internal Medicine, 163, pp. 553-564.
BELLOSTA, S.; PAOLETTI, R.; CORSINI, A. (2004). Safety of Statins: Focus on Clinical
Pharmacokinetics and Drug Interactions. Journal of the American Heart Association, 109, pp. III50-III-57.
BENNER, J.; GLYNN, R.; MOGUN, H.; NEUMANN, P. et al (2002). Long-term persistence in use of
statin therapy in elderly patients. Journal of the American Medical Association, 288 (4), pp. 455–
461.
BERTHOLD, H.; UNVERDORBEN, S.; DEGENHARDT, R.; BULITTA, M. et al (2006). Effect of
Policosanol
on
Lipid
Levels
Among
Patients
With
Hypercholesterolemia
or
Combined
Hyperlipidemia. Journal of the American Medical Association, 295 (19), pp. 2262-2269.
BIERMAN, E. (1992). Atherogenesis in diabetes. Arteriosclerosis, Thrombosis and Vascular
Biology, 12, pp. 647-656.
BORCHERS, A.; KEEN, C.; STERN, J.; GERSHWIN, M. (2000). Inflammation and Native American
medicine: the role of botanicals. American Journal of Clinical Nutrition, 72, pp. 339-347.
BRACE, L. (2002). Cardiovascular benefits of garlic (Allium sativum L). Journal of Cardiovascular
Nursing, 16 (4), pp. 33-49 [Abstract].
BROWN, L.; ROSNER, B.; WILLETT, W.; SACKS, F. (1999). Cholesterol-lowering effects of dietary
fiber: a meta-analysis. American Journal of Clinical Nutrition, 69, pp. 30-42.
57
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
CALLE, E.; THUN, M.; PETRELLI, J.; RODRIGUEZ, C. et al (1999). Body-mass index and mortality in
a prospective cohort of U.S. adults. The New England Journal of Medicine, 341, pp. 1097-1105.
Coronary drug project research group (1975). Clofibrate and niacin in coronary heart disease.
Journal of the American Medical Association, 231, pp. 360-381.
CRUZ, M.; KUSTNER, E.; VICENTE, J.; FERRERO, X. et al (2008). Adverse effects of statins in the
oral cavity. Medicina Oral, Patologia Oral y Cirugía Bucal, 13 (2), pp. E98-E101.
CUNHA, A.; SILVA, A.; ROQUE, O. (2009). Plantas e Produtos Vegetais em Fitoterapia. Fundação
Calouste Gulbenkian, 3ª Edição, pp. 21-25;100;142;364;594.
CUNHA, A.; TEIXEIRA, F.; SILVA, A.; ROQUE, O. (2010). Plantas na Terapêutica – Farmacologia e
Ensaios Clínicos. Fundação Calouste Gulbenkian, 2ª Edição, pp. 15-40;193-217.
DAVIDSON, M.; ROBINSON, J. (2007). Safety of aggressive lipid management. Journal of the
American College of Cardiology, 49, pp. 1753–1762.
DIPIRO, J.; TALBERT, R.; YEE, G.; MATZKE, G. et al (2008). Pharmacotherapy – A Pathophysiologic
Approach. McGraw Hill, 7th Edition, pp. 385-400.
DOWNS, J.; CLEARFIELD, M.; WEIS, S.; WHITNEY, E. et al (1998). Primary prevention of acute
coronary events with lovastatin in men and women with average cholesterol levels: results of
AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. Journal of the
American Medical Association, 279 (20), pp. 1615-1622.
ECKEL, R. (2010). Approach to the Patient Who Is Intolerant of Statin Therapy. The Journal of
Clinical Endocrinology & Metabolism, 95 (5), pp. 2015–2022.
Estatuto da Ordem dos Farmacêuticos (2001). Ministério da Saúde, pp. 33.
Estatuto do Medicamento (2006). Decreto-Lei nº. 176/2006, de 30 de Agosto, INFARMED.
European
Heart
Network
-
CVD
Statistics
(2008).
Online
em
Junho
2011:
http://www.ehnheart.org/cvd-statistics.html
58
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Farmácia Observatório (2010). Especial Genéricos - Análise do Mercado de Medicamentos
Genéricos, CEFAR. Online em Maio de 2011: http://www.anf.pt/media/fo26.pdf
FLETCHER, G.; BALADY, G.; BLAIR, S.; BLUMENTHAL, J. et al (1996). Statements on exercise:
benefits and recommendations for physical activity programs for all Americans: a statement for
health professionals by the Committee on Exercise and Cardiac Rehabilitiation of the Council on
Clinical Cardiology. American Heart Association, 94, pp. 857-862.
FRANKLIN, S.; KHAN, S.; WONG, N.; LARSON, M. et al (1999). Is pulse pressure useful in predicting
risk for coronary heart disease? The Framingham Heart Study, 100, pp. 354-360.
Fundação Portuguesa de Cardiologia (2011 ). Factores de risco para as Doenças Cardiovasculares.
Online em Junho de 2011 em: http://www.fpcardiologia.pt/fact.html
FUNG, V.; SINCLAIR, F.; WANG, H.; DAILEY, D. (2010). Patients´ Perspectives on Nonadherence to
Statin Therapy: A Focus-Group Study. The Permanent Journal, 14 (1), pp. 4-10.
GARDINER, P.; PHILLIPS, R.; SHAUGHNESSY, A. (2008). Herbal and Dietary Supplement-Drug
Interactions in Patients with Chronic Illnesses. American Family Physician, 77 (1), pp. 73-78.
GEBHARDT, R. (1998). Inhibition of Cholesterol Biosynthesis in Primary Cultured Rat Hepatocytes
by Artichoke (Cynara scolymus L.) Extracts. The Journal of Pharmacology and Experimental
Therapeutics, 286, pp. 1122–1128.
GOLD, K.; DAVINSON, D. (1988). Oat bran as a cholesterol-reducing dietary adjunct in a young,
healthy population. Western Journal of Medicine, 148, pp. 299-302.
GORINSTEIN, S.; LEONTOWICZ, H.; LEONTOWICZ, M.; DRZEWIECKI, J. et al (2006). Raw and boiled
garlic enhances plasma antioxidant activity and improves plasma lipid metabolism in cholesterolfed rats. Life Sciences, 78 (6), pp. 655-663.
HEBER, D.; YIP, I.; ASHLEY, J.; ELASHOFF, D. et al (1999). Cholesterol-lowering effects of a
proprietary Chinese red-yeast rice dietary supplement. The American Journal of Clinical
Nutrition, 69, pp. 231–236.
59
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
HOIE, L.; MORGENSTERN, E.; GRUENWALD, J.; GRAUBAUM, H. et al (2005). A double-blind
placebo-controlled clinical trial compares the cholesterol-lowering effects of two different soy
protein preparations in hypercholesterolemic subjects. European Journal of Nutrition, 44 (2), pp.
65-71 [Abstract].
HUSER, M.; EVANS, T.; BERGER, V. (2005). Medication adherence trends with statins. Advances in
Therapy, 22 (2), pp. 163–171.
HUTTUNEN, J.; MANNINEN, V.; MÄNTTÄRI, M.; KOSKINEN, P. et al (1991). The Helsinki Heart
Study: central findings and clinical implications. Annals of Medicine; 23, pp. 155-159.
Instituto Nacional de Estatística (2011). Censos 2011, Resultados Preliminares. Online em
Setembro
de
2011:
http://censos.ine.pt/xportal/xmain?xpid=CENSOS&xpgid=ine_censos_publicacao_det&menuBOUI=
13707294&contexto=pu&PUBLICACOESpub_boui=122103956&PUBLICACOESmodo=2&selTab=tab1
ISAACSOHN, J.; MOSER, M.; STEIN, E.; DUDLEY, K. et al (1998). Garlic powder and plasma lipids
and lipoproteins: a multicenter, randomized, placebo-controlled trial. Archives of Internal
Medicine, 158, pp. 1189-1194.
JALLINGER, P.; DICKEY, R.; GANDA, O.; MEHTA, A. et al (2002). Medical Guidelines for Clinical
Practice for the Diagnosis and Treatment of Dyslipidemia and Prevention of Atherogenesis
[Amended Version]. Endocrine Practice, 6 (2), pp. 166-182.
JANIKULA, M. (2002). Policosanol: a new treatment for cardiovascular disease? Alternative
Medicine Review, 7 (3), pp. 203-217.
JONES, P.; KAFONEK, S.; LAURORA, I.; HUNNINGHAKE, D. (1998). Comparative dose efficacy study
of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with
hypercholesterolemia (The CURVES Study). The American Journal of Cardiology, 81, pp. 582–587.
JÚNIOR, C.; SOEIRO, A.; ARAÚJO, L.; JABOT, B. et al (2010). Lack of Clopidogrel-Statin
Interaction in Patients Undergoing Coronary Stent Implantation. Arquivos Brasileiros de
Cardiologia, 95 (3), pp. 321-327.
60
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
KASSIS, A.; JONES, P. (2008). Changes in cholesterol kinetics following sugar cane policosanol
supplementation: a randomized control trial. Lipids in Health and Disease, 7 (17), pp. 1-8.
KEYS, A.; MENOTTI, A.; ARAVANIS, C.; BLACKBURN, H. et al (1984). The Seven Countries Study:
2,289 deaths in 15 years. Preventive Medicine, 13, pp. 141-154.
KING,
M.
(2010).
The
medical
biochemistry
page.
Online
em
Maio
de
2011:
http://themedicalbiochemistrypage.org
KISHIMOTO, M.; SUGIYAMA, T.; OSAME, K.; TAKARABE, D. et al (2011). Efficacy of ezetimibe as
monotherapy or combination therapy in hypercholesterolemic patients with and without
diabetes. The Journal of Medical Investigation, 58, pp. 86-94.
KLIMEK, M.; WANG, S.; OGUNKANMI, A. (2009). Safety and Efficacy of Red Yeast Rice (Monascus
purpureus) as an Alternative Therapy for Hyperlipidemia. Pharmacy & Therapeutics, 36 (6), pp.
313-327.
KRAUSS, R.; ECKEL, R.; HOWARD, B.; APPEL, L. (2000). AHA Dietary Guidelines, revision 2000: a
statement for healthcare professionals from the Nutrition Committee of the American Heart
Association. Circulation, 102, pp. 2284-2299.
LAPI, F.; GALLO, E.; BERNASCONI, S.; VIETRI, M. (2008). Myopathies associated with red yeast
rice and liquorice: spontaneous reports from the Italian Surveillance System of Natural Health
Products. British Journal of Clinical Pharmacology, 34 (6), pp. 572-574.
LAU, B. (2006). Suppression of LDL oxidation by garlic compounds is a possible mechanism of
cardiovascular health benefit. Journal of Nutrition, 136 (3 Suppl), pp. 765S-768S.
LeBLANC, M.; BRUNET, S.; BOUCHARD, G.; LAMIREAU, T. (2003). Effects of dietary soybean
lecithin on plasma lipid transport and hepatic cholesterol metabolism in rats. Journal of
Nutritional Biochemistry, 14 (1), pp. 40-48.
LI, R.; BENSEN, J.; HUTCHINSON, R.; PROVINCE, M. et al (2000). Family risk score of coronary
heart disease (CHD) as a predictor of CHD: the Atherosclerosis Risk in Communities (ARIC) Study
and the NHLBI Family Heart Study. Genetic Epidemiology, 18, pp. 236-250.
61
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
LIN, C.; LI, T.; LAI, M. (2005). Efficacy and safety of Monascus purpureus Went rice in subjects
with hyperlipidemia. European Journal of Endocrinology, 153, pp. 679–686.
LIN, P. (2003). Drug interactions and polypharmacy in the elderly. The Canadian Alzheimer
Disease Review, pp 10-14.
Lipid research clinics program (1984). The Lipid Research Clinics Coronary Primary Prevention
Trial results II: The relationship of reduction in incidence of coronary heart disease to cholesterol
lowering. The Journal of the American Medical Association, 251, pp. 365-374.
LIPSY, R.; BOTTORF, M.; DENKE, M.; FREEMAN, E. (2003). Optimizing Dyslipidemia Outcomes: A
Novel Pharmacotherapeutic Pathway (Supplement). Journal of Managed Care Pharmacy, 9 (1),
pp. 4-23.
LIU, J.; ZHANG, J.; SHI, Y.; GRIMSGAARD, S. et al (2006). Chinese red yeast rice (Monascus
purpureus) for primary hyperlipidemia: a meta-analysis of randomized controlled trials. Chinese
Medicine, 1 (4), pp. 1-13.
MAGALHÃES, M. (2005). Mecanismos de rabdomiólise com estatinas. Arquivos Brasileiros de
Cardiologia, 85 (Suplemento V), pp. 42-44.
MARKEL, A. (2011). The Resurgence of Niacin: From Nicotinic Acid to Niaspan/Laropiprant. Israel
Medical Association Journal, 13, pp. 368-373.
MARKOWITZ, J.; DEVANE, C.; CHAVIN, K.; TAYLOR, R. et al (2003). Effects of garlic (Allium
sativum L.) supplementation on cytochrome P450 2D6 and 3A4 activity in healthy volunteers.
Clinical Pharmacology & Therapeutics, 74 (2), pp. 170-177 [Abstract].
MARON, D.; FAZIO, S.; LINTON, M. (2000). Current Perspectives on Statins. Journal of the
American Heart Association, 101, pp. 207-213.
MATHEW, B.; PRASAD, N.; PRABODH, R. (2004). Cholesterol-lowering effect of organosulphur
compounds from garlic: a possible mechanism of action. Kathmandu University Medical Journal,
2 (2), pp. 100-102.
62
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
Mayo
Clinic
(2011).
Heart
Disease,
Definition.
Online
em
Maio
de
2011:
http://www.mayoclinic.com/health/heart-disease/DS01120
McBRIDE, P. (1992). The health consequences of smoking: cardiovascular diseases. Medical Clinics
of North America, 76, pp. 333-353.
McGILL, H. (1968). Introduction to the geographic pathology of atherosclerosis. Laboratory
Investigation, 18, pp. 465-467.
McGINNIS, B.; OLSON, K.; MAGID, D.; BAYLISS, E. et al (2007). Factors related to adherence to
statin therapy. The Annals of Pharmacotherapy, 41 (11), pp. 1805–1811.
Monascus purpureus Monograph (2004). Alternative Medicine Review, 9 (2), pp. 208-210.
MOURAD, A.; PINCINATO, E.; MAZZOLA, P.; SABHA, M. et al (2010). Influence of Soy Lecithin
Administration on Hypercholesterolemia. Cholesterol, pp. 1-4.
Natural medicines in the clinical management of hyperlipidemia (2011). Natural Medicines
Comprehensive
Database.
Online
em
Maio
de
2011:
http://naturaldatabase.therapeuticresearch.com/ce/ceCourse.aspx?s=ND&cs=&pc=10%2D105&ce
c=1&pm=5
NEUVONEN, P.; NIEMI, M.; BACKMAN, J. (2006). Drug interactions with lipid-lowering drugs:
Mechanisms and clinical relevance. Clinical Pharmacology and Therapeutics, 80, pp. 565-581.
OLAFSDOTTIR, L.; GUDJONSSON, H.; JONSDOTTIR, H.; THJODLEIFSSON, B. (2011). Natural history
of heartburn: A 10-year population-based Study. World Journal of Gastroenterology, 17 (5), pp.
639-645.
PELEG, A.; HERSHCOVICI, T.; LIPA, R.; ANBAR, R. et al (2003). Effect of garlic on lipid profile and
psychopathologic parameters in people with mild to moderate hypercholesterolemia. Israel
Medical Association Journal, 5 (9), pp. 637-640.
PEPROTECH
(2005).
Lipoproteins
and
Apoproteins.
Online
em
Maio
de
2011:
http://www.peprotech.com/content/focusarticles.htm?id=75
63
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
PEREZ-JIMENEZ, J.; SAURA-CALIXTO, F. (2005). Literature may underestimate the actual
antioxidant capacity of cereals. Journal of Agricultural and Food Chemistry, 53 (12), pp. 50365040 [Abstract].
Portal
da
Saúde
(2009).
Doenças
Cardiovasculares.
Online
em
Abril
de
2011:
http://www.portaldasaude.pt/portal/conteudos/enciclopedia+da+saude/doencas/doencas+do+a
parelho+circulatorio/doencascardiovasculares.htm
Prontuário Terapêutico (2010). INFARMED, pp. 210-220.
PYÖRÄLÄ, K.; DE BACKER, G.; GRAHAM, I.; POOLE-WILSON, P. (1994). Prevention of coronary
heart disease in clinical practice: recommendations of the Task Force of the European Society of
Cardiology,
European
Atherosclerosis
Society
and
European
Society
of
Hypertension.
Atherosclerosis, 110, pp. 121-161.
RAHMAN, K. (2001). Historical Perspective on Garlic and Cardiovascular Disease. Journal of
Nutrition, 131, pp. 977S-979S.
RIDKER, P. (2009). The JUPITER Trial: Results, Controversies, and Implications for Prevention.
Journal of the American Heart Association, 2, pp. 279-285.
SACKS, F.; MOYÉ, L.; DAVIS, B.; COLE, T. et al (1998). Relationship between plasma LDL
concentrations during treatment with pravastatin and recurrent coronary events in the
cholesterol and recurrent events trial. Journal of the American Heart Association, 97, pp. 14461452.
SAVAIANO, D.; BOUSHEY, C.; McCABE, G. (2006). Lactose Intolerance Symptoms Assessed by MetaAnalysis: A Grain of Truth That Leads to Exaggeration. The Journal of Nutrition, 136, pp. 1107–
1113.
Scandinavian simvastatin survival study group (1994). Randomised trial of cholesterol lowering in
4,444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S).
Lancet, 344, pp. 1383-1389.
64
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
SCHELLEMAN, H.; BILKEN, W.; BRENSINGER, C.; WAN, F. et al (2010). Fibrate/Statin Initiation in
Warfarin Users and Gastrointestinal Bleeding Risk. American Journal of Medicine, 123(2), pp. 114.
SHITARA, Y.; HIRANO, M.; SATO, H.; SUGIYAMA, Y. (2004). Gemfibrozil and its glucuronide inhibit
the organic anion transporting polypeptide 2 (OATP2/OATP1B1:SLC21A6)-mediated hepatic
uptake and CYP2C8-mediated metabolism of cerivastatin: analysis of the mechanism of the
clinically relevant drug-drug interaction between cerivastatin and gemfibrozil. The Journal of
Pharmacology and Experimental Therapeutics, 311, pp. 228-236.
SILVA, A.; COELHO, A.; RODRIGUES, E.; SANTOS, F. et al (2009). Recomendações portuguesas
para a prevenção primária e secundária da aterosclerose. Sociedade Portuguesa de Aterosclerose,
2ª Edição, pp. 17-28.
SILVA, P. (2006). 25 Perguntas em Dislipidémias – Parte I. Permanyer Portugal, 1ª Edição, pp. 1326.
SILVA, P. (2010). Terapêutica redutora intensiva do colesterol: a certeza da segurança. Revista
Portuguesa de Cardiologia, 29 (9), pp. 1405-1418.
SINGH, D.; LI, L.; PORTER, T. (2006). Policosanol Inhibits Cholesterol Synthesis in Hepatoma Cells
by Activation of AMP-Kinase. The Journal of Pharmacology and Experimental Therapeutics, 318
(3), pp. 1020–1026.
SMITH, D.; OLIVE, K. (2003). Chinese red rice induced myopathy. Southern Medical Journal, 96
(12), pp. 1265-1267.
SOVOVÁ, M.; SOVA, P. (2004). Pharmaceutical importance of Allium sativum L. 5. Hypolipemic
effects in vitro and in vivo. Ceska Slov Farm., 53 (3), pp. 117-123 [Abstract].
STAESSEN, J.; FAGARD, R.; THIJS, L.; CELIS, H. et al (1997). Randomised double-blind comparison
of placebo and active treatment for older persons with isolated systolic hypertension. Lancet, 1,
pp. 757-764.
65
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
STAMLER, J.; WENTWORTH, D.; NEATON, J. (1986). Is relationship between serum cholesterol and
risk of premature death from coronary heart disease continuous and graded? Findings in 356 222
primary screenees of the Multiple Risk Factor Intervention Trial (MRFIT). The Journal of the
American Medical Association, 256, pp. 2823-2828.
STEVINSON, C.; PITTLER, M.; ERNST, E. (2000). Garlic for treating hypercholesterolemia. A metaanalysis of randomized clinical trials. Annals of Internal Medicine, 133, pp. 420-429.
The World Health Report (2002). World Health Organization, pp. 114-118.
Third report of the expert panel on detection, evaluation and treatment of high blood cholesterol
in adults (2002). National Cholesterol Education Program. National Heart, Lung, and Blood
Institute, pp. II1-II26;II42-II45;VI1-VI20.
TYROLER, H. (2000). Coronary Heart Disease Epidemiology in the 21 st Century. Epidemiologic
Reviews, 22 (1), pp 7-11.
VAN DEN HOOGEN, P.; FESKENS, E.; NAGELKERKE, N.; MENOTTI, A. et al (2000). The relation
between blood pressure and mortality due to coronary heart disease among men in different
parts of the world. The New England Journal of Medicine, 342, pp. 1-8.
VANDERBERG, B.; ROBINSON, J. (2010). Management of the Patient with Statin Intolerance.
Current Atherosclerosis Reports, 12, pp. 48–57.
West of Scotland coronary prevention study group (1998). Influence of pravastatin and plasma
levels on clinical events in the West of Scotland Coronary Prevention Study (WOSCOPS).
Circulation; 97, pp. 1440-1445.
WILLIAMS, R.; HUNT, S.; HEISS, G.; PROVINCE, M. et al (2001). Usefulness of cardiovascular family
history data for population-based preventive medicine and medical research (the Health Family
Tree Study and the NHLBI Family Heart Study). American Journal of Cardiology, 87, pp. 129-135.
WILSON, P.; D'AGOSTINO, R.; LEVY, D.; BELANGER, A. (1998). Prediction of coronary heart
disease using risk factor categories. Journal of the American Heart Association, 97, pp. 18371847.
66
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
World Health Organization (2011). Cardiovascular Diseases - Fact Sheet Nº 317. Online em Abril
de 2011: http://www.who.int/mediacentre/factsheets/fs317/en/index.html
YAMADA, K.; TOKUNAGA, Y.; IKEDA, A.; OHKURA, K. et al (1999). Dietary effect of guar gum and
its partially hydrolyzed product on the lipid metabolism and immune function of Sprague-Dawley
rats. Bioscience, Biotechnology and Biochemistry, 63 (12), pp. 2163-2167.
YU-YAN, Y.; LIU, L. (2001). Cholesterol lowering effect of garlic extracts and organosulfur
compounds: Human and animal studies. Journal of Nutrition, 131, pp. 989S-993S.
67
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
68
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
8. Anexos
8.1 Anexo I – Inquérito
Inquérito Estatístico
“Estatinas e fitoterapia em dislipidémias:
efeitos secundários e interacções medicamentosas”
Dissertação para obtenção do Grau de Mestre em Ciências Farmacêuticas pela Faculdade
de Ciências da Saúde da Universidade da Beira Interior
Catarina Ferreira
Este inquérito é confidencial e anónimo.
Destina-se unicamente à recolha de dados para posterior análise estatística.
69
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
1. DADOS DO DOENTE
1.1. Sexo:
1.2. Idade:
anos
Feminino
Masculino
1.3. Patologias concomitantes:
1.4. Farmacoterapia:
2. ESTATINAS
2.1. Que estatina toma:
2.2. Dose:
Atorvastatina
2.3. Posologia:
Fluvastatina
Lovastatina
Pravastatina
2.4. Adesão e cumprimento da terapêutica:
Rosuvastatina
Sinvastatina
Outra
2.5. Há quanto tempo toma este medicamento?
2.6. Desde que toma esta medicação tem sentido algum efeito secundário?
Sim
Não
70
Estatinas e fitoterapia em dislipidémias: efeitos secundários e interacções medicamentosas
2.7. Se a resposta anterior foi sim, qual ou quais?
Dores abdominais
Náuseas
Obstipação
Flatulência
Azia
Eritema
Cãibras
Fraqueza
Espasmos
Dores musculares
Sabor amargo
Boca seca
Perturbação do sono
Dor de cabeça
Outros
3. FITOTERAPIA
3.1. Toma algum suplemento ou produto natural para o colesterol?
Sim
Não
3.2. Se a resposta anterior foi sim, qual?
Chá
Infusão
Cápsula
3.3. Há quanto tempo toma este produto?
Comprimido
Outro
3.4. Comunicou a toma do fitoterápico ao médico?
Sim
Não
3.5. Desde que toma este produto tem sentido algum efeito secundário?
Sim
Não
3.6. Se a resposta anterior foi sim, qual ou quais?
71
[Escrever texto]