UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
Instituto de Bioquímica Médica
LISTA DE EXERCÍCIOS 2 – Bioquímica/Bloco 1 – Odonto (2012/I)
1. Qual dos seguintes aminoácidos tem a maior variação em solubilidade (em água)
quando diminuímos o pH de 5 para 3?
a) Arginina
b) Prolina
c) Tirosina
d) Ácido Aspártico
e) Asparagina
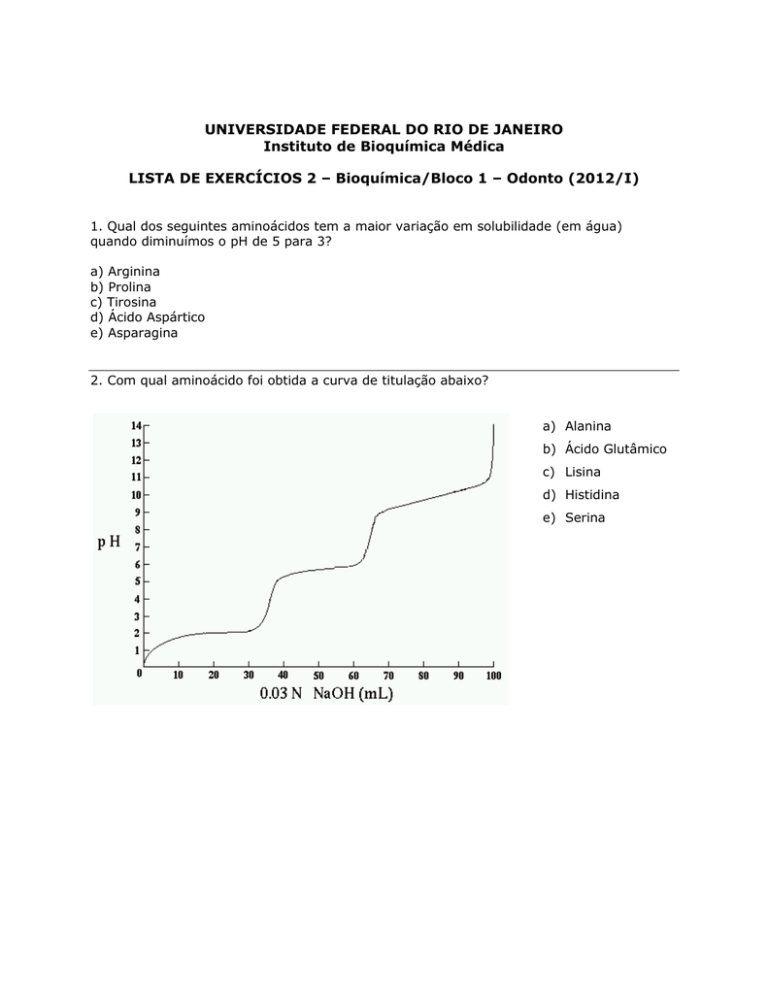
2. Com qual aminoácido foi obtida a curva de titulação abaixo?
a) Alanina
b) Ácido Glutâmico
c) Lisina
d) Histidina
e) Serina
3. a) Desenhe a estrutura do
dipeptídio Ala-Leu com todas as
suas formas de ionização,
indicando os equilíbrios.
b) Calcule o valor de pI e desenhe
sua curva de titulação.
Alanina (Ala, A)
Leucina (Asp; D)
pK1 = 2,3; pK2 = 9,8
pK1 = 2,4; pK2 = 9,6;
H
+ _ H3N C COO
CH3
c) Discuta a capacidade
tamponante desse peptídio.
4. Um método utilizado para purificação de proteínas consiste no uso da propriedade de
solubilidade diferencial. Sabendo-se que a solubilidade em água de uma cadeia polipeptídica
depende da polaridade relativa das cadeias laterais dos resíduos de aminoácidos, qual
peptídeo será mais solúvel em cada uma das situações abaixo? EXPLIQUE.
a) (Gly-Gly-Gly) ou (Glu-Glu-Glu) em pH 7,0
b) (Ala-Ser-Gly) ou (Asn-Ser-His) em pH 6,0
5. Indique os efeitos prováveis na estrutura de uma proteína globular causados pelas
seguintes mutações e explique suas razões:
a. Leucina para Fenilalanina
b. Metionina para Cisteína
c. Valina para Treonina
d. Glicina para Alanina
e. Metionina para Prolina
6. Dado os seguintes polipeptídeos:
I. Ala-Phe-Tyr-Phe-Ala-Met-Gly-Ser-Trp-Gly-Thr
II. Ala-Glu-Phe-Met-Ile-Arg-Val-Cys-Leu-Ala-Pro-Gly-Met
a. Que tipo de estrutura secundária seria mais provavelmente encontrada para cada
polipeptídeo? Explique.
b. Qual a consequência na estrutura do peptídeo II se fosse provocada uma mutação e
o resíduo de Arg fosse trocado por Asp?
c. Explique como a presença de um resíduo de Pro no peptídeo II possibilita a formação
de uma dobra-β.
7. A alfa1-antitripsina (AAT) é uma proteína de 52 kDa sintetizada no fígado, que atua como
um inibidor natural de proteases (enzimas que degradam proteínas). A deficiência em AAT
leva à enfisema pulmonar e cirrose hepática. A enfisema pulmonar ocorre porque a AAT é
um inibidor responsável por inativar a elastase, uma protease que degrada elastina, que é a
proteína responsável pela elasticidade do tecido pulmonar. A deficiência em AAT é causada
pela mutação pontual E342K, ou seja, o resíduo de glutamato (E) na posição 342 foi trocado
por um resíduo de lisina (K). Como consequência da mutação, a proteína se agrega no
fígado, onde é sintetizada, levando à cirrose hepática. Discuta as causas da agregação da
proteína mutante quando ela é sintetizada.
8. Muitas doenças degenerativas, como o Mal de Alzheimer, a Doença de Parkinson, a
Doença de Huntington, a Esclerose Amiotófica Lateral e a Doença do Príon (vaca louca), são
causadas por agregação protéica. Os agregados (amilóides ou placas amiloidogênicas) são
formados por fibras protéicas, contendo uma proteína com estrutura em folhas-β. A
conformação original da proteína é em alfa-hélice e a mudança da conformação de alfa para
beta leva à agregação da molécula. EXPLIQUE porque a proteína não agrega na sua forma
original e porque ela agrega quando ocorre a mudança conformacional →β.