Lista de Exercícios 2 – Aminoácidos e Proteínas Globulares
Curso:
Bioquímica para Odonto / Bloco 1 (Profa. Lucia Bianconi)
Aminoácidos
1. Qual dos seguintes aminoácidos tem a maior variação em solubilidade (em água) quando
diminuímos o pH de 5 para 3?
a) Arginina
b) Prolina
c) Tirosina
d) Ácido Aspártico
e) Asparagina
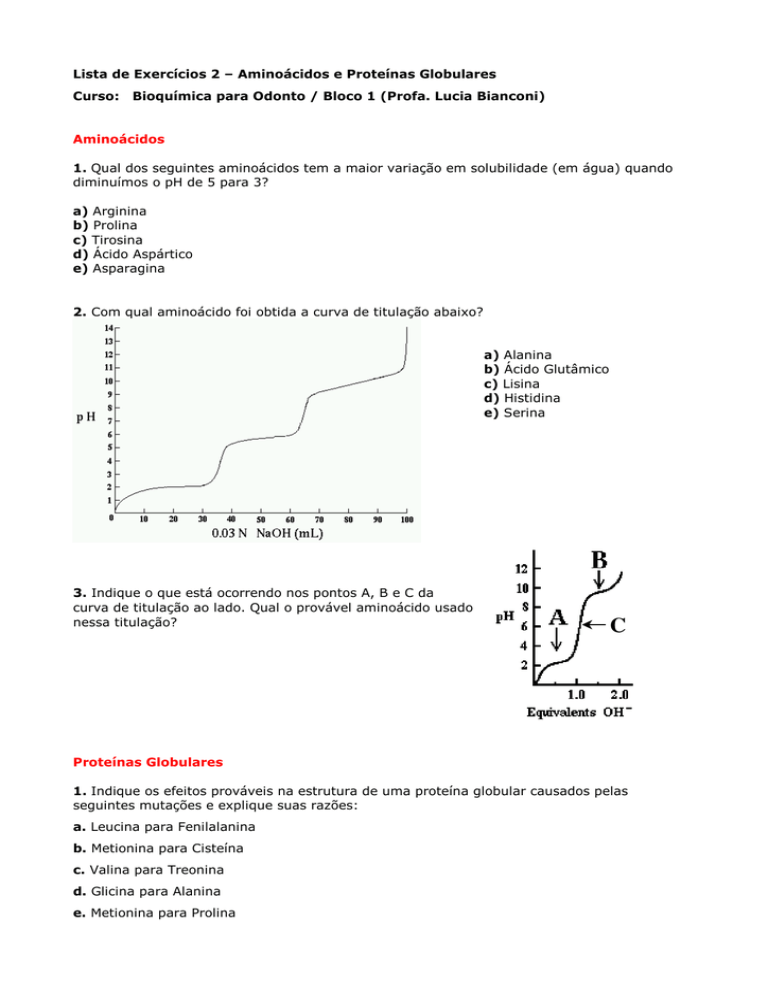
2. Com qual aminoácido foi obtida a curva de titulação abaixo?
a) Alanina
b) Ácido Glutâmico
c) Lisina
d) Histidina
e) Serina
3. Indique o que está ocorrendo nos pontos A, B e C da
curva de titulação ao lado. Qual o provável aminoácido usado
nessa titulação?
C
Proteínas Globulares
1. Indique os efeitos prováveis na estrutura de uma proteína globular causados pelas
seguintes mutações e explique suas razões:
a. Leucina para Fenilalanina
b. Metionina para Cisteína
c. Valina para Treonina
d. Glicina para Alanina
e. Metionina para Prolina
2. Dado os seguintes polipeptídeos:
I. Ala-Phe-Tyr-Phe-Ala-Met-Gly-Ser-Trp-Gly-Thr
II. Ala-Glu-Phe-Met-Ile-Arg-Val-Cys-Leu-Ala-Pro-Gly-Met
a. Que tipo de estrutura secundária seria mais provavelmente encontrada para cada
polipeptídeo? Explique.
b. Qual a consequência na estrutura do peptídeo II se fosse provocada uma mutação e o
resíduo de Arg fosse trocado por Asp?
c. Explique como a presença de um resíduo de Pro no peptídeo II possibilita a formação de
uma dobra-β.
3. A termolisina é uma protease (enzima que degrada proteínas) que contém um íon de Zn2+
essencial para sua função. A posição correta desse íon na proteína é mantida pela interação
com as cadeias laterais de três resíduos de aminoácidos: H142, H146 e E166.
a) Descreva a proteína em termos estruturais (estrutura secundária e terciária).
b) Explique como os aminoácidos em posições distantes da cadeia polipeptídica (142, 146 e
166) podem manter a interação com o Zn2+, com distâncias de poucos ângstroms entre eles.
H142
H146
E166
4. A alfa1-antitripsina (AAT) é uma proteína de 52 kDa sintetizada no fígado, que atua como
um inibidor natural de proteases (enzimas que degradam proteínas). A deficiência em AAT
leva à enfisema pulmonar e cirrose hepática.
A enfisema pulmonar ocorre porque a AAT é um inibidor responsável por inativar a
elastase, uma protease que degrada elastina, que é a proteína responsável pela elasticidade
do tecido pulmonar.
A deficiência em AAT é causada pela mutação pontual E342K, ou seja, o resíduo de glutamato
(E) na posição 342 foi trocado por um resíduo de lisina (K). Como consequência da mutação,
a proteína se agrega no fígado, onde é sintetizada, levando à cirrose hepática.
Discuta as causas da agregação da proteína mutante quando ela é sintetizada.
5. Muitas doenças degenerativas, como o Mal de Alzheimer, a Doença de Parkinson, a Doença
de Huntington, a Esclerose Lateral Amiotrófica e a Doença do Príon (vaca louca), são causadas
por agregação protéica. Os agregados (amilóides ou placas amiloidogênicas) são formados por
fibras protéicas, contendo uma proteína com estrutura em folhas-β. A conformação original da
proteína é em alfa-hélice e a mudança da conformação de alfa para beta leva à agregação da
molécula. EXPLIQUE porque a proteína não agrega na sua forma original e porque ela agrega
quando ocorre a mudança conformacional αβ.