Mestrado Integrado em Medicina Veterinária
Metabolismo de aminoácidos
1. Reações chave do metabolismo de aminoácidos
1.1 Transaminases
1.2. Glutamato desidrogenase
1.3. Glutamina sintetase e glutaminase
2. Transporte de azoto para o fígado e rins
Vítor Costa: [email protected]
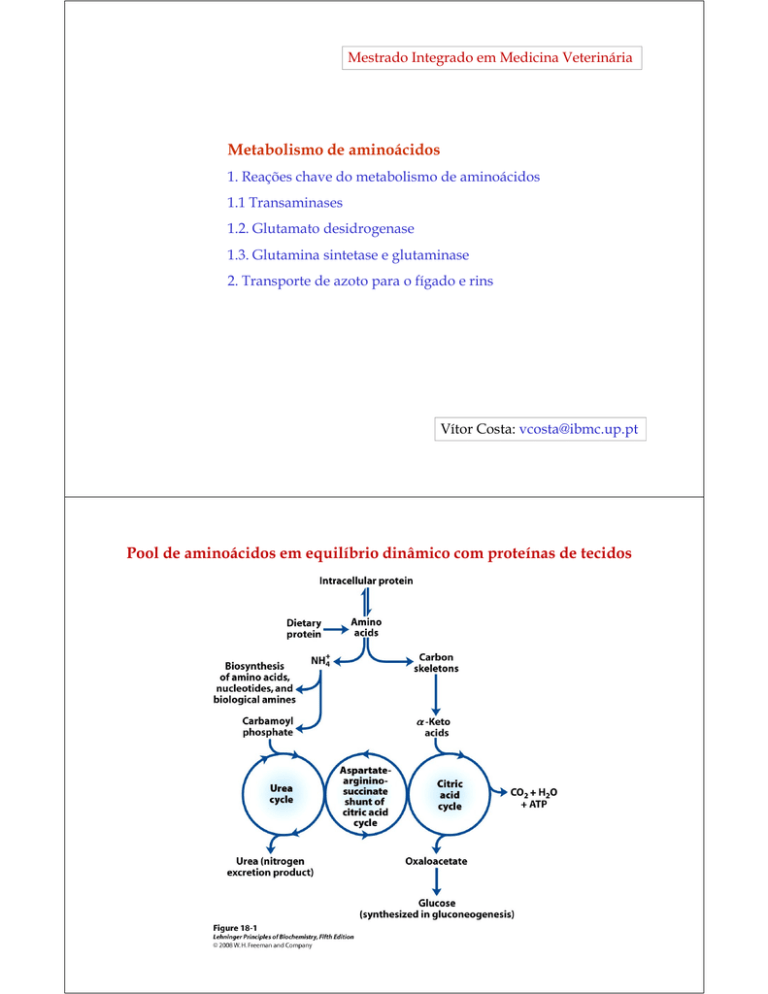
Pool de aminoácidos em equilíbrio dinâmico com proteínas de tecidos
Condições metabólicas em que os aminoácidos são degradados
1. Durante o turnover de proteínas (síntese e degradação de proteínas celulares),
alguns aminoácidos libertados durante a degradação de proteínas não são
necessários para a síntese de novas proteínas e são oxidados
2. Quando a dieta é rica em proteínas, os aminoácidos em excesso (relativamente
às necessidades para a síntese de proteínas) são oxidados. Os aminoácidos não
podem ser armazenados.
3. Durante o jejum ou na situação de diabetes mellitus não controlada, as
proteínas celulares são usadas para produção de energia.
Carnívoros podem obter (após uma refeição) até 90% das necessidades
energéticas por oxidação de aminoácidos, enquanto que os herbívoros
apenas produzem uma pequena fração de energia por esta via.
Catabolismo do grupo amino
A maioria dos aminoácidos são
metabolizados no fígado.
Alguma amónia produzida é
reciclada e usada na biossíntese
de outros compostos.
O excesso de amónia é excretado
diretamente ou convertido em
ureia ou ácido úrico.
Amónia em excesso gerada em
tecidos extrahepáticos é
transportada para o fígado (sob a
forma de Ala ou Gln).
Formas de excreção do azoto dos aminoácidos
Transaminases (ou aminotransferases)
- catalisam a transferência do grupo α-amino de um aminoácido para o
α-cetoglutarato
- grupo prostético: piridoxal fosfato (PLP; derivado da vitamina B6)
Nome da enzima em função
do aminoácido dador do
grupo amino – por ex:
• Alanina transaminase
• Aspartato transaminase
Alanina transaminase ou Alanina aminotransferase
Transaminação de aminoácidos essenciais
normalmente unidirecional
treonina e lisina não participam em reações de transaminação
exceção em terapêutica: em situações de hiperamonémia (ex.
devido a disfunção hepática), os aminoácidos da dieta são
substituídos por α-cetoácidos análogos – por exemplo: valina pode ser
gerada a partir de α–cetoisovalerato administrado terapeuticamente:
NH4+
Remoção de amónia pela
glutamato desidrogenase
Transaminases
enzimas citosólicas / mitocondriais relativamente estáveis
atividade facilmente quantificada interesse clínico:
conc. sérica proporcional ao grau de lesão do
fígado (muito rico em transaminases)
usadas para síntese / degradação de aminoácidos
durante a degradação de amino ácidos, os grupos amino são
transferidos para o α-cetoglutarato
Glutamato desidrogenase
• local: mitocôndria
• reação reversível:
remoção de amónia (adicionada ao α-cetoglutarato, produzindo glutamato)
desaminação oxidativa do glutamato produz amónia quando os aminoácidos
são necessários como precursores de glucose ou para obtenção de energia;
NADH aproveitado para produção de ATP
Amónia livre é tóxica convertida em compostos não tóxicos antes de
ser exportada dos tecidos extrahepáticos para o fígado e rins
Glutamina
sintetase
• Nos tecidos, a glutamina é sintetizada e
transportada para o fígado
• No fígado, a amónia é libertada
pela glutaminase
• 50% dos aminoácidos em circulação são
glutamina (transportador de amónia)
Ciclo da alanina-glucose
Nos músculos e outros tecidos que degradam
aminoácidos para produção de energia:
os grupos amino são transferidos para o αcetoglutarato por transaminação.
o glutamato pode:
• ser convertido em glutamina
• transferir o grupo amino para piruvato pela
alanina transaminase, gerando alanina
(outro transportador de grupos amino)
No fígado, a alanina transaminase transfere o
grupo amino da alanina para o αcetoglutarato, formando:
piruvato - segue para a gluconeogénese
glutamato – na mitocôndria:
• sofre desaminação oxidativa (liberta
amónia)
• ou é transaminado com oxaloacetato, para
produzir aspartato (necessário para a
síntese de ureia)
Catabolismo de amino ácidos - remoção do grupo amino
(a) via da transdeaminação
amino ácido
+
α-cetoglutarato
aminotransferase
glutamato
desidrogenase
glutamato
cetoácido
+
glutamato
α-cetoglutarato
+
NH4+
ciclo da
ureia
Catabolismo de amino ácidos - remoção do grupo amino
(b) via da transaminação
amino ácido
+
α-cetoglutarato
glutamato
+
oxaloacetato
aminotransferase
aspartato
aminotransferase
cetoácido
+
glutamato
α-cetoglutarato
+
aspartato
ciclo da
ureia
Proteólise muscular e
transporte de azoto
Glucagon / cortisol
+
mobilização de aminoácidos
dos músculos (por ex., em
condições de jejum, trauma)
Alguma glutamina e alanina
são captadas pelos rins
excreção amónia
Quando ocorre acidose:
• a glutamina é transportada
do fígado para os rins para
poupar bicarbonato
• a captação de glutamina
pelo fígado é inibida
Metabolismo de aminoácidos
3. Ciclo da ureia
3.1. síntese de ureia
3.2. regulação do ciclo da ureia
3.3. doenças metabólicas
3.4. toxicidade da amónia e terapias
Vantagens em produzir ureia
Amónia é extremamente tóxica
provoca tremores
afecta fala / visão
provoca danos irreversiveis no cérebro
Nota: alguma amónia é produzida no lúmen intestinal durante oxidação
de aminoácidos por bactérias e chega ao fígado via veia porta
Ureia
molécula pequena, não carregada, e solúvel em água
UREIA
NH2-CO-NH2
atravessa facilmente membranas e é excretada na urina
NH4+
50% peso é azoto
Sintetizada nos hepatócitos
• 2 reações na mitocôndria
• 3 reações no citosol
Ciclo da ureia:
aspartato
Ciclo da ureia
Ciclo da ureia – interligação com ciclo de Krebs
4
3
2
1
1- ornitina transcarbamoilase
2- argininosuccinato sintetase
3- argininosuccinato liase
4- arginase
Balanço energético da síntese de ureia: 1 ATP / ureia
NH4+ + HCO3- + 2ATP
citrulina + aspartato + ATP
malato + NAD+
carbamoil fosfato + 2 ADP + Pi
argininosuccinato + AMP + 2Pi
oxaloacetato + NADH + H+
3ATP
Regulação do ciclo da ureia
(a) curto prazo
glutamato + acetil-CoA
Arg
+
(b) longo prazo
• dieta rica em proteínas
• jejum prolongado proteólise muscular
N-acetilglutamato
sintetase
N-acetilglutamato
+
Carbamoil fosfato sintetase I
Síntese da carbamoil fosfato sintetase I e
enzimas do ciclo da ureia
Deficiência em enzimas do ciclo da ureia
Enzima
Fenótipo
N-acetilglutamato sintetase
hiperamonémia
carbamoil fosfato sintetase
hiperamonémia
ornitina transcarbamoilase
orotato no sangue
argininosuccinato sintetase
citrulina no sangue
argininosuccinato liase
excreção de argininosuccinato
arginase
excreção de arginina
Mecanismo proposto para a toxicidade da amónia
(cérebro e sistema nervoso central)
NADPH NADP+
α-cetoglutarato
GDH
NH4+
α-cetoglutarato
glutamato
glutamina
NH4+
ciclo de Krebs
ATP
glutamato (e seu derivado, o GABA; neurotransmissores)
glutamina
danos (mec. desconhecido)
Deficiência em enzimas do ciclo da ureia: Terapias
1. Diminuição de proteínas ingeridas e uso de α-cetoácidos
- aminoácidos (essenciais) substituídos por α-cetoácidos equivalentes
glutamato
NH4+
α-cetoglutarato
2. Uso de compostos que acidificam o intestino:
- ex. levulose, um dissacárido fracamente absorvido, é metabolizado pelas
bactérias formando produtos ácidos amónia protonada e excretada nas
fezes
3. Antibióticos contra bactérias produtoras de amónia
Deficiência em enzimas do ciclo da ureia: Terapias
4. Eliminação de amónia em excesso :
- compostos (ex., benzoato e fenilbutirato) que se ligam covalentemente a
aminoácidos, (glicina, glutamina) e são excretadas na urina
- a regeneração desses aminoácidos gasta amónia
Deficiência em enzimas do ciclo da ureia: Terapias
5. Carbamoil glutamato:
- análogo do N-acetilglutamato
- ativador da carbamoil-fosfato sintetase I
6. Arginina
- ativador da N-acetilglutamato sintetase
- exceto quando há deficiência em arginase – tem de
ser excluído da dieta