Bioquimica Fisiológica
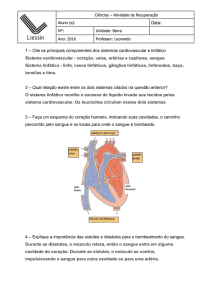
Metabolismo das Proteinas
Metabolismo das
Proteinas
Proteínas
degradação
Aminoácidos
desaminação
NH3
Glutamato
nos tecidos
Ureia
síntese
transporte p/
fígado
NH3
Glutamina
− O nitrogénio atmosférico, antes de ser utilizado pelos animais tem que ser
reduzido de N2 a NH3 (por microorganismos, plantas e descarga eléctrica)
e assim pode ser incorporado em aminoácidos e proteínas.
− Os seres humanos apenas conseguem sintetizar 11 dos 20 aminoácidos
necessários para a síntese de proteínas.
Renovação Proteica
As proteínas corporais estão em constante síntese e degradação (cerca de
1-2%, sobretudo de origem muscular). Os esqueletos de carbono dos AA são
degradados a metabolitos anfibólicos.
Balanço azotado: existe quando um adulto saudável com uma dieta variada
ingere a mesma quantidade de azoto que excreta.
Balanço Azotado = Aporte de N – Perda de N
ingesta
urina, fezes, transpiração
Balanço azotado negativo: é excretado mais azoto que ingerido. Ocorre em
jejum e no envelhecimento, em que as cadeias de carbono dos aminoácidos
são necessárias para a gliconeogénese e a amónia libertada é excretada na
ureia e não é incorporada.
Aporte < Saida
Balanço azotado positivo: a incorporação de aminoácidos em proteínas é
maior que a sua quebra, ocorrendo em períodos de crescimento corporal das
crianças e adolescentes, na gravidez e na alimentação após o jejum.
Aporte > Saida
Págian 1 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
Degradação Proteica
A degradação varia com o tipo de proteína e estado fisiológico, dependo de
proteases e peptidases (ATP dependentes ou independentes).
Existem 3 tipos de mecanismos (2 no citosol e o restante nos lisossomas)
1. As proteínas intracelulares de meia-vida curta e anormais são
degradadas no citosol, após identificação e fixação a um oligopéptido,
a ubiquitina, sendo a proteólise catalisada por um complexo protease
26S ATP-dependente;
Ubiquitina
Ubiquitina
Proteina
Proteina-Ubiquitina
ATP AMP+PPi
aminoácidos
nATP
nAMP+PPi
2. As proteínas da membrana, extracelulares ou de meia-vida longa são
degradadas nos lisossomas por catepsinas (ATP-independentes) após
endocitose.
3. A outra modalidade de degradação proteica extra-lisossomal envolve
enzimas Ca2+-dependentes.
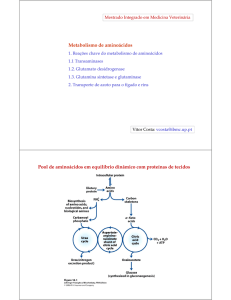
Aminoácidos
Origens:
Alimentação
Degradação proteica
Derivados não-proteicos
Destinos:
Biossíntese proteica
Aminação de cetoácidos
Oxidação metabólica do esqueleto carbonado
(aa cetogénicos e glicogénicos)
Regeneração da glicose
Velocidade (rate) de degradação
As proteínas são degradadas a diferentes velocidades, de acordo com as
necessidades fisiológicas
Elevado ritmo de degradação tecidos em rearranjo estrutural (p/ ex. útero
durante a gravidez; músculo esquelético na subnutrição grave)
Susceptibilidade de uma proteína à degradação semi-vida da proteína (t1/2)
tempo que decorre até à redução da quantidade inicial de proteína para
metade.
Págian 2 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
Catabolismo Geral dos Aminoácidos
− Cerca de 75% dos aminoácidos provenientes da degradação proteica são
reutilizados na síntese proteica;
− Os restantes perdem o seu grupo amina para formar α-cetoácidos, os
esqueletos de carbono dos aminoácidos. Os α-cetoácidos podem ser
oxidados a CO2 e H2O ou fornecer unidades de 3 a 4 C que podem ser
convertidas em glicose pela gliconeogénese;
− A degradação oxidativa de aminoácidos pode ocorrer em 3 diferentes
circunstâncias metabólicas:
1. Durante a síntese e degradação normal de proteínas celulares; alguns
aminoácidos libertados durante a quebra de proteínas podem ser
oxidados se não forem necessários para novas sínteses proteicas.
2. Quando uma dieta é rica em proteínas e a quantidade de aminoácidos
excede a necessária para síntese o excesso é catabolizado; os
aminoácidos não podem ser armazenados.
3. Durante o jejum ou nos diabetes mellitus, quando os carbohidratos
estão indisponíveis ou a ser incorrectamente utilizados, as proteínas
celulares são utilizadas para a obtenção de energia.
Destinos metabólicos dos grupos amina:
− O excesso pode ser excretado directamente ou ser convertido em ureia ou
ácido úrico para excreção, dependendo do organismo.
− O excesso de amónia gerado em tecidos extrahepáticos viaja até ao
fígado, para ser convertido na forma em que é excretada.
− NH3 não é excretado sob a forma de NH4+ porque é tóxico para o
organismo e é altamente solúvel em água, pelo que originaria
rapidamente a desidratação nos animais terrestres.
glicose
75%
Proteínas
cetoácidos
aa
Corpos cetónicos
CO2 e H2O
25%
NH3
Ureia
Págian 3 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
1. Transaminação
− Assim que os aminoácidos chegam ao fígado, ocorre a remoção dos
grupos amina, promovida pelas aminotransferases ou transaminases.
− O grupo amina é transferido para o carbono α do cetoglutarato,
libertando o α-cetoácido análogo ao aminoácido.
− O efeito das reacções de transaminação é juntar os grupos amina de
diferentes aminoácidos na forma de L-glutamato.
− O glutamato funciona como dador de grupo amina para as vias
biossintéticas ou vias de excreção que levam à eliminação de produtos
nitrogenados.
− O esqueleto carbonado formado é utilizado em intermediários metabólicos
(acetil-CoA, piruvato, intermediários do ciclo de Krebs) com potencial de
formação de ácidos gordos, corpos cetónicos e glicose.
− Pares AA – KA:
Alanina – Piruvato
Glutamato – -cetoglutarato
Aspartato – Oxaloacetato
α-cetoglutarato + L-aminoacidos L-glutamato + α-cetoácido
aminotransferase
A transaminação de aa essenciais é indirecta, uma vez que o organismo
não consegue sintetizar o cetoácido correspondente.
Aminotransferase
Muitas são específicas para o α-cetoglutarato como grupo aceptor, mas
diferente na especificidade para os L-aminoácidos.
Todas as aminotrasnferases têm o fosfato piridoxal como grupo prostético
(derivado da vitamina B6).
Págian 4 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
2. Remoção dos grupos amina
2.1 Desaminação oxidante do glutamato
Nos hepatócitos, o glutamato é transportado do citosol para a mitocôndria,
onde sofre desaminação oxidativa, catalisada pela L-glutamato
desidrogenase.
Glutamato + NAD(P)+ α-cetoglutarato + NH4++ NAD(P)H + H+
L-glutamato desidrogenase
− A combinada acção de aminotransferases e glutamato desidrogenase é
referida como transdesaminação.
− O α-cetoglutarato formado pode ser utilizado no ciclo de Krebs e para
síntese de glicose.
Glutamato desidrogenase:
− Catalisa a reacção inversa, reacção da incorporação, apenas quando o
ião amónio está em excesso, por exemplo, na região perivenosa do
figado.
− A sua actividade é influenciada por uma complexa rede de moduladores
alostéricos
Moduladores positivos: GDP, ADP
Moduladores negativos: GTP, ATP
2.1 Desaminação por aminoácidos-oxidases:
− Processo irreversível
− 1º Ocorre uma desidrogenação do aminoácido a iminoácido, em que a
reacção catalisada por uma flavoproteína, e os 2 H retirados ao substrato
vão reduzir o FAD ou FMN.
− Depois o iminoácido hidrolisa-se em α-cetoácido e amoníaco.
− A coenzima reduzida é geralmente reoxidade pelo oxigénio molecular a
H2O.
− No entanto outros aceitadores de electrões podem permitir a reoxidação
do FADH2.
− As aminoácidos-oxidases são enzimas estereoespecíficas, e apenas as
aminoácido-oxidases L catalisam a desaminação oxidante dos
aminoácidos proteicos.
NH4+
Aminoácido
Iminoácido
FAD
α-cetoácidos
FADH2
Aminoácido Oxidases
Págian 5 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
3. Transporte e transformação do amoníaco
− A amónia é tóxica para os tecidos animais, e o excesso é convertido num
composto não tóxico antes de ser transportado dos tecidos extrahepáticos
para o fígado ou rins, pela circulação sanguínea.
− A amónia livre combina-se com o glutamato, originando glutamina pela
acção da glutamina sintetase, em 2 etapas:
γ-Glutamil P
L-Glutamato
ATP
ADP
Glutamina
NH4+
Pi
Glutamina Sintetase
− A glutamina em excesso em relação à necessária para biossíntese é
transportada no sangue para o fígado e rins para processamento.
− A amónia é apenas libertada nas mitocôndrias do fígado/rins, onde a
enzima glutaminase converte a glutamina a glutamato e NH4+.
− No fígado esta reacção fornece outra fonte de amónia que pode ser
utilizada para a síntese de ureia.
− O glutamato pode ser depois processado pela glutamato desidrogenase,
libertando mais amónia e produzindo esqueletos de carbono para
obtenção de energia.
Glutamato
Glutamina
H2O
NH4+
Glutaminase
Págian 6 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
Ciclo da glicose-alanina
− A alanina também desempenha um papel especial no transporte de
grupo amina para o fígado numa forma não tóxica
− O glutamato também pode transferir o seu grupo α-amina ao piruvato, um
produto prontamente disponível da glicose do músculo, pela acção da
alanina aminotransferase.
− A alanina formada passa para o sangue e viaja até ao fígado.
− No citosol dos hepatócitos, a alanina aminotransferase transfere o grupo
amina da alanina para o α-cetoglutarato, formando piruvato e glutamato.
− O glutamato entra na mitocôndria onde a reacção da glutamato
desidrogenase liberta NH4+, ou pode sofrer transaminação com o
oxaloacetato para formar aspartato, outro dador de azoto na síntese da
ureia.
− A utilização da alanina para transportar amónia do músculo esquelético
para o fígado é outro exemplo da economia intrínseca dos organismos
vivos.
Glicose
Glicose
Piruvato
Piruvato
Ureia
Lactato
α-aminoácido
NH3
α-cetoácido
Alanina
Alanina
Sangue
Figado
Músculo
A contracção vigorosa dos músculos, efectuada em condições anaeróbias, produz
piruvato e lactato (glicólise) e amónia (clivagem de proteínas). Estes produtos
regressam ao fígado, onde o piruvato e o lactato são incorporados na glicose, que
regressa aos músculos, e a amónia é convertida em ureia para excreção.
O ciclo da glicose-alanina, em conjunto com o ciclo de cori, realiza esta transacção.
O fardo energético da gliconeogénese é imposto então ao fígado sendo todo o ATP
disponível no músculo utilizado para a contracção muscular.
Em situação de hiperamoniémia:
esgotamento das reservas de glutamato utilização do -KG para sintetizar
novo glutamato depleção do ciclo de Krebs formação de oxaloacetato
a partir do piruvato por carboxilação (piruvato carboxicinase).
Consequências: menor energia disponível para os processos cerebrais;
glutamato é um importante neurotransmissor excitatório distúrbios do
funcionamento nervoso
Págian 7 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
4. Ciclo da Ureia
Ocorre em 2 compartimentos
3 aminoácidos: ornitina; citrulina; arginina
Intermediários do ciclo de Krebs: oxaloacetato, fumarato, cetoglutarato.
Gasto de 3 ATP por 2 NH4+ incorporados
− Nos organismo ureotélicos a amónia depositada nas mitocôndrias dos
hepatócitos é convertida em ureia no ciclo da ureia.
− A ureia passa para a corrente sanguínea e depois para o rim e é
excretado na urina.
− O ciclo da ureia começa na mitocondria do fígado, mas os 3 passos
subsequentes ocorrem no citosol; o ciclo ocorre em 2 compartimentos.
− O 1º grupo amina que entra no ciclo da ureia é derivado da amónia na
matriz mitocondrial.
− O fígado também recebe amónio, através da veia porta do intestino.
− O NH4+, qualquer que seja a fonte, é imediatamente usado em conjunto
com CO2 (como HCO3-) produzido na respiração mitocondrial para formar
carbamoil fosfato na matriz. Esta reacção ATP dependente é catalizada
pela carbamoil fosfato sintetase I, uma enzima reguladora.
NH4+ + HCO3- + 2ATP Carbamoil fosfato + 2ADP
carbamoil fosfato sintetase I
O carbomoil fosfato entra agora no ciclo da ureia, que tem 4 passos
enzimáticos:
1. O carbomoil fosfato doa o seu grupo carbamoil à ornitina para formar
citrulina, com libertação de Pi. A ornitina desempenha um papel
semelhante ao do oxaloacetato no Ciclo de Krebs, aceitando material
em cada volta do ciclo. A reacção é catalizada pela ornitina
transcarbamoilase e a citrulina resultante passa da mitocôndria ao
citosol
Carbamoil fosfato + ornitina citrulina
ornitina transcarbamoilase
2. O 2º grupo amina é introduzido pelo aspartato por uma condensação
entre o grupo amina do aspartato e o grupo carbonil da citrulina,
formando argininosuccinato. Esta reacção é catalizada pela
argininasuccinato sintetase, requer ATP e tem o citrulil-AMP como
intermediário
Citrulina + ATP citrulil-AMP + PPi + Aspartato argininasuccinato + AMP
Argininasuccinato sintetase
3. A argininasuccinato é então clivada reversívelmente pela
argininasuccinato liase, originanto arginina e fumarato (que entra
posteriormente na mitocôndria para servir como intermediário do CAC)
Argininasuccinato Arginina + Fumarato
Argininasuccinato liase
Págian 8 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
4. Por fim, a arginase cliva a arginina para formar ureia e ornitina. A
ornitina é transportada para a mitocôndria para iniciar outra volta do
ciclo da ureia.
Arginina + H2O Ureia + ornitina
Arginase
NH4+ + HCO32ATP
2ADP + Pi
Carbamoil-P
sintase I
Carbamoil-P
ATP
Pi + H2O
AMP + PPi
Citrulina
Aspartato
Ornitina
Transcarbamoilase
Arginina
succinato sintase
Ornitina
Arginase
Ureia
Argininosuccinato
α-cetoglutarato
glutamato
Oxaloacetato
Arginina
succinato liase
Arginina
Fumarato
Ciclo de Krebs
H2O
Enzimas do ciclo da ureia:
− São sintetizadas em elevados níveis de jejum ou em dietas com elevado
teor proteico.
− Numa pequena escala a regulação alostérica de pelos menos um enzimachave ajusta o fluxo através do ciclo da ureia.
− A 1ª enzima do ciclo é alostérica, activada pelo N-acetilglutamato, que é
sintetizada do acetil-CoA e glutamato pela N-acetilglutamato sintetase (e
que é activada pela arginina)
Se o ciclo da ureia for visto isoladamente a síntese de uma molécula de
ureia requer 4 grupos fosfato de alta energia (2ATP para fazer carbamoil
fosfato + 1ATP para síntese de argininasuccinato)
2NH4+ + HCO3- + 3ATP4- + H2O ureia + 2ADP3- + 4Pi + AMP2- + 5H+
Contudo, o ciclo da ureia também provoca a conversão de oxaloacetato
em fumarato (via aspartato) e a regeneração do oxaloacetato, que produz
NADH na reacção da malato desidrogenase
Págian 9 de 11
Bioquimica Fisiológica
Metabolismo das Proteinas
Relações entre o ciclo da ureia e o ciclo de Krebs
− O fumarato produzido na reacção de argininasuccinato liase,
intermediário do ciclo de Krebs, pode ser convertido a malato e a
oxaloacetato no citosol, e estes intermediários podem ser metabolizados
no citosol ou transportados para a mitocôndria, sendo utilizados no ciclo
de Krebs.
− O aspartato formado na mitocôndria por transaminação entre
oxaloacetato e glutamato pode ser transportado para o citosol, onde
serve como dador de azoto no ciclo da ureia na reacção catalizada pela
argininasuccinato sintetase.
− Estas reacções constituem o desvio aspartato-argininasuccinato, que
fornece ligações entre as vias separadas pelas quais os grupos amina e os
esqueletos de carbono são processados.
Problemas Metabólicos do Ciclo da Ureia
Todos os problemas do ciclo da ureia têm como consequência a intoxicação
por amónia e envolvem o mesmo tipo de sintomas: vómitos, evitamento de
alimentos ricos em proteínas, ataxia intermitente, irritabilidade, letargia e atraso
mental.
O tratamento das 5 patologias referidas seguidamente é também semelhante
dieta pobre em proteínas e repartida em várias pequenas refeições ao
longo do dia, para que não haja picos de amónia no sangue ao longo do dia.
Hiperamoniémia tipo I deficiência da carbamoil fosfato sintase I, hereditária,
da qual são conhecidos 24 tipos diferentes.
Hiperamoniémia tipo II defeito na ornitina transcarbamoilase, hereditária.
níveis de glutamina no sangue, LCR e urina consequência do da síntese
de glutamina, devido à acumulação de amónia nos tecidos.
Citrulinémia doença muito rara, defeito na argininossuccinato sintase.
Manifestações clínicas: excreção de citrulina na urina, citrulina no plasma e
LCR. O fornecimento de arginina aumenta a excreção de citrulina. O
fornecimento de benzoato transfere o azoto da amónia para o hipurato,
através da glicina.
Argininossuccinicacidúria doença muito rara, que consiste na ausência de
argininossuccinase. argininossuccinato (ArgSuc) no sangue, na urina e no
LCR, associado ao aparecimento de penugem em todo o corpo. A urina pode
também apresentar grânulos, constituídos por derivados cíclicos do ArgSuc.
Tem início precocemente (até aos 2A) e é fatal. Tal como na citrulinémia, a
administração de arginina e benzoato aumenta a excreção de azoto.
Hiperargininémia arginina no sangue e no LCR, arginase nos eritrócitos,
excreção de arginina, ornitina, lisina e cistina na urina ( lisina-cistinúria),
devida à competição entre a arginina, a lisina e a cistina na reabsorção
tubular renal. Tratamento dieta pobre em proteínas.
Págian 10 de 11
squema
formação
glutamina
suportada
pelo ciclo
Krebs
–
de
é
Bioquimica Fisiológica
Metabolismo das Proteinas
de
Glutaminólise intestinal
− A glutaminólise intestinal consiste na oxidação parcial da glutamina em
células que se dividem rapidamente, como os enterócitos.
− A glutamina é convertida a glutamato na matriz mitocondrial, passa
depois para o citosol, onde ocorre uma transaminação.
− Assim obtém-se energia e moléculas percursoras da síntese de pirimidinas e
purinas, necessários para estas células se dividirem rapidamente.
− Os carbonos e NH4+ formandos são libertados na corrente sanguínea na
forma de alanina.
− Uma das enzimas (glutamato redutase ATP-dependente) necessária para
exacta conversão existe apenas nos enterócitos.
Glutamina
Glutamina
NH4+
NH4+
Glutamato
Glutamato
Piruvato
Piruvato
CO2
α-cetoglutarato
CO2
Malato
CO2
Alanina
Acetil-CoA
Ciclo de
Krebs
Mitocôndria
α-cetoglutarato
Citosol
Págian 11 de 11