UNIVERSIDADE ESTADUAL DO CENTRO-OESTE - UNICENTRO
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
AVALIAÇÃO DO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA
ANFOTERICINA B
KETLLYN SIMONE VONCIK
GUARAPUAVA
2014
UNIVERSIDADE ESTADUAL DO CENTRO-OESTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
AVALIAÇÃO DO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA
ANFOTERICINA B
Ketllyn Simone Voncik
Dissertação apresentada ao programa de PósGraduação
em
Ciências
Farmacêuticas
da
Universidade Estadual do Centro-Oeste em
associação ampla com a Universidade Estadual
de Ponta Grossa, como requisito parcial para a
obtenção do Título de Mestre em Ciências
Farmacêuticas.
ORIENTADORA: JULIANA SARTORI BONINI
Guarapuava
2014
Catalogação na Publicação
Biblioteca Central da Unicentro, Campus Cedeteg
V945a
Voncik, Ketllyn Simone
Avaliação do efeito da curcumina sobre a toxicidade da Anfotericina B /
Ketllyn Simone Voncik. – – Guarapuava, 2014
xix, 78 f. : il. ; 28 cm
Dissertação (mestrado) - Universidade Estadual do Centro-Oeste, em
associação ampla com a Universidade Estadual de Ponta Grossa,
Programa de Pós-Graduação em Ciências Farmacêuticas, área de
concentração em Fármacos, Medicamentos e Biociências Aplicadas à
Farmácia, 2014
Orientadora: Juliana Sartori Bonini
Banca examinadora: Emerson Carraro, João Batista Teixeira da Rocha
Bibliografia
1. Ciências farmacêuticas. 2. Farmácia. 3. Anfotericina B. 4. Antifúngico.
5. Toxicidade. 6. Curcumina. I. Título. II. Programa de Pós-Graduação em
Ciências Farmacêuticas.
CDD 615
Dedico este trabalho a minha filha, minha razão de viver.
AGRADECIMENTOS
Agradeço inicialmente a minha orientadora Dra. Juliana Sartori Bonini pela
orientação, auxílio e incentivo.
Ao prof. Dr. Najeh e a professora Rubiana pelo empréstimo do laboratório, doação dos
fármacos e suporte na realização do trabalho.
Agradeço a Cassielli, Raíssa e Jheniffer por toda a ajuda, apoio, disposição, incentivo,
empenho, sem vocês seria impossível realizar esse trabalho. Vocês sacrificaram-se para que o
experimento fosse realizado, além de que vocês muito especiais e merecem toda minha
gratidão e respeito.
A Nathalia pelo auxílio na realização dos experimentos.
A Juliane Almeida pelo coleguismo durante as matérias do mestrado.
A professora Margarete Kimie Falbo pelo apoio, suporte e estímulo durante todo o
desenvolvimento deste trabalho e incentivo durante esses últimos três anos.
A Danielle Pivato pelo auxílio nos exames dos animais, por lavar os tubos, estar
sempre disposta a me ajudar.
A Karen Regina Lemos pela ajuda na realização deste trabalho, empréstimo da sala de
experimentação, laboratório, câmara de gás e microscópio.
Ao Professor Dr. Emerson Carraro, pelo incentivo, por tirar minhas dúvidas e me fazer
ver os problemas do experimento por outro ângulo, além do auxílio na confecção de artigo.
A professora Juliane Rossi pelo auxilio na aplicação do fármaco, mesmo sendo no
final de semana, por deixar o filho pequeno em casa para me ajudar.
A professora Luciana Camargo pelo apoio e auxílio.
Ao Professor Marco Aurélio Romano e Timothy Gustavo Cavazzotto pela ajuda nas
análises estatísticas.
A minha mãe pelo apoio emocional e financeiro, pelo carinho e estimulo.
A minha irmã pela ajuda na confecção da Dissertação.
Ao meu marido, por estar sempre ao meu lado, por seu amor e amizade, disposição em
me ajudar e principalmente por ser um homem que me instiga a ser uma pessoa melhor.
A minha filha, por me dar um motivo para crescer, me superar diariamente.
“A mente que se abre a uma nova ideia jamais voltará ao seu tamanho original.
(Albert Einstein)”
i
RESUMO
A Anfotericina B é um antibiótico macrolídeo utilizado contra infecções fúngicas
sistêmicas e leishmaniose. Devido ao aumento no número de pacientes imunossuprimidos e
da resistência aos fármacos antimicrobianos a Anfotericina está em foco, apesar de descoberta
em 1955 a droga tem sido usada com eficácia e com pouca resistência fúngica. A droga pode
apresenta toxicidade hepática, hematológica e renal, sendo necessário muitas vezes
descontinuar seu uso. A Curcumina é um pigmento natural que já foi utilizado em conjunto
com drogas nefrotóxicas e hepátotóxicas, amenizando seus efeitos. Foram realizados três
experimento que tinham como objetivo determinar a dose e o tempo de administração da
Anfotericina B que causam nefro, hepato e hematotoxicidade, bem como verificar a ação da
Curcumina sobre a toxicidade da droga, além das possíveis alterações causadas pelo uso da
Curcumina nos parâmetros bioquímicos, hematológicos e histopatológicos. O experimento
inicial foi uma Curva de dose e tempo de administração de Anfotericina B (20 mg/kg/10 dias,
40 mg/kg/10 dias, 80 mg/kg/10 dias, 20 mg/kg/30 dias, 40 mg/kg/30 dias, n=6) para averiguar
a dose tóxica. O segundo experimento consistiu na aplicação de Anfotericina B intravenosa (3
mg/kg) e administração de Curcumina via oral (100 mg/kg) por 5 dias (n=8). O terceiro
experimento consistiu na administração intravenosa de Anfotericina B desoxicolato (1 mg/kg)
e Curcumina (100 mg/kg) por 5 dias (n=10). Para verificar alterações hematológicas foram
realizados hemograma dos animais. A função renal foi avaliada através da mensuração da
uréia e creatinina sérica e a hepática pela quantificação da ALT e fosfatase alcalina. Foi
realizado exame histopatológico dos rins e fígados dos animais. Os resultados obtidos foram
descritos em média e desvio padrão e adotado o nível de significância de 5%. Foram
empregados os testes estatísticos Shapiro-Wilk e teste de Levene para homogeneidade das
variâncias dos grupos. Para as variáveis que não violaram o pressuposto de homogeneidade
foi empregado o teste ANOVA one way com post hoc de Bonferroni e para as que violaram
foi empregado o teste não paramétrico de Kruskal-Wallis com correção do valor de
significância para múltiplas comparações, seguido de teste de Dunnet. Na Curva de dose
ocorreram alterações hematológicas, em relação ao controle nos grupos 40 mg/kg/10 dias e 80
mg/kg/10 dias. No segundo experimento, grupo Anfotericina B diferiu de todos os grupos em
relação a uréia. No terceiro experimento foram observadas reações infusionais nos animais em
que foi aplicada a Anfotericina B desoxicolato, ocorrendo a morte de 50% dos animais
tratados com Anfotericina B desoxicolato e 30% dos tratados concomitantemente com
Anfotericina B desoxicolato e Curcumina, além de ser observada perda de peso nos animais
do grupo Anfotericina e Anfotericina/Curcumina. Há indícios de proteção do pigmento sobre
as reações agudas do fármaco, entretanto nesse experimento observaram-se alterações nos
parâmetros hematológicos (hematócrito, hemoglobina e número de hemácias) nos animais
tratados com Curcumina e Anfotericina B desoxicolato/Curcumina quando comparados com
os animais do grupo controle, fato que não foi observado no experimento anterior. Assim não
foi possível verificar a toxicidade hepática e renal da Anfotericina B, bem como a ação
protetora da Curcumina. Pode-se afirmar que a Curcumina não provocou alterações hepáticas
e renais, bem como no peso dos animais. Dessa forma novos estudos devem ser realizados
para verificar a atividade da Curcumina sobre as reações infusionais da Anfotericina B
desoxicolato e possíveis alterações hematológicas causadas pelo composto natural.
Palavras chave: Anfotericina B, antifúngico, toxicidade, Curcumina.
ii
ABSTRACT
Amphotericin B is a macrolide antibiotic used against systemic fungal infections and
leishmaniasis. Due to the increasing number of immunocompromised patients and resistance
to antimicrobial drugs Amphotericin is in focus, even though the drug discovery in 1955 has
been used effectively with little fungal resistance. The drug has hepatic, hematologic and
renal toxicity, and its use is often necessary to discontinue. Curcumin is a natural pigment that
has been used in conjunction with nephrotoxic and hepatotoxic drugs, mitigating their effects.
Three experiment that aimed to determine the dose and timing of administration of
Amphotericin B nephrotoxicity, hepato-and hematotoxicity and check the action of Curcumin
on the toxicity of the drug were performed in addition to the possible changes caused by the
use of curcumin in the biochemical, hematological and histopathological parameters. The
initial experiment was a curve of dose and time of administration of Amphotericin B ( 20
mg/kg/10 days , 40 mg/kg/10 days , 80 mg/kg/10 days , 20 mg/kg/30 days , 40 mg / kg/30
days, n = 6 ) to determine the toxic dose . The second experiment consisted in the application
of Amphotericin B intravenously (3 mg / kg) and oral administration of Curcumin (100 mg /
kg) for 5 days (n=8). The third experiment involved the intravenous administration of
Amphotericin B deoxycholate (1 mg / kg) and curcumin (100 mg / kg ) for 5 days (n = 10).
To check hematological changes of animals were performed. Renal function was assessed by
measurement of urea and serum creatinine and liver function by quantifying the ALT and
alkaline phosphatase. Histopathological examination of kidneys and livers of animals were
performed. The results were expressed as mean and standard deviation and the adopted
significance level of 5 %. Were employed statistic test Shapiro -Wilk and Levene test for
homogeneity of variances of the groups. For variables that did not violate the assumption of
homogeneity was employed one-way ANOVA and post hoc Bonferroni and the variables who
violated was used the nonparametric test Kruskal- Wallis with a significance value correction
for multiple comparisons, followed by test Dunnet. In Curve dose changes occurred in
hematological parameters, compared to the control groups in 40 mg/kg/10 days and 80
mg/kg/10 days. In the second experiment, Amphotericin B group of all groups differed with
respect to urea. In the third experiment infusion reactions were observed in animals in which
it was applied to Amphotericin B deoxycholate, occurring death in 50 % of animals treated
with Amphotericin B deoxycholate and 30% treated concomitantly with amphotericin B
deoxycholate and Curcumin. There are indications of protective pigment on acute drug
reactions, however this experiment we observed changes in hematological parameters
(hematocrit, hemoglobin and number of red blood cells) in animals treated with amphotericin
B deoxycholate and Curcumin / curcumin when compared with those of group control, a fact
that was not observed in the previous experiment. So it has not been possible to check liver
and kidney toxicity of Amphotericin B and the protective action of curcumin. It can be stated
that curcumin did not cause hepatic and renal changes as well as weight of the animals. This
new form studies should be conducted to verify the activity of Curcumin on infusion reactions
of Amphotericin B deoxycholate and possible hematological changes caused by natural
compound.
Key-words: Amphotericin B, antifungal, toxicity, curcumin
iii
LISTA DE FIGURAS
FIGURA 1. Mecanismo de ação da Anfotericina B na célula fúngica.
2
FIGURA 2. Estrutura química da Curcumina
6
FIGURA 3. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre o Hematócrito de ratos Wistar.
16
FIGURA 4. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre as hemácias de ratos Wistar.
17
FIGURA 5. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a hemoglobina de ratos Wistar.
17
FIGURA 6. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre os Leucócitos Totais de ratos Wistar.
20
FIGURA 7. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a proteína plasmática total de ratos Wistar.
21
FIGURA 8. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a creatinina sérica de ratos Wistar.
22
FIGURA 9. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a uréia de ratos Wistar.
23
FIGURA 10. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a ALT de ratos Wistar.
24
FIGURA 11. Curva de dose e Tempo de Anfotericina Intraperitoneal em
ratos sobre a FA de ratos Wistar.
25
FIGURA 12. Fotomicrografia do fígado (HE) do animal do grupo controle
(400x) do experimento da curva de dose e tempo de Anfotericina B
intraperitoneal.
26
FIGURA 13. Fotomicrografia do fígado (HE) do animal tratado com 20
mg/kg por 10 dias (400x) do experimento da curva de dose e tempo de
Anfotericina B intraperitoneal.
27
FIGURA 14. Fotomicrografia do fígado (HE) do animal tratado com 40
mg/kg por 10 dias (400x) do experimento da curva de dose e tempo de
Anfotericina B intraperitoneal.
27
FIGURA 15. Fotomicrografia do fígado (HE) do Animal tratado com 80
mg/kg por 10 dias (400x) do experimento da curva de dose e tempo de
Anfotericina B intraperitoneal.
28
FIGURA 16. Fotomicrografia do fígado (HE) do Animal tratado com 20
mg/kg por 30 dias (400x) do experimento da curva de dose e tempo de
Anfotericina B intraperitoneal.
28
iv
FIGURA 17. Fotomicrografia do fígado (HE) do Animal tratado com 40
mg/kg por 30 dias (400x) do experimento da curva de dose e tempo de
Anfotericina B intraperitoneal.
28
FIGURA 18. Fotomicrografia (HE) de Rim de animal controle do
experimento de curva de dose e tempo de Anfotericina B intraperitoneal
(400x).
30
FIGURA 19. Fotomicrografia (HE) de Rim de animal do experimento de
curva de dose e tempo de Anfotericina B intraperitoneal tratado com 20
mg/kg por 10 dias (400x).
30
FIGURA 20. Fotomicrografia (HE) de Rim de animal do experimento de
curva de dose e tempo de Anfotericina B intraperitoneal tratado com 40
mg/kg por 10 dias (400x).
31
FIGURA 21. Fotomicrografia (HE) de Rim de animal do experimento de
curva de dose e tempo de Anfotericina B intraperitoneal tratado com 80
mg/kg por 10 dias (400x).
31
FIGURA 22. Fotomicrografia (HE) de Rim de animal do experimento de
curva de dose e tempo de Anfotericina B intraperitoneal tratado com 20
mg/kg por 30 dias (400x).
32
FIGURA 23. Fotomicrografia (HE) de Rim de animal do experimento de
curva de dose e tempo de Anfotericina B intraperitoneal tratado com 40
mg/kg por 30 dias (400x).
32
FIGURA 24. Hematócrito de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
34
FIGURA 25. Hemácias totais de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
34
FIGURA 26. Hemoglobina de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
35
FIGURA 27. Leucócitos Totais de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
36
FIGURA 28. Proteína plasmática Total de ratos Wistar tratados com
Anfotericina B intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral
por 5 dias.
36
FIGURA 29. Creatinina Sérica de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
37
FIGURA 30. Uréia Sérica de ratos Wistar tratados com Anfotericina B
intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
38
FIGURA 31. ALT de ratos Wistar tratados com Anfotericina B intravenosa
(3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
39
FIGURA 32. Fosfatase Alcalina de ratos Wistar tratados com Anfotericina
39
v
B intravenosa (3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
FIGURA 33. Fotomicrografia (HE-400x) do fígado de animal controle do
experimento do efeito da Curcumina (100mg/kg) via oral sobre a toxicidade
da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
40
FIGURA 34. Fotomicrografia (HE-400x) do fígado de animal tratado com
Curcumina do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
41
FIGURA 35. Fotomicrografia (HE-400X) do fígado de animal tratado com
Anfotericina B do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
41
FIGURA 36. Fotomicrografia (HE-400X) do fígado de animal tratado com
Anfotericina B e Curcumina do experimento do efeito da Curcumina
(100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via
intravenosa por 5 dias.
42
FIGURA 37. Fotomicrografia (HE-400X) do rim de animal do grupo
controle do experimento do efeito da Curcumina (100mg/kg) via oral sobre a
toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
43
FIGURA 38. Fotomicrografia (HE-400X) do rim de animal do grupo
Curcumina do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
43
FIGURA 39. Fotomicrografia (HE-400X) do rim de animal do grupo
Anfotericina B do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
44
FIGURA 40. Fotomicrografia (HE-400X) do rim de animal do grupo
Anfotericina B e Curcumina do experimento do efeito da Curcumina
(100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via
intravenosa por 5 dias.
44
FIGURA 41. Fluxograma do Experimento de Anfotericina B desoxicolato
(1mg/kg/IV) e Curcumina (100mg/kg/VO) indicando o numero de animais
em cada grupo, nos respectivos dias do experimento.
45
FIGURA 42. Fotografia de animal tratado com Anfotericina B desoxicolato
(1mg/kg intravenoso).
46
FIGURA 43. Hematócrito de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
5 dias.
48
FIGURA 44. Hemacias de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
5 dias.
48
FIGURA 45. Hemoglobina de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
49
vi
5 dias.
FIGURA 46. Leucócitos Totais de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
5 dias.
50
FIGURA 47. Proteína Plasmática de ratos Wistar tratados com Anfotericina
B desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral
por 5 dias.
51
FIGURA 48. Creatinina Sérica de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
5 dias.
52
FIGURA 49. Uréia serica de ratos Wistar tratados com Anfotericina B
desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por
5 dias.
53
FIGURA 50. ALT de ratos Wistar tratados com Anfotericina B desoxicolato
intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias.
54
FIGURA 51. Fosfatase Alcalina de ratos Wistar tratados com Anfotericina
B desoxicolato intravenosa (1mg/kg) e Curcumina (100mg/kg) por via oral
por 5 dias.
55
FIGURA 52. Fotomicrografia (HE-100x) do fígado de animal do grupo
controle do experimento do efeito da Curcumina (100mg/kg) via oral sobre a
toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por 5
dias. Sem sinais de alterações hepáticas.
56
FIGURA 53. Fotomicrografia (HE-100x) do fígado de animal do grupo
Curcumina do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa
por 5 dias. Sem sinais de alterações hepáticas.
56
FIGURA 54. Fotomicrografia (HE-100x) do fígado de animal do grupo
Anfotericina B desoxicolato do experimento do efeito da Curcumina
(100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato
(1mg/kg) via intravenosa por 5 dias. Sem sinais de alterações hepáticas.
57
FIGURA 55. Fotomicrografia (HE-100x) do fígado de animal do grupo
Anfotericina B/Curcumina do experimento do efeito da Curcumina
(100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato
(1mg/kg) via intravenosa por 5 dias. Sem sinais de alterações hepáticas.
57
FIGURA 56. Fotomicrografia (HE-100x) do rim de animal do grupo
controle do experimento do efeito da Curcumina (100mg/kg) via oral sobre a
toxicidade da Anfotericina B desoxicolato (1 mg/kg) via intravenosa por 5
dias.
58
FIGURA 57. Fotomicrografia (HE-100x) do rim de animal do grupo
Curcumina do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa
59
vii
por 5 dias.
FIGURA 58. Fotomicrografia (HE-100x) do rim de animal do grupo
Anfotericina B do experimento do efeito da Curcumina (100mg/kg) via oral
sobre a toxicidade da Anfotericina B desoxicolato (1 mg/kg) via intravenosa
por 5 dias.
59
FIGURA 59. Fotomicrografia (HE-100x) do rim de animal do grupo
Anfotericina B/Curcumina do experimento do efeito da Curcumina
(100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato
(1mg/kg) via intravenosa por 5 dias.
60
FIGURA 60. Peso dos animais ao longo do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B
desoxicolato (1mg/kg) via intravenosa por 5 dias.
61
viii
LISTA DE TABELAS
TABELA 1. Experimentos utilizando Anfotericina B, doses, espécie animal
e via de administração e tempo de administração.
19
TABELA 2. Peso dos animais ao longo do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B
desoxicolato (1mg/kg) via intravenosa por 5 dias.
62
ix
LISTA DE ABREVIATURAS
DP
Desvio padrão
EDTA
Ácido etilenodiamino tetra-acético
dL
decilitro
g
gramas
HIV
Vírus da Imunodeficiência humana
IP
intraperitoneal
IV
intravenoso
mL
Mililitro
mg
miligrama
mg/kg
miligramas por kilogramas
nm
Nano Metro
VO
via oral
rpm
rotação por minuto
UI/L
unidades internacionais por litro
°C
graus Celsius
μL
microlitro
µM
mili Molar
SUMÁRIO
1. INTRODUÇÃO .................................................................................................................................. 1
1.1 ANFOTERICINA B .......................................................................................................................... 1
1.2 CURCUMINA .................................................................................................................................. 5
2 OBJETIVOS ........................................................................................................................................ 8
2.1 OBJETIVOS GERAIS ...................................................................................................................... 8
2.2 OBJETIVOS ESPECÍFICOS ............................................................................................................ 8
3 METODOLOGIA ................................................................................................................................ 9
3.1 ANIMAIS .......................................................................................................................................... 9
3.2 FÁRMACOS, VEÍCULOS E KITS .................................................................................................. 9
3.3 EXPERIMENTOS .......................................................................................................................... 10
3.3.1 Curva de Dose e Tempo de Anfotericina B Intraperitoneal (EXPERIMENTO A). .................... 10
3.3.2 Efeito da Curcumina Sobre a Toxicidade da Anfotericina B intravenosa (EXPERIMENTO B). 10
3.3.3 Efeito da Curcumina Sobre a Toxicidade da Anfotericina B intravenosa Anforin ®
(EXPERIMENTO C). ........................................................................................................................... 11
3.4 HEMOGRAMA .............................................................................................................................. 11
3.5 EXAMES BIOQUÍMICOS ............................................................................................................. 12
3.5.1 Atividade da enzima Alanina Aminotransferase (ALT) .............................................................. 13
3.5.2 Dosagem de Uréia ........................................................................................................................ 13
3.5.3 Dosagem de Creatinina ................................................................................................................ 14
3.5.4 Dosagem de Fosfatase Alcalina ................................................................................................... 14
3.6 EXAMES HISTOPATOLÓGICOS ................................................................................................ 14
4. ANÁLISE ESTATÍSTICA ............................................................................................................... 15
5. RESULTADOS E DISCUSSÃO ...................................................................................................... 16
5.1. CURVA DE DOSE E TEMPO DE ANFOTERICINA B INTRAPERITONEAL
(EXPERIMENTO A). ........................................................................................................................... 16
5.1.1 Parâmetros Hematológicos ........................................................................................................... 16
5.1.2 Parâmetros Bioquímicos Renais................................................................................................... 21
5.1.3 Parâmetros Bioquímicos Hepáticos ............................................................................................. 23
5.1.4 Análises Histopatológicas ............................................................................................................ 26
5.2. EXPERIMENTO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA ANFOTERICINA
B INTRAVENOSA (EXPERIMENTO B). .......................................................................................... 33
5.2.1 Parâmetros Hematológicos ........................................................................................................... 33
5.2.2 Parâmetros Bioquímicos Renais................................................................................................... 37
5.2.3 Parâmetros Bioquímicos Hepáticos ............................................................................................. 38
5.2.4 Exames Histopatológicos ............................................................................................................. 40
5.3. EXPERIMENTO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA ANFOTERICINA
B INTRAVENOSA ANFORIN (EXPERIMENTO C)......................................................................... 45
5.3.1 Parâmetros Hematológicos ........................................................................................................... 47
5.3.2 Parâmetros Bioquímicos Renais................................................................................................... 51
5.3.3 Parâmetros Bioquímicos Hepáticos ............................................................................................. 53
5.3.4 Exames Histopatológicos ............................................................................................................. 55
5.3.5 Peso Corporal ............................................................................................................................... 60
CONSIDERAÇÕES FINAIS ................................................................................................................ 64
CONCLUSÃO ...................................................................................................................................... 66
REFERÊNCIAS .................................................................................................................................... 67
ANEXO 1. ............................................................................................................................................. 78
1
1. INTRODUÇÃO
1.1 ANFOTERICINA B
A Anfotericina B é um antibiótico macrolídeo poliênico que possui atividade
antifúgica, sendo o tratamento de escolha para infecções fúngicas sistêmicas e parasitárias
como a Leishmaniose. Foi isolado pela primeira vez em 1955 da bactéria Streptomyces
nodosus sp., na Venezuela (CHATTOPADHYAY e JAFURULLA, 2011).
A Anfotericina B é ativa contra as espécies Candida, Cryptococcus neoformans,
Aspergillus spp., Histoplasma spp., Paracoccidiodes spp., Blastomyces spp. e Coccidioides
spp.(MICELI e CHANDRASEKAR, 2012). As infecções fúngicas sistêmicas tem alta
morbidade e mortalidade, atingindo principalmente pacientes imunossuprimidos como
portadores da AIDS, pacientes transplantados, com doenças hematológicas, tratados com
corticosteroides ou em quimioterapia (CHATTOPADHYAY e JAFURULLA, 2011;
ROSANOVA et al., 2011).
Em 2010, de acordo com a Organização Mundial da Saúde, existiam
aproximadamente 34 milhões de pessoas portadoras do vírus da AIDS (Síndrome de
Imunodeficiência Adquirida), ocorrendo cerca de 7000 infecções diária pelo vírus, tratando-se
de uma doença crescente, que pode causar imunossupressão. A criptococose sistêmica é um
dos exemplos de infecções fúngicas que atingem pacientes imunossuprimidos principalmente
portadores da AIDS, constituindo uma importante causa de morte desta população. Segundo
Falci (2009) 6% dos casos de AIDS no Brasil foram notificados com criptococose,
apresentando uma mortalidade de 45 a 65%.
Em 1999 foram registradas 2673 mortes por AIDS e 57 por Leishamaniose a nível
mundial (MRAZEK e MOSSIALOS, 2003).
A Anfotericina B é atualmente utilizada no tratamento da Leishmaniose, uma doença
que atinge principalmente países em desenvolvimento, sendo muitas vezes negligenciada. Na
Índia são tratados muitos casos da doença, sendo gastos 467 dólares por paciente com a droga
e 1.613 dólares para o tratamento com a forma lipossomal da Anfotericina B, dessa forma fazse necessário encontrar uma forma de minimizar os efeitos tóxicos da droga e gerar um menor
impacto econômico (CARVALHO, 2009).
As maiores limitações para utilização da Anfotericina são a baixa solubilidade do
fármaco, sua baixa bioviabilidade por via oral, o que limita sua administração à ambientes
2
hospitalares, e seus efeitos tóxicos, principalmente relacionados ao rim (LEON et al., 2011;
SIVAK et al., 2011).
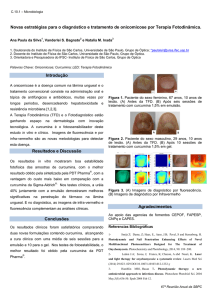
O mecanismo de ação do fármaco ainda não foi totalmente elucidado, entretanto a
hipótese mais aceita é que ocorre sua ligação com ao ergosterol da célula fúngica formando
poros permeáveis aos íons (FIGURA 1) (KIM et al., 2012). Pelos poros ocorre um influxo de
sódio e efluxo de potássio, ativando a bomba de sódio/potássio, gerando gasto de energia.
Ocorre aumento da respiração mitocondrial para suprir esse gasto, com isso eleva-se o
consumo de oxigênio. (WHITE, MARR e BOWDEN, 1998). Ocorre acúmulo de cálcio
intracelular. Essas alterações na membrana celular causam desequilíbrio na célula a
conduzindo a apoptose. (VARLAM et al., 2001).
Além da alteração na membrana a Anfotericina B, a atividade antifúngica da droga
também está relacionada com o estresse oxidativo, em que o fármaco promove a geração de
espécies reativas a oxigênio, causando oxidação proteica e peroxidação fosfolipídica da
membrana celular (AN et al., 2009).
FIGURA 1. Mecanismo de ação da Anfotericina B na célula fúngica. (A) Ergosterol (B) grupos
farmacocinéticos (C) micosamina e (D) radical hidroxicil. Interação eletrostática entre o radical hidroxil,
micosamida e ergosterol formando os poros.
A classe a que a droga pertence é antibióticos macrolídios poliênicos por possuir um
anel lactônico macrocíclico, que é a estrutura ativa da droga, com uma porção rígida lipofílica
3
e outra rígida hidrofílica (BERDICHEVSKI, 2003). O anel macrolídeo da droga permite a
molécula uma conformação flexível, possibilitando a formação desses poros (MAZERSKI e
BOROWSKI, 1995). Além disso, estudos recentes mostram que o fármaco desencadeia
estresse oxidativo da célula, contribuindo para a morte celular (KIM et al., 2012).
Apesar de ter alta afinidade com o ergosterol, o fármaco possui afinidade pelo
colesterol da célula do paciente, o que parece estar relacionado aos efeitos tóxicos (YANO et
al., 2009).
Os efeitos colaterais podem estar relacionados à infusão da droga como, por exemplo,
febre, anorexia, tremores, hipotensão, náusea, vômito, taquipnéia e dores de cabeça,
denominados efeitos agudos sendo facilmente tratados (KLEPSER, 2011). Entretanto, podem
ocorrer efeitos colaterais dose dependentes, crônicos, que podem ocasionar a descontinuação
do tratamento, principalmente em pacientes muito debilitados como nefrotoxicidade
glomerular e do túbulo- intersticial, devido a vasocontrição da arteríola glomerular aferente,
que leva a diminuição da taxa de filtração glomerular, podendo levar a insuficiência renal
aguda. Acredita-se que a droga cause lesão no túbulo renal levando a hipocalemia,
hipomagnesemia e acidose tubular renal (ECHEVARRIA et al., 2006).
Ocorre aumento da uréia e creatinina séricas, devido a diminuição no clearence de
creatinina (IMHOF, WALTER e SCHAFFNER, 2003). Minutos após a administração do
fármaco, há uma hipoperfusão renal, com diminuição na produção de urina, mesmo quando
pressão sanguínea sistêmica se mantém inalterada. A porção medular do rim é pobremente
irrigada, sofrendo com essa hipoperfusão. Eventualmente os néfrons diminuem sua função,
principalmente em pacientes que são tratados com uma dose elevada durante um longo
período (LANIADO-LABORIN e CABRALES-VARGAS, 2009). A nefrotoxicidade está
diretamente ligada a fatores como a idade do paciente (MILLER e BATES, 1969), presença
de doença concomitante, utilização de outros fármacos nefrotóxicos e grau de hidratação.
A Anfotericina B causa nefrotoxicidade em humanos, sendo observado em pacientes o
aumento da creatinina em até duas vezes os valores normais, necessitando muitas vezes a
descontinuação do tratamento (WALSH et al., 1999). Observou-se alteração renal em 51,9 %
dos pacientes utilizando Anfotericina B, sendo necessária hemodiálise em 4,7% destes
(TUON et al., 2012). Sendo assim o uso da droga fica relacionado entre a eficácia do
tratamento e sua toxicidade (DUPONT, 2002).
Em um estudo epidemiológico retrospectivo de nove anos, com 494 pacientes
utilizando a terapia antifúngica convencional, Harbarth e colaboradores (2001), observaram
4
28% de nefrotoxicidade, sendo que 12% dos pacientes apresentaram toxicidade de moderada
a severa. Em outro estudo, com 75 pacientes que foram tratados com Anfotericina
Lipossomal, observou-se a nefrotoxicidade em 56% destes, deve-se salientar que destes, 12
pacientes apresentaram alterações hepáticas. Ela promove a redução da atividade fagocítica
das células de Kupffer, causa elevação temporária das enzimas hepáticas, aumenta bilirrubina
sérica, sinais típicos de dano hepático (INSELMANN, INSELMANN e HEIDEMANN,
2002).
A Anfotericina B causa alterações hematológicas como anemia (SHIGEMI et al.,
2011). A anemia deve-se a supressão da eritropoiese e não a hemólise (LANIADOLABORIN e CABRALES-VARGAS, 2009). Em estudos com humanos com administração
da droga observou-se o aparecimento de anemia normocítica, normocromica, sem
reticulocitose e hiperplasia eritróide (BRANDRISS et al., 1964; LIN et al., 1990). Em um
estudo com seis humanos recebendo Anfotericina B de 42 a 144 dias observou-se uma queda
no hematócrito de 25.8% (MACGREGOR, BENNETT e ERSLEV, 1978).
A leucopenia é encontrada em pacientes que fazem o tratamento com Anfotericina B.
(BENNETT et al., 1979; STAMM et al., 1987). A diminuição dos leucócitos pode ser causada
por uma diminuição na sua produção por aplasia da medula, aumento no consumo ou
destruição devido a agentes infecciosos (PEIXOTO, 2008). A Anfotericina B age sobre o
sistema imune, atuando na quimiotaxia dos leucócitos, em suas propriedades funcionais e na
produção de anticorpos, sendo um ponto muito importante que deve ser mais estudado visto
que a maioria dos pacientes que utilizam a droga são imunossuprimidos (FILIPPIN e
SOUZA, 2006).
A droga pode ocasionar alterações hepáticas. Ela promove a redução da atividade
fagocítica das células de Kupffer, causa elevação temporária das enzimas hepáticas, aumenta
bilirrubina sérica, sinais típicos de dano hepático (INSELMANN, INSELMANN e
HEIDEMANN, 2002).
Com a finalidade de diminuir os efeitos tóxicos da droga foram realizadas várias
pesquisas com diferentes formulações, sendo já comercializada em novas formulações como
preparações lipossomais ou complexos lipídicos (UD ALLEN, 2010). Essas formulações
possuem menor potencial tóxico, mas ainda assim apresentam vários efeitos colaterais e seu
custo elevado quando comparado a Anfotericina desoxicolato, comumente utilizada, o que
ocasiona a menor comercialização das outras formulações. Também estão sendo pesquisadas
5
formulações em nanopartículas, entretanto ainda não estão disponíveis comercialmente
(JUNG et al., 2009).
Além de formulações alternativas como citado acima, em estudos científicos tem-se
testado uso de antioxidantes como a N-Acetilciteína em conjunto ao tratamento com a
Anfotericina B verificando-se menor apoptose das células renais assim, menor toxicidade do
fármaco (ODABASI et al., 2009). Como os antioxidantes são produtos de fácil acesso, sendo
muitos deles produtos naturais, tornam-se uma alternativa viável a nanopartículas, devido a
sua facilidade de obtenção.
Neste contexto, foi realizado um experimento de lise de hemácias in vitro por Kuduva
em que foram utilizadas Anfotericina B (21 µM) e Curcumina (32 µM). Verificou-se que a
adição da Curcumina, um antioxidante, no experimento fez com que a lise provocada pela
Anfotericina B fosse adiada. Desta forma vê-se na utilização concomitante da Curcumina,
uma alternativa possível para diminuição dos efeitos tóxicos do tratamento com Anfotericina
B, pela sua ação antioxidante sem causar alteração em sua atividade antifúngica.
1.2 CURCUMINA
A Curcumina é um pigmento amarelo, isolado do rizoma da Curcuma longa pela
primeira vez em 1815. Esta planta é utilizada na alimentação como tempero em diversos
países asiáticos, sendo ela que dá cor e sabor ao curry. É insolúvel em água, mas solúvel em
álcool, acetona e dimetilsulfóxido (GOEL, KUNNUMAKKARA e AGGARWAL, 2008).
Dentre suas limitações estão sua natureza hidrofóbica e baixa bioviabilidade,
necessitando altas doses para alcançar o efeito desejado (YALLAPU et al., 2011). Além disso,
rápida metabolização e eliminação (AGGARWAL e HARIKUMAR, 2009).
A Curcumina possui atividade anti-inflamatória e anticancerígena e protege contra
estresse oxidativo, sendo utilizada de forma tópica ou via oral. Ela atravessa a barreira
hematoencefálica, sendo considerada neuroprotetora contra danos isquêmicos e doenças
neurodegenerativas (GUANGWEI et al., 2010). Alem de ser considerada hepatoprotetora e
hipoglicemiante (GOEL, KUNNUMAKKARA e AGGARWAL, 2008).
6
O pigmento é um composto fenólico que age sequestrando radicais livres e inibindo o
processo de peroxidação lipídica e com isso o dano oxidativo (BIANCHI e ANTUNES,
1999).
FIGURA 2. Estrutura química da Curcumina.
Utilizando o pigmento e acetomifeno, antiinflamatório que causa alterações renais e
hepáticas, observou-se a atividade antioxidante da Curcumina, confirmando-se que esta pode
ser um agente protetor potencial para nefrotoxicidade induzida pelo estresse oxidativo
(CEKMEN et al., 2009). Sua utilização em conjunto com a vancomicina, conferiu
propriedades nefroprotetoras, por sua ação antioxidante (AHMIDA, 2012). Na utilização
concomitante com o antibiótico nefrotóxico gentamicina observou-se que a Curcumina
diminuiu os efeitos tóxicos, agindo como uma substância nefroprotetora (FAROMBI e
EKOR, 2006).
Foi observada que a Curcumina inibe a liberação de interleucinas, após a isquemia
renal, possivelmente através da inibição da ativação dos macrófagos e com isto a liberação de
citocininas inflamatórias. Age como agente antiapoptótico atraves da inibição da TGF-β
como indutor da caspase-3 que age como mediadora da apoptose no rim e figado (AWAD e
EL-SHARIF, 2011).
A Curcumina preveniu a necrose hepática e alterações hematológicas causadas pelo
paracetamol (YOUSEF et al., 2010) e pelo uso do etanol (BAO et al., 2010). Em experimento
utilizando a droga em células renais foi observado que ela protegeu estas de lesão celular
oxidativa por meio da inibição da degradação lipídica, peroxidação lipídica e citólise
(MAHESHWARI et al., 2006)
Utilizando-a na prevenção de doenças hepática em camundongos causadas pelo
consumo de álcool, ela atuou como poderoso agente antioxidante, causando aumento na
7
concentração da glutationa, com aumento da atividade da glutationa peroxidase e glutationaS-transferase (RONG et al., 2012).
Inibiu a apoptose das células cardíacas causada pela doxirrubicina devido sua
capacidade antioxidante (HOSSEINZADEH et al., 2011). Além da proteção ela tornou a
atividade antitumoral da droga mais efetiva (SADZUKA et al., 2012).
A Curcumina apresentou hepato e nefroproteção em ratos que receberam uma
overdose de paracetamol (KHERADPEZHOUH et al., 2010; YOUSEF et al., 2010). A
Curcumina agiu beneficamente sobre a toxicidade renal causada pela vancomicina (ratos 400
mg/kg) (AHMIDA, 2012). O pigmento (100mg/kg) diminuiu as concentrações de Alanina
Aminotransferase e Fosfatase Alcalina em ratos tratados com tetracloreto de carbono, tanto na
intoxicação aguda, quanto na crônica (PARK et al., 2000). Também foi efetiva em diminuir a
ALT de ratos com hepatotoxicidade causada pelo ferro (REDDY e LOKESH, 1996). Além de
sua ação nefroprotetora em ratos tratados com gentamicina, normalizando os valores de uréia
e creatinina (FAROMBI e EKOR, 2006) e os exames histopatológicos (ALI et al., 2005).
Dessa forma foi utilizada a Curcumina, por suas propriedades antioxidantes, hepato e
nefroprotetoras com a finalidade de diminuir os efeitos adversos da Anfotericina B e com isso
possibilitar o tratamento de infecções fúngicas sistêmicas sem causar maiores danos a saúde
do paciente.
8
2 OBJETIVOS
2.1 OBJETIVOS GERAIS
Investigar a atividade da Curcumina sobre a nefrotoxicidade, hepatotoxicidade e
hematotoxicidade induzida pela Anfotericina B.
2.2 OBJETIVOS ESPECÍFICOS
Buscar a dose nefrotóxica, hepatotóxica e hematotóxica da Anfotericina B.
Avaliar o efeito da Curcumina sobre parâmetros bioquímicos, hematológicos e
histopatológicos renais e hepáticos.
Investigar o efeito hepatoprotetor, hematoprotetor e nefroprotetor da Curcumina em
relação a Anfotericina B.
9
3 METODOLOGIA
3.1 ANIMAIS
Para a realização do experimento foram utilizados ratos Wistar (Ratus norvergicus)
adultos, machos, com peso de aproximadamente de 300 gramas, advindos dos biotérios da
Universidade Estadual de Ponta Grossa (UEPG) e Universidade Estadual do Centro-Oeste
(UNICENTRO). Os animais foram alojados em gaiolas próprias com lotação máxima de 3
ratos por gaiola, e mantidos em instalações climatizadas com alimentação e água fornecidas
ad libitum. Os animais foram submetidos à ambientalização por 30 dias.
Ao final do experimento os animais foram eutanasiados por meio de câmara de
dióxido de carbono seguido de decapitação.
O estudo foi aprovado pelo Comitê de Ética Animal da Universidade Estadual do
Centro-Oeste, parecer 030/2012 respeitando-se todas as regras e utilizando de meios para
garantir o estresse mínimo dos animais assegurando assim seu bem estar durante o
experimento.
3.2 FÁRMACOS, VEÍCULOS E KITS
Anfotericina B (Iffect Chemphar Co., Ltd, China®),
Anfotericina B desoxicolato (Anforin ®, Cristália),
Curcumina (Sigma®);
Óleo vegetal de milho Liza®
Solução glicosada a 5% JP®.
Solução de Marcano (manipulado VICOFARMA),
Ácido Acético (manipulado VICOFARMA);
Padrão Hemoglobina Labtest ® Ref. 47;
Kit Comercial Labtest® Uréia CE Ref. 27;
Kit Comercial Labtest® Creatinina K Ref. 35;
Kit Comercial Labtest® ALT/GPT Liquiform Ref. 108;
10
Kit Comercial Labtest® Fosfatase Alcalina Liquiform Ref. 79.
3.3 EXPERIMENTOS
3.3.1 Curva de Dose e Tempo de Anfotericina B Intraperitoneal (EXPERIMENTO A).
A Anfotericina B (Iffect Chemphar Co., Ltd, China®) foi administrada por via
intraperitoneal (IP) diluída em solução glicosada a 5%.
Os animais foram divididos em seis grupos:
G1) Solução glicosada a 5% por 30 dias IP, n= 6
G2) Anfotericina B 20 mg/kg por 10 dias IP, n= 6
G3) Anfotericina B 40 mg/kg por 10 dias IP, n= 6
G4) Anfotericina B 80 mg/kg por 10 dias IP, n= 6
G5) Anfotericina B 20 mg/kg por 30 dias IP, n=6
G6) Anfotericina B 40 mg/kg por 30 dias IP, n=6
3.3.2 Efeito da Curcumina Sobre a Toxicidade da Anfotericina B intravenosa
(EXPERIMENTO B).
Realizou-se o experimento por via intravenosa (via intracaudal) com Anfotericina B
(Iffect Chemphar Co., Ltd, China®), na dose de 3 mg/kg e Curcumina na dose de 100 mg/kg
via gavagem (VO) (BABU, SHYLESH e PADIKKALA, 2001), diluída em óleo vegetal de
milho. A dose de Anfotericina foi a mesma utilizada por Manente (2013).
Foram divididos os animais em quatro grupos:
G1) Solução glicosada a 5% (IV) e óleo de milho (VO) por 5 dias, n=8
G2) Anfotericina B 3 mg/kg (IV) e óleo de milho (V0) por 5 dias, n=8
G3) Curcumina 100 mg/kg(VO) e solução glicosada (IV) por 5 dias, n=8
G4) Anfotericina B 3 mg/kg (IV) por 5 dias e Curcumina 100 mg/kg por 5 dias, n=8.
11
3.3.3 Efeito da Curcumina Sobre a Toxicidade da Anfotericina B intravenosa Anforin ®
(EXPERIMENTO C).
Neste experimento foi aplicada por via intravenosa (via intracaudal) Anfotericina B
desoxicolato (Anforin®), na dose de 1 mg/kg e Curcumina na dose de 100 mg/kg via
gavagem (VO), diluída em óleo vegetal de milho. A Anfotericina desoxicolato foi diluída
inicialmente no diluente próprio e em seguida em solução glicosada a 5% conforme a
indicação do fabricante. Foram divididos os animais em quatro grupos:
G1) Solução glicosada 5% (IV) e óleo de milho (VO) por 5 dias, n=10
G2) Anfotericina B 1 mg/kg (IV) e óleo de milho (V0) por 5 dias, n=10
G3) Curcumina 100 mg/kg (VO) e solução glicosada 5% (IV) por 5 dias, n=10
G4) Anfotericina B 1 mg/kg (IV) por 5 dias e Curcumina 100 mg/kg por 5 dias, n=10.
Foi realizada a pesagem inicial dos animais, seguida da pesagem diária para
monitoração da dose e peso.
Após os experimentos A, B e C foi realizada eutanásia dos animais no dia seguinte a
ultima aplicação, seguida de coleta se sangue para realização de hemograma, exames
bioquímicos e coleta dos rins e fígado para exame histopatológico do fígado e rins.
3.4 HEMOGRAMA
Para averiguar se ocorreram alterações hematológicas, como anemias, nos animais
foram realizadas mensuração dos componentes sanguíneos da série vermelha (hematócrito,
hemoglobina e hemácias). Foi coletado 1ml de sangue em tubo com 80 μl de EDTA a 5%
para realização do hemograma, com contagem de hemácias em câmara de Neubauer conforme
descrito na literatura (HENDRIX, 2005). Foi utilizado o hematócrito para verificar a presença
de anemia (valor abaixo do limite normal) ou desidratação do animal (hemoconcentração
apresentando um valor acima do limite normal) Em estado normal o hematócrito varia
paralelo a hemoglobina (FAILACE, 2003).
Para determinar o hematócrito o sangue foi homogeneizado, preenchido um tubo de
micro-hematócrito (capilar com 75 mm) com sangue até aproximadamente ¾ de sua
capacidade. Após o fechamento de uma das extremidades do túbulo a fogo este foi
centrifugado em uma centrífuga de micro-hematócrito a 10.000 rotações por minuto por 5
12
minutos. Após a centrifugação, a leitura do hematócrito foi feita através de uma tabela padrão.
Sendo o valor médio apresentado por ratos saudáveis de 39,1 a 48,7 % (MELO et al., 2013).
A proteína plasmática foi determinada através da leitura com refratômetro manual
(GOMES et al., 2006). Valores de referência 5,4-6,6 g/dL (MELO et al., 2013).
Para contagem de hemácias foi utilizada uma solução preparada com 10 μl de sangue
adicionado a 2 ml de Solução de Marcano. Após a homogeneização esta solução foi colocada
em uma Câmara de Neubauer, sendo realizada a contagem em microscopia óptica, contados
os cinco quadrados centrais diagonais, sendo focalizado em objetiva de 10 vezes e contados
em objetiva de 40 vezes. O valor obtido pela soma das hemácias no quadrado foi multiplicado
por 10.000. Valores de referência: 6,7 – 8,6 x 106/μL (SANTOS et al., 2010)
Para determinação da hemoglobina foi utilizado o método de cianometahemoglobina.
A leitura foi realizada em espectrofotômetro no comprimento de onda de 540 nm. O valor
obtido de hemoglobina foi expresso em g/dL, sendo o valor de referência de 13,2 a 16,4 g/dL
(THRALL, 2007).
Foi realizada a contagem de leucócitos totais com o intuito de verificar a presença de
leucopenia que pode ser verificado em humanos com a utilização de Anfotericina B
(BENNETT et al., 1979; STAMM et al., 1987).
Para a contagem de leucócitos totais foi preparada uma solução de 400 μl de ácido
acético (na concentração de 2%) na qual foram adicionados 20 μl de sangue total e realizada
homogeneização. Deixou-se descansar essa solução por 20 minutos para que ocorra a
destruição das hemácias, restando apenas os leucócitos para a contagem. Após nova
homogeneização foi preenchida a câmara de Neubauer com a solução com auxílio de uma
pipeta e levada ao microscópico óptico em objetiva de 40 vezes, realizada a contagem de
leucócitos nos quatro retículos laterais da câmara. A soma dessa contagem foi multiplicada
por 50, sendo o valor de referência de 7,3 a 12,66 x103 células (THRALL, 2007).
3.5 EXAMES BIOQUÍMICOS
Para a verificação da função renal e hepática foram realizados exames bioquímicos
para tanto foi coletado aproximadamente 3 ml de sangue sem anticoagulante, sendo foi
centrifugado a 2500 rpm por 10 minutos para obtenção de soro que foram acondicionado em
alíquotas em túbulos plásticos tipo Eppendorfs e congelados a -20ºC até o processamento das
amostras e análises bioquímicas. No soro congelado foram realizadas análises bioquímicas de
13
quantificação de uréia, creatinina e Alanina aminotransferase (ALT) e Fosfatase Alcalina
através da espectrofotometria em analisador bioquímico semiautomático (BIOPLUS 200®)
utilizando Kits comerciais Labtest®, segundo informações do fabricante.
3.5.1 Atividade da enzima Alanina Aminotransferase (ALT)
A enzima alanina aminotransferase (ALT) esta presente no interior dos hepatócitos,
sendo liberada no caso de lesão ou destruição destas células hepáticas (Motta, 2000). É
considerada uma enzima altamente hepato-específica, sendo que em geral o aumento desta
enzima sugere lesão da membrana à necrose dos hepatócitos. O aumento da ALT
normalmente é proporcional ao número de células lesadas (THRALL, 2007).
A atividade da Enzima Alanina Aminotransferase foi realizada de acordo com a
metodologia padrão, utilizando-se o piroxal fosfato (REITMAN e FRANKEL, 1957; PINTO,
2010). Para quantificação da alanina aminotransferase (ALT) foram pipetados com 100 μl de
soro previamente descongelado adicionado ao reagente de trabalho do teste comercial. Os
valores normais de ALT para ratos são de 36-58 UI/L (MELO et al., 2013).
3.5.2 Dosagem de Uréia
A uréia é um dos parâmetros sanguíneos utilizados para avaliar a filtração glomerular,
pois a maior parte da uréia sanguínea é excretada pela urina por meio da filtração glomerular.
A diminuição na taxa de filtração glomerular leva ao aumento da uréia sanguínea (THRALL,
2007).
A mensuração foi realizada pelo método enzimático em que a uréia da amostra é
hidrolisada pela enzima urease, produzindo amônia e dióxido de carbono através da reação de
Berthelot modificada, sendo lido em um comprimento de onda de 340 nm (SEARCY et al.,
1961). Valores de referência: 30-42 mg/dL (MELO et al., 2013).
14
3.5.3 Dosagem de Creatinina
A creatinina plasmática é derivada do catabolismo muscular, cuja excreção é
exclusivamente renal, não sendo reabsorvida ou reaproveitada, sendo que uma diminuição no
fluxo renal causa seu o acúmulo na corrente sanguínea, indicando um déficit renal
(GONZÁLEZ e SCHEFFER, 2003; THRALL, 2007).
Foi realizada através da reação de Jeffée (MYERS et al., 2006). A mensuração foi feita
por meio de reação cinética, em que a creatinina reage com ácido pícrico em condições
alcalinas, formando um complexo de cor lido no espectofotometro em onda de 510 nm, sendo
que a formação da cor é proporcional a creatinina na amostra. Valores de referência: 0,5 – 1,4
mg/dL (THRALL, 2007).
3.5.4 Dosagem de Fosfatase Alcalina
A fosfatase alcalina é uma enzima presente nos canalículos biliares, túbulos renais,
baço, ossos e placenta, sendo que a forma predominante no soro sanguíneo é referente ao
fígado e ossos. Esta elevada em casos de desordem do trato biliar, podendo apresentar
elevação no caso de cirrose hepática (MOTTA, 2000).Foi realizada através da metodologia de
Roy por ensaio colorimétrico (ROY, 1970). Sendo considerados valores de referência 124130 UI/L (DANTAS et al., 2006).
3.6 EXAMES HISTOPATOLÓGICOS
Após a eutanásia, os rins e fígados foram coletados armazenados em solução de
formalina tamponada a 10% para processamento histológico padrão (desidratação do órgão
em álcool, seguida de imersão em parafina, com posterior microtomia (50 μm), confecção da
lâmina, remoção da parafina e coloração da lâmina e posterior observação em microscopia
ótica (ALVES, 2002). As amostras foram encaminhadas ao Centro de Apoio em Patologia de
15
Guarapuava (Guarapuava, Paraná). As colorações utilizadas foram hematoxilina e eosina
(HE) com a finalidade de observar a composição dos tecidos de acordo com suas estruturas
morfológicas e principalmente verificar e quantificar a presença de compostos amiloides os
quais foram observados pela coloração marrom (TOLOSA, 2003). As lesões foram
observadas qualitativamente observando-se a presença de alterações morfológicas nas células,
presença de infiltrados inflamatórios. Foram comparadas as lâminas dos animais em
tratamento com os controles, foram realizados dois cortes histológicos em de cada rim dos
animais e uma lâmina com três cortes histológicos dos fígados dos animais.
4. ANÁLISE ESTATÍSTICA
As variáveis quantitativas foram descritas como média e desvio padrão. Os testes
estatísticos foram utilizados para realizar a comparação e entre as variáveis independentes.
Para todas as comparações, foi adotado o nível de significância de 5% e os testes foram
bicaudais.
Inicialmente foi empregado o teste de Shapiro-Wilk e teste de Levene para
homogeneidade das variâncias dos grupos. Para as variáveis que não violaram o pressuposto
de homogeneidade foi empregado o teste ANOVA one way com post hoc de Bonferroni para
comparações múltiplas.
Para as variáveis que violaram o pressuposto de homogeneidade foi empregado o teste
não paramétrico de Kruskal-Wallis com correção do valor de significância para múltiplas
comparações, seguido de teste de Dunnet. Foi utilizado o software Statistical Package for the
Social Sciences (SPSS) versão 20.0 (IBM, Armonk, Nova York, Estados Unidos).
Para o peso dos animais utilizou-se o pressuposto de esfericidade (teste de Mauchly e
correção Greenhouse-Geiser). Utilizado o teste de ANOVA para medidas repetidas com post
hoc de Sidak.
16
5. RESULTADOS E DISCUSSÃO
5.1. CURVA DE DOSE E TEMPO DE ANFOTERICINA B INTRAPERITONEAL
(EXPERIMENTO A).
5.1.1 Parâmetros Hematológicos
Foi realizada a quantificação de hemoglobina, hemácias e o hematócrito dos animais
para verificar a presença de anemia e alterações hematológicas provocadas pela droga. Em
relação ao hematócrito, hemácias e hemoglobina dos animais, foi observada diferença o grupo
controle e os grupos 40mg/kg/10 dias e 80mg/kg/10 dias (FIGURAS 3, 4 e 5).
FIGURA 3. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos sobre o Hematócrito de ratos
Wistar. Dados expressos em média ± DP, sendo que letras diferentes indicam diferença estatística (p<0,05).
Teste ANOVA One way (F=18,527 e p<0,001) e pós teste de Bonferroni Diferiram do grupo controle os grupos
( 40mg/kg por dez dias (p=0,001) (bc) e 80 mg/kg por dez dias (p<0,001) (c). Grupos com n=6.
17
FIGURA 4. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos sobre o número total de Hemácias
de ratos Wistar. Dados expressos em média ± DP, sendo que letras diferentes indicam diferença estatística
(p<0,05), pelo teste ANOVA One way (F=18,637 e p<0,001) com pós teste de Bonferroni. Diferiram do grupo
controle os grupos 40mg/kg por dez dias (p=0,001) (bc) e 80 mg/kg por dez dias (p<0,001) (c). Grupos com n=6
FIGURA 5. Curva de dose e Tempo de Anfotericina Intraperitoneal sobre a Hemoglobina de ratos Wistar.
Dados expressos em média ± DP, letras diferentes indicam diferença estatística (p<0,05), pelo teste ANOVA
One way (F=17,489 e p<0,001) com pós teste de Bonferroni. Diferiram do grupo controle (a) os grupos 40mg/kg
por dez dias (bc) (p=0,004) e 80 mg/kg por dez dias (p<0,001) (c). Grupos com n=6.
18
A anemia é um distúrbio hematológico que é observado por diversos autores, em
pacientes em tratamento com Anfotericina B, estando possivelmente relacionado a supressão
da produção de eritropoetina, devido lesão renal e não pela ação direta na medula óssea
(BRANDRISS et al., 1964; MACGREGOR, BENNETT e ERSLEV, 1978). Mas essa inibição
não é total e é suprimida após a descontinuação do tratamento (LIN et al., 1990). O
mecanismo proposto pelo qual ela ocorre é a inibição da transcrição do gene EPO (produtor
da eritropoetina) pela inativação de HIF-1(fator de transcrição induzido por hipóxia) (YEO et
al., 2006). Foi observado que os grupos 40 mg/kg por 10 dias e 80 mg/kg por 10 dias
diferiram estatisticamente do controle nos parâmetros hematológicos, diferindo de Carraro
(2013), que não observou alterações hematológicas em ratos tratados com Anfotericina B por
7 dias na dose de 10mg/kg intraperitoneal, essa alteração pode ter ocorrido devido ao tempo
de experimento ser menor no experimento. Os parâmetros do grupo 80mg/kg são os que se
apresentam mais diminuídos, provavelmente devido à alta dose utilizada. Nos grupos tratados
por trinta dias não ocorreu diferença estatística, sendo assim o tempo parece ser um fator
crucial a ser considerado na detecção da hematotoxicidade induzida pela Anfotericina B.
Sabe-se que a utilização da Anfotericina B desoxicolato pode provocar leucopenia,
porém em relação à contagem de leucócitos, não foi observada diferença estatística entre os
grupos (FIGURA 6). Esse resultado corrobora com o experimento de Carraro (2013)
(TABELA 1) que não observou leucopenia em ratos pela via intraperitoneal em 7 dias de
tratamento. Peixoto (2008) observou a presença de leucopenia em camundongos nas 12 horas
iniciais do tratamento, sendo que aos trinta dias esses valores se normalizaram desse modo, o
tempo de coleta de sangue do experimento A pode ter sido um fator para a não visualização
da leucopenia nos animais. Utilizando 10mg/kg/30 dias/IP, Keim e colaboradores (1976)
constataram a presença de leucocitose, devido a peritonite causada pela aplicação, o que não
foi detectado neste experimento (KEIM et al., 1976).
19
TABELA 1. Experimentos utilizando Anfotericina B, doses, espécie animal e via de
administração e tempo de administração.
Espécie
Animal
Dose de
Via de
Anfotericina Administração
Tempo
Referência
Camundongo
2 mg/kg
Intraperitoneal
30 dias
Amaral et al., 2009
Ratos
10mg/kg
Intraperitoneal
10 dias
Carraro, 2013
Ratos
2mg/kg
Intravenoso
14 dias
Fukui et al., 2003
Ratos
5 mg/kg
Intravenoso
Aplicação
única
Italia et al., 2009.
Ratos
10 mg/kg
Intraperitoneal
30 dias
Keim et al., 1976
Camundongo
0,5 mg/kg
Intravenoso
21 dias
Larabi
Ratos
3 mg/kg
Intravenoso
5 dias
Manente, 2013.
Camundongo
1 mg/kg
Intravenoso
7 dias
Nahar et al., 2008
Camundongo
2mg/kg
Intraperitoneal
12 horas
Peixoto, 2008.
30 dias
90 dias
Ratos
1mg/kg
Intravenoso
24 horas
Riscovi et al., 1976.
20
FIGURA 6. Curva de dose e Tempo de Anfotericina Intraperitoneal sobre os Leucócitos Totais de ratos Wistar.
Dados expressos em média ± DP, letras iguais indicam que não há diferença estatística (p>0,05), pelo teste não
paramétrico Kruskal Willis (F =9,595 e p=0,088). Não foi observada diferença estatística entre os grupos (n=6).
Não foi observada diferença entre os grupos para proteína plasmática total (FIGURA
7). A proteína plasmática total refere-se a combinação de albumina e globulinas, sendo a
albumina produzida no fígado. Uma diminuição neste parâmetro esta presente em casos de
alterações hepáticas, onde o fígado deixa de produzi-la, ou em casos de alterações renais,
onde há perda de proteína pelos túbulos renais (GONZÁLEZ e SCHEFFER, 2003). Apesar de
não ser observada diferença estatística para esse parâmetro, observou-se uma leve diminuição
dos valores quando comparados aos de referencia dos animais tratados com Anfotericina B,
essa diminuição pode ser relacionada a fatores individuais fisiológicos dos indivíduos ou ser
uma sutil alteração causada pelo fármaco.
21
FIGURA 7. Curva de dose e Tempo de Anfotericina Intraperitoneal sobre a Proteína Plasmática de ratos Wistar.
Dados expressos em média ± DP, letras iguais indicam que não há diferença estatística (p>0,05), pelo teste
ANOVA One way (F=3,414 e p=0,13). Não foi observada diferença estatística entre os grupos (n=6).
5.1.2 Parâmetros Bioquímicos Renais
Não foi observada diferença significativa para creatinina (FIGURA 8), assim como
nos trabalhos Carraro (2013), Peixoto (2008) e Amaral et al. (2009). Peixoto (2008) não
observou qualquer alteração, precoce (12 horas) ou tardia (80 dias de tratamento). Amaral
(2009) utilizou 2 mg/kg/intraperitoneal em camundongos durante 30 dias e não ocorreram
alterações na creatinina dos animais. Carraro (2013) utilizou a droga em ratos, sem qualquer
alteração nesse parâmetro. Esses resultados diferem de outros estudos com ratos em que foi
observado aumento da creatinina sérica utilizando a droga por um período menor de tempo e
em uma dose menor, como 5 mg/kg intraperitoneal (IP) por 7 dias (HEIDEMANN et al.,
1992), 5 mg/kg IP por 10 dias (TOLINS e RAIJ, 1991). Não ocorreu alteração na creatinina
dos animais do experimento A, assim, a filtração glomerular manteve-se eficiente, não
mostrando sinais de toxicidade renal. A alteração neste parâmetro é comumente visualizada
em humanos utilizando o fármaco, devendo ser realizado o monitoramento contínuo deste
metabólito durante o tratamento.
22
FIGURA 8. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos Wistar sobre a creatinina sérica.
Dados expressos em média ± DP, letras iguais indicam que não há diferença estatística (p>0,05), pelo teste
ANOVA One way (F=2, 001 e p= 0,104). Não foi observada diferença estatística entre os grupos (n=6).
Em relação a uréia, o GRUPO 4 diferiu estatisticamente de todos os grupos,
apresentando aumento da uréia sanguínea (FIGURA 9), discordando dos resultados
apresentados por de Carraro (2013), Peixoto (2008) e Amaral et al. (2009) que não
observaram qualquer aumento neste parâmetro pela via intraperitoneal. Esse aumento da uréia
poderia ser um indicador de lesão renal, pois ela é eliminada na urina, sendo a diminuição do
fluxo renal e da filtração glomerular as causas de seu acúmulo na corrente circulatória
(GONZÁLEZ e SCHEFFER, 2003). Keim et al. (1976) utilizando Anfotericina desoxicolato
por via intraperitoneal em ratos (10mg/kg durante 30 dias), observou aumento da uréia sérica,
bem como aumento na ingestão hídrica, indicando nefrotoxicidade (KEIM et al., 1976). Esse
aumento na uréia poderia ser um indício de inicio de nefrotoxicidade, apresar de ocorrer sem
aumento na creatinina, visto que esta tem aumento tardio na lesão renal quando comparada a
uréia.
23
FIGURA 9. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos Wistar na concentração de Uréia
sérica. Dados expressos em média ± DP, letras diferentes indicam diferença estatística (p<0,05), pelo Teste
ANOVA One way (F= 9,581 e p<0,001) com pós teste de Bonferroni. O grupo 80 mg/kg/10 dias (a) diferiu
estatisticamente de todos os grupos (b). Grupos com n=6.
5.1.3 Parâmetros Bioquímicos Hepáticos
Em relação à enzima alanina aminotransferase obteve-se diferença estatística somente
entre o grupo controle e o grupo 3 (Anfotericina B 40 mg/kg por 10 dias) (FIGURA 10). Essa
enzima é um marcador de dano hepático em roedores, estando relacionado a apoptose das
células hepáticas, estando relacionada ao número de células envolvidas e não a gravidade da
lesão. Tem um pico de liberação 3 ou 4 dias após a lesão mas retorna aos valores basais em
duas semanas (SCHEFFER e GONZÁLEZ, 2003). Foi observada diminuição da ALT por
Peixoto (2008) no tempo 24 horas para o grupo tratado com Anfotericina B intraperitoneal,
restabelecendo seu valor inicial após 7 dias, essa diminuição da ALT não tem valor
significativo. No experimento de Carraro (2013) não ocorreu alteração na ALT dos animais
tratados com 10 mg/kg de Anfotericina B intraperitoneal por 7 dias, dessa forma, percebe-se
que a alteração neste parâmetro pode ocorrer precocemente, sendo necessário realizar a coleta
do sangue dos animais em período anterior aos coletados. Amaral et al., 2009 utilizando
Anfotericina B desoxicolato em camundongos (2mg/kg/30 dias) não observou sinais de
hepatotoxicidade (AMARAL et al., 2009).
24
FIGURA 10. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos Wistar na concentração de ALT.
Dados expressos em média ± DP, Diferiram estatisticamente os grupos controle (a) e 40 mg/kg/10 dias (b). Teste
não paramétrico Kruskal Willis (KW=19,287 e p=0,002) com pós teste de Dunnet. Grupos com n=6.
A respeito da enzima fosfatase alcalina, que pode ter seu aumento transitório em casos
de necrose hepatocelular (SCHEFFER e GONZÁLEZ, 2003), não ocorreram diferenças entre
os grupos (FIGURA 11). Peixoto (2008) observou aumento da enzima 24 horas após o
tratamento; aos trinta dias ela manteve-se dentro dos parâmetros normais. Dessa forma, no
período em que foi coletado o sangue dos animais esse aumento, se ocorreu, não pode ser
identificado.
25
FIGURA 11. Curva de dose e Tempo de Anfotericina Intraperitoneal em ratos Wistar sobre a Fosfatase
Alcalina. Dados expressos em média ± DP, letras iguais indicam que não há diferença estatística (p>0,05), pelo
Teste ANOVA One way (F= 1,696 e p= 0,163). Não foi observada diferença estatística entre os grupos (n=6).
A hepatotoxicidade é um dos efeitos da droga, entretanto menos comum em humanos
do que a nefrotoxicidade. Em um paciente foi relatado aumento de fosfatase alcalina e ALT
(além de AST, lactato desidrogenase e bilirrubinuria) sem motivo aparente em com
Anfotericina B, necessitando a descontinuação do tratamento (MILLER, 1984). Essa
toxicidade é dose dependente, possivelmente relacionada a predisposição genética (ABAJO e
CARCAS, 1986).
A toxicidade hepática relacionada ao uso da Anfotericina B é mais comumente
verificada no uso das formulações lipossomais (FISCHER et al., 2005) e lipídicas (ELLIS et
al., 2001). Patel observou essa alteração em 21% de 75 pacientes utilizando a formulação
lipossomal (PATEL, CRANK e LEIKIN, 2011). Possivelmente esse efeito esteja relacionado
ao veículo (lipossoma) que faz com que a droga acumule-se neste órgão. Há relatos de um
caso de um paciente utilizando a droga em sua forma lipossomal, apresentou necrose hepática
(ELLIS et al., 2001).
Como não ocorreram alterações nos parâmetros hepáticos, não foi possível averiguar a
hepatotoxicidade na curva de dose de Anfotericina B.
26
5.1.4 Análises Histopatológicas
Como os exames hematológicos e bioquímicos não puderam esclarecer a dose
nefrotóxica e hepatotóxica da Anfotericina B, visto que não ocorreu um aumento significativo
de ambas as enzimas ou substratos, realizou-se a análise histológica dos órgãos dos animais.
As lâminas dos rins e fígados dos animais, coradas hematoxilina e eosina (HE) foram
analisadas por meio de microscopia de luz, para a realização das fotomicrografias utilizandose um microscópio com câmara digital acoplada. A análise baseou-se em comparar as lâminas
dos animais tratados com o fármaco com as do controle e exame do estado celular dos tecidos.
Nas análises histopatológicas do fígado dos animais (FIGURAS 12-17) inclusive nos
animais do grupo controle, observou-se a presença de infiltrados inflamatórios
linfoplasmocitários.
FIGURA 12. Fotomicrografia do fígado (HE) do animal do grupo controle (400x) do experimento da curva de
dose e tempo de Anfotericina B intraperitoneal. Presença de infiltrado inflamatório linfoplasmocitário (seta).
27
FIGURA 13. Fotomicrografia do fígado (HE) do animal tratado com 20 mg/kg por 10 dias (400x) do
experimento da curva de dose e tempo de Anfotericina B intraperitoneal. Sem alterações nessa lâmina.
FIGURA 14. Fotomicrografia do fígado (HE) do animal tratado com 40 mg/kg por 10 dias (400x) do
experimento da curva de dose e tempo de Anfotericina B intraperitoneal. Observado presença de infiltrado
inflamatório linfocitário (seta).
28
FIGURA 15. Fotomicrografia do fígado (HE) do animal tratado com 80 mg/kg por 10 dias (400x) do
experimento da curva de dose e tempo de Anfotericina B intraperitoneal. Sem alterações no parênquima hepático
nesta lâmina.
FIGURA 16. Fotomicrografia do fígado (HE) do animal tratado com 20 mg/kg por 30 dias (400x) do
experimento da curva de dose e tempo de Anfotericina B intraperitoneal. Presença de Infiltrado Linfocítico
Plasmocitário (seta).
29
FIGURA 17. Fotomicrografia do fígado (HE) do animal tratado com 40 mg/kg por 30 dias (400x) do
experimento da curva de dose e tempo de Anfotericina B intraperitoneal. Sem alterações no parênquima hepático
nessa lâmina.
Peixoto (2008) obsevou infiltrados inflamatórios no fígado dos camundongos tratados
com Anfotericina B por 30 dias, bem como Carraro em ratos (2013). Entretanto esses
infiltrados foram encontrados também nos animais do grupo controle, que foram tratados por
30 dias, possivelmente estando relacionadas ao inicio de uma peritonite pela aplicação diária,
apesar de tomadas todas as precauções com a antissepsia, apesar de não ter ocorrido alteração
no número de leucócitos.
A literatura descreve inflamação perivascular da região portal do fígado com
vacuolização de hepatócitos em animais tratados com Anfotericina B (SOUZA, SALDIVA e
CAMPA, 2000). No experimento foi observada a inflamação do parênquima hepático e não
da região portal.
Nas lâminas dos rins dos animais não se observou qualquer alteração nos glomérulos,
túbulos e vasos, como podemos verificar nas FIGURAS 18 a 23.
30
FIGURA 18. Fotomicrografia (HE) de Rim de animal controle do experimento de curva de dose e tempo de
Anfotericina B intraperitoneal (400x). Túbulos e vasos sem alteração.
FIGURA 19. Fotomicrografia (HE) de Rim de animal do experimento de curva de dose e tempo de Anfotericina
B intraperitoneal tratado com 20 mg/kg por 10 dias (400x). Glomérulos e túbulos sem alteração.
31
FIGURA 20. Fotomicrografia (HE) de Rim de animal do experimento de curva de dose e tempo de Anfotericina
B intraperitoneal tratado com 40 mg/kg por 10 dias (400x). Túbulos e vasos sem alterações.
FIGURA 21. Fotomicrografia (HE) de Rim de animal do experimento de curva de dose e tempo de Anfotericina
B intraperitoneal tratado com 80 mg/kg por 10 dias (400x). Túbulos e vasos sem alterações.
32
FIGURA 22. Fotomicrografia (HE) de Rim de animal do experimento de curva de dose e tempo de Anfotericina
B intraperitoneal tratado com 20 mg/kg por 30 dias (400x). Glomérulos e túbulos sem alteração.
FIGURA 23. Fotomicrografia (HE) de Rim de animal do experimento de curva de dose e tempo de Anfotericina
B intraperitoneal tratado com 40 mg/kg por 30 dias (400x). Glomérulos e túbulos sem alteração.
33
Não foram encontradas quaisquer alterações renais nos animais do experimento A. O
mesmo foi observado por Carraro (2013), utilizando a via intraperitoneal em ratos por 7 dias.
Peixoto (2008) encontrou infiltrados inflamatórios nos órgãos dos camundongos tratados com
Anfotericina B (IP) por 30 dias.
Por não perceberem-se alterações renais dos animais tratados como edema tubular
proximal e distal, com infiltrado leucocitário peritubular e degeneração celular tubular
(SOUZA, SALDIVA E CAMPA, 2000) e não ocorrer aumento da creatinina, e da uréia na
maioria dos grupos, pode-se concluir que a droga não causou toxicidade renal.
Em relação a toxicidade hepática, por todos os grupos, inclusive o controle,
apresentarem infiltrados inflamatórios, esta também não pode ser confirmada. Não ocorreram
alterações nos exames bioquímicos, a não ser na uréia do grupo 80 mg/kg/10 dias. Dessa
forma, a via intraperitoneal não foi adequada para causar a toxicidade renal e hepática.
Foram encontradas alterações nos parâmetros hematológicos dos animais dos grupos
40mg/kg por 10 dias e 80 mg/kg por 10 dias, indicando hematotoxicidade.
5.2. EXPERIMENTO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA
ANFOTERICINA B INTRAVENOSA (EXPERIMENTO B).
5.2.1 Parâmetros Hematológicos
Em relação ao hematócrito, hemácias e hemoglobina ocorreu diferença significativa
apenas entre os grupos Curcumina e Anfotericina (Figuras 24, 25 e 26). Não ocorreu
diferença entre os grupos tratados e o controle, diferindo do trabalho de Manente (2013), em
que os animais, utilizando a mesma via e dose apresentaram alteração nos grupos tratados
com Anfotericina B em relação ao controle. Uma característica que difere do experimento
realizado de Manente (2013) é a utilização de fêmeas, que sofrem alterações hormonais.
Em um experimento utilizando Anfotericina B, em comparação com nanoparticulas e
com a formulação lipossomal durante sete dias, observou-se decréscimo nestes parâmetros no
grupo que utilizou a Anfotericina B convencional (1mg/kg/7dias/IV) , quando comparado
com os outros grupos e com o controle (NAHAR et al., 2008), diferindo dos resultados
apresentados no Experimento B.
34
Os animais tratados apenas com Curcumina não diferiram do grupo controle, podendose concluir que a Curcumina não provocou alterações hematológicas nos animais tratados, não
apresentando caráter hematotóxico.
FIGURA 24. Hematócrito de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes diferem
estatisticamente (p<0,05) , pelo teste ANOVA One way com pós teste de Bonferroni (F= 3,579 e p= 0,045).
Observado apenas diferença estatística entre os grupos Curcumina (a) (100mg/kg) e Anfotericina B (b) (3
mg/kg). Grupos com n=8.
FIGURA 25. Hemácias totais de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes diferem
estatisticamente (p<0,05) , pelo teste ANOVA One way com pós teste de Bonferroni (F= 3,445 e p= 0,030).
Observado apenas diferença estatística entre os grupos Curcumina (100mg/kg) (a) e Anfotericina B (3 mg/kg)
(b). Grupos com n=8.
35
FIGURA 26. Hemoglobina de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam diferença
estatística (p<0,05), pelo Teste ANOVA One way com pos teste de Bonferroni (F= 3,054 e p=0,045). Observado
diferença estatística entre os grupos Curcumina (100mg/kg) (a) e Anfotericina B (3 mg/kg) (b). Grupos com n=8.
Em relação aos leucócitos, experimentos verificaram uma diminuição dos valores em
relação aos animais controle (MANENTE, 2013), resultado que não foi reproduzido neste
experimento, em que não ocorreu diferença significativa entre os grupos (FIGURA 27). Dessa
forma, a droga não causou uma imunossupressão nos animais, o que geraria uma leucopenia
bem como a aplicação não ocasionou um processo inflamatório ou infeccioso, o que
ocasionaria uma leucocitose.
Não foi verificada alteração no número de leucócitos do grupo Curcumina, sendo
assim o pigmento não causou alterações imunológicas nos animais como a leucopenia.
36
FIGURA 27. Leucócitos Totais de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que não há
diferença estatística (p>0,05) , pelo teste ANOVA One way (F= 2,698 e p=0,065). Não houve diferença
estatistica entre os grupos (n=8).
Não ocorreu diferença significativa entre os grupos para o parâmetro proteína
plasmática total (FIGURA 28), assim como no experimento anterior.
FIGURA 28. Proteína Plasmática Total de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que
não há diferença estatística (p>0,05). Teste ANOVA One way (F=2,288 e p= 0,100). Não ocorreram diferenças
estatísticas entre os grupos (n=8).
37
5.2.2 Parâmetros Bioquímicos Renais
Os animais não apresentaram diferença estatística para o critério creatinina sérica
conforme pode ser verificado na FIGURA 29. Este resultado difere de Manente (2013), que
obteve diferença entre os grupos controle e Anfotericina. Peixoto (2008) e Carraro (2013) não
verificaram alterações nesse parâmetro, sendo descrito a via de administração (IP) como a
causa de menor toxicidade. No caso deste experimento, a creatinina manteve-se nos valores
normais indicando que não ocorreu toxicidade. Em um experimento em que foi realizada uma
única aplicação intravenosa de 5mg/kg de Anfotericina desoxicolato em ratos, com coleta do
sangue dos animais 72 horas após, foi observado aumento significativo da creatinina e uréia
dos animais (os valores foram maiores que o dobro do valor dos controles), indicando
nefrotoxicidade (ITALIA et al., 2009), diferindo dos resultados obtidos. Nahar et al. (2008)
observou alterações na uréia e creatinina dos animais após 7 aplicações de Anfotericina B.
FIGURA 29. Creatinina Sérica de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que não há
diferença estatística (p>0,05). Teste ANOVA one way (F=0,562 e p=0,644) Não ocorreram diferenças
estatísticas entre os grupos (n=8).
Em relação a uréia, verificou-se diferença estatística entre o grupo controle e
Anfotericina B (FIGURA 30) confirmando outros estudos que mostram que ocorre diferença
estatística entre o grupo controle a Anfotericina B (2 mg/kg via intravenosa durante 4 dias)
(SOUZA, SALDIVA e CAMPA, 2000), 2 mg/kg intravenoso por 14 dias em ratos (FUKUI et
al., 2003) e 3 mg/kg intravenoso por 5 dias em ratos (MANENTE, 2013). Entretanto no
38
experimento B o grupo Anfotericina B apresentou uma média deste parâmetro menor que o
controle, enquanto os outros experimentos verificaram aumento nesse parâmetro Esse fato
ocorre normalmente em caso de dieta pobre em proteína e insuficiência hepática A uréia pode
ser considerada um indicador hepático, pois a conversão de amônia em uréia ocorre no fígado,
sendo assim, caso este órgão esteja lesionado pode ocorrer uma diminuição nesta conversão e
com isso na diminuição uréia sanguínea.com aumento da amônia na circulação sanguínea
(GONZÁLEZ e SCHEFFER, 2003). Visto que não foram observadas outras alterações que
pudessem confirmar essas possíveis causas, pois todos os animais ingeriram a mesma ração e
não foram observadas alterações nas enzimas hepáticas e histopatológico que confirmassem a
insuficiência hepática.
A Curcumina não alterou os valores de creatinina ou uréia dos animais, indicando que
não ocorreu alteração renal nos animais tratados com o pigmento, dessa forma a Curcumina
não se mostrou nefrotóxica.
FIGURA 30. Uréia sérica de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes diferem
estatisticamente (p<0,05) , Diferiram estatisticamente os grupos Controle (a) e Anfotericina B (3mg/kg) (b).
Teste ANOVA (F= 3,774 e p=0,022) com pós teste de Bonferroni. Grupos com n=8.
5.2.3 Parâmetros Bioquímicos Hepáticos
Não ocorreram diferenças em relação ao parâmetro ALT (FIGURA 31). Este resultado
corrobora com outros estudos, em que o fármaco foi utilizando por via intravenosa em ratos
39
por 14 dias (2mg/kg) sem alteração na ALT dos animais (FUKUI et al., 2003), e como de
Manente (2013) (3mg/kg/IV/5dias em ratos) que não verificou alteração.
FIGURA 31. ALT de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina (100mg/kg)
por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que não há diferença
estatística (p>0,05). Não ocorreram diferenças estatísticas entre os grupos (n=8). Teste ANOVA One way (F=
3,774 e p=0,022).
Não foi observada alteração no Fosfatase Alcalina dos animais (FIGURA 32) , tal qual
descrito por Manente (2013) e verificada no experimento A.
FIGURA 32. Fosfatase Alcalina de ratos Wistar tratados com Anfotericina B intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que não há
diferença estatistica (p>0,05). Não ocorreram diferenças estatísticas entre os grupos (n=8). Teste ANOVA
(F=1,496 e p= 0,237).
40
A Curcumina não provocou qualquer alteração nas enzimas hepáticas, tal qual
observado em outro experimento com ratos Gutierres (2011), que utilizou Curcumina por via
oral na dose de 90 mg/kg durante 31 dias (n=8), sem qualquer hepatotoxicidade.
5.2.4 Exames Histopatológicos
No exame histopatológico foi observada esteatose hepática em todos os grupos
(FIGURAS 33 a 36).
FIGURA 33. Fotomicrografia (HE-400x) do fígado de animal controle (400x) do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa. Presença de
infiltrado linfoplasmocitário (seta) e esteatose hepática (seta grossa).
41
FIGURA 34. Fotomicrografia (HE-400x) do fígado de animal tratado com Curcumina do experimento do efeito
da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
Presença de esteatose hepática (seta).
FIGURA 35. Fotomicrografia (HE-400x) do fígado de animal tratado com Anfotericina B do experimento do
efeito da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5
dias. Presença de esteatose hepática (seta).
42
FIGURA 36. Fotomicrografia (HE-400x) do fígado de animal tratado com Anfotericina B e Curcumina do
experimento do efeito da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via
intravenosa por 5 dias. Esteatose hepática (seta).
A esteatose hepática é pode ser causada pelo acúmulo de gordura nas células do
fígado, provocada pelo aumento de lipídeos na dieta (DA SILVA, 2007; MULLER, 2012)
Essa alteração foi observada em todos os grupos. A esteatose discreta, como verificado neste
experimento, não causou aumento das enzimas hepáticas.
Em todos os grupos do experimento não foi observada qualquer alteração renal
(FIGURA 37 a 40). Entre as alterações histopatológicas causadas pela Anfotericina B estão
lesões glomerulares que incluem espessamento ou fragmentação das membranas basais
hipercelularidade fibrose e hialinização tubular, atrofia do ramo ascendente da alça de Henle e
túbulos contornados distais, além de nefrocalicinolise (depósito de cálcio na parênquima ou
túbulos renais) (BAGNIS e DERAY, 2002).
43
FIGURA 37. Fotomicrografia (HE-400x) do rim de animal do grupo controle do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
FIGURA 38. Fotomicrografia (HE-400x) do rim de animal do grupo Curcumina do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias. Sem
evidência de alterações renais.
44
FIGURA 39. Fotomicrografia (HE-400x) do rim de animal do grupo Anfotericina B do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via intravenosa por 5 dias.
Ausência de alterações.
FIGURA 40. Fotomicrografia (HE-400x) do rim de animal do grupo Anfotericina B e Curcumina do
experimento do efeito da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B (3mg/kg) via
intravenosa por 5 dias. Sem alterações.
45
5.3. EXPERIMENTO EFEITO DA CURCUMINA SOBRE A TOXICIDADE DA
ANFOTERICINA B INTRAVENOSA ANFORIN (EXPERIMENTO C).
O experimento foi realizado nos mesmos moldes do Experimento B, porém a
Anfotericina B utilizada foi a de uso hospitalar comercial. Mesmo com uma dose baixa da
droga os animais apresentaram a sintomatologia de toxicidade aguda descrita em humanos,
entretanto, por se tratar de um experimento não foi utilizado o tratamento para reverter esses
sinais que se utiliza em humanos, como corticoides, paracetamol, difenidramina e heparina
(GOODWIN et al., 1995).
Durante as injeções intravenosas os animais apresentaram sinais de toxicidade aguda
da droga, ocasionando o óbito de 5 animais do grupo Anfotericina e 3 animais do grupo
Anfotericina/Curcumina (FIGURA 41).
FIGURA 41. Fluxograma do Experimento de Anfotericina B desoxicolato (1mg/kg/IV) e Curcumina
(100mg/kg/VO) indicando o numero de animais em cada grupo, nos respectivos dias do experimento. Percebe-se
a morte de 5 animais do grupo Anfotericina B desoxicolato e 3 do grupo Anfotericina B
desoxicolato/Curcumina.
Os sinais observados foram taquicardia, dispneia, tremores musculares, convulsão,
sangramento nasal (FIGURA 42) e movimentos incoordenados. Essas alterações físicas não
foram observadas em nenhum animal dos outros experimentos (A e B).
46
FIGURA 42. Fotografia de animal tratado com Anfotericina B desoxicolato (1mg/kg intravenoso). percepe-se
sangramento nasal. O animal apresentou esse sinal, além de convulsões, tremores e dispnéia imediatamente após
a administração do fármaco.
Em estudo retrospectivo, Wright e colaboradores (1981) observaram a presença de
toxicidade pulmonar em humanos neutropenicos que receberam transfusão de leucócitos e
foram tratados com Anfotericina B desoxicolato. Foram estudados 22 pacientes e destes 14
(64%) apresentaram deterioração respiratória aguda, com sinais de dispneia, hipoxemia e
infiltrados intersticiais em radiografias, sendo que destes cinco faleceram com sinais
semelhantes aos observados nos animais.
Não se tem total conhecimento sobre o mecanismo pelo qual a Anfotericina B
desoxicolato provoca as reações infusionais, acredita-se que se deve a secreção de citocininas
inflamatórias (fator de necrose tumoral e interleucinas) por macrófagos ativados (ARNING et
al., 1995).
Já foi observado que in vitro a Curcumina atua inibindo a produção de um
lipolissacarídeo pelos macrófagos humanos e com isso impedindo liberação do fator de
necrose tumoral e interleucina (CHAN, 1995; SHARMA et al., 2007). Esse fato pode explicar
porque ocorreu uma menor mortalidade no grupo tratado com Anfotericina B
desoxicolato/Curcumina quando comparados com o grupo que recebeu apenas Anfotericina B
desoxicolato.
Um dos fatores que podem ter levado ao óbito dos animais é a velocidade de infusão
da droga, visto que em estudos em humanos, a infusão continua da Anfotericina B
47
desoxicolato (24 horas) apresentou menos efeitos relacionados a infusão rápida (4 horas)
(ERIKSSON, SEIFERT e SCHAFFNER, 2001). A infusão lenta da droga nos animais seria
uma alternativa para redução dos efeitos apresentados, visto que em humanos ela é mais bem
tolerada, propiciando menores efeitos infusionais e renais (IMHOF, WALTER e
SCHAFFNER, 2003). A menor toxicidade na infusão continua deve-se principalmente a
ligação da droga com proteínas plasmáticas, sendo que nas infusões rápidas uma maior
quantidade de droga liga-se as proteínas, resultando numa redistribuição rápida aos tecidos
(LEWIS e WIEDERHOLD, 2003). Não foi possível a aplicação do fármaco de forma
contínua devido ao estresse que seria causado aos animais, sendo necessária sua sedação, que
ocasionaria efeitos hepáticos e renais que não poderiam ser abstraídos dos ocasionados pela
Anfotericina B desoxicolato.
5.3.1 Parâmetros Hematológicos
Em relação aos parâmetros hematológicos verificou-se que diferiram estatisticamente
os grupos Controle e Anfotericina desoxicolato/Curcumina; Controle e Curcumina no
hematócrito (FIGURA 43) e número de hemácias (FIGURA 44) e hemoglobina (FIGURA
45). Esses resultados diferem do Experimento B, apesar de ser utilizado o pigmento do
mesmo frasco (mesmo fabricante, lote). Como ambos os grupos que receberam a Curcumina
apresentaram alteração hematológica, conclui-se que o composto natural causou a
modificação.
48
FIGURA 43. Hematócrito de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam
diferença estatística (p<0,05). Observado diferença estatística entre os grupos Curcumina (b) (n=10) (100mg/kg)
e Controle (a) (n=10); Anfotericina B desoxicolato/Curcumina (b) (n=7) e o grupo Controle (a) (n=10). Teste
ANOVA One Way com pós teste de Bonferroni (F= 3,993 e p= 0,017).
FIGURA 44. Hemacias de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam
diferença estatística (p<0,05). Observado diferença estatística entre os grupos Curcumina (b) (n=10) (100mg/kg)
e Controle (a) (n=10); Anfotericina B desoxicolato/Curcumina (b) (n=7) e o grupo Controle (a) (n=10). Teste
ANOVA One Way com pós teste de Bonferroni (F= 3,9103 e p= 0,019).
49
Essam e Ashraf (2013) administraram a Curcumina em camundongos (600mg/kg) por
6 semanas, e observaram alteração hematológicos dos animais, entretanto sem significância
estatística quando comparado com o grupo controle, diferindo dos resultados apresentados
neste experimento. Verificou-se que a Curcumina causou diminuição nos parâmetros
hematológicos no Experimento C, o que não ocorreu no Experimento B.
FIGURA 45. Hemoglobina de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam
diferença estatística (p<0,05). Observado diferença estatística entre os grupos Curcumina (b) (n=10) (100mg/kg)
e Controle (a) (n=10); Anfotericina B desoxicolato/Curcumina (b) (n=7) e o grupo Controle (a) (n=10). Teste
ANOVA One Way com pós teste de Bonferroni Teste ANOVA com pós teste de Bonferroni (F= 3,973 e p=
0,021).
Utilizando Anfotericina desoxicolato (0,5 mg/kg/IV/21 dias) em camundongos (n=5),
foi observada diferença estatística no parâmetro hematócrito (LARABI et al., 2004), diferindo
do resultado obtido no Experimento C, essa diferença nos resultados pode ter sido causada
pelo tempo do experimento, que na dose de 1 mg/kg/5 dias não causou hematotoxicidade.
O hematócrito dos animais do Grupo Anfotericina/Curcumina, bem como a
hemoglobina, hemácias e proteína plasmática apresentaram-se ligeiramente abaixo dos
valores de referencia podendo indicar uma discreta toxicidade hematológica (FIGURAS 43,
44 e 45). Como o Grupo Anfotericina não apresentou alteração neste parâmetro não se pode
dizer que a droga tenha causado a toxicidade muito menos que a Curcumina protegeu contra a
ação da primeira.
50
A respeito do número total de leucócitos dos animais (FIGURA 46) observou-se
diferença entre os grupos Controle e Anfotericina desoxicolato/Curcumina e entre os grupos
Curcumina e Anfotericina desoxicolato/Curcumina; Curcumina e Anfotericina. Percebe-se
leve leucocitose no grupo Anfotericina/Curcumina e leucopenia no Grupo Curcumina. Não
foi encontrado esse resultado no Experimento B, visto que não ocorreu diferença estatística
entre os grupos (FIGURA 27). Visto que o experimento foi realizado nos mesmos moldes do
experimento B, considera-se essa alteração um achado, pois o grupo em que foi utilizada
apenas a Anfotericina B não ocorreu nenhuma alteração que pudesse justificar a leucocitose
do grupo Anfotericina/Curcumina.
FIGURA 46. Leucócitos Totais de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg)
e Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam
diferença estatística (p<0,001). Teste ANOVA com pós teste de Bonferroni (F= 16,665 e p<0,001). Diferiram do
grupo Controle (bc) (n=10) e Anfotericina/Curcumina (a) (n=7).
Não ocorreu alteração na proteína plasmática em nenhum grupo (FIGURA 47), assim
como no experimento B (FIGURA 28).
51
FIGURA 47. Proteína Plasmática de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa
(3mg/kg) e Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais
indicam que não há diferença estatística (p>0,05). Sem diferença estatística entre os grupos. Teste ANOVA One
way (F= 0,864 e p= 0,471).
5.3.2 Parâmetros Bioquímicos Renais
Quanto aos testes renais, não foi observada diferença estatística quanto a creatinina
(FIGURA 48) dos animais, estando todos os valores dentro dos limites normais. Esse
resultado difere de outros experimentos, sendo observado após 24 horas da administração
intravenosa de 1mg/kg de Anfotericina desoxicolato em ratos (1mg/kg) os animais
apresentaram aumento de 87% da creatinina sérica quando comparada com seu valor basal
(RISOVIC et al., 2003). No experimento B não ocorreram diferenças estatísticas entre os
grupos (FIGURA 29). Larabi e colaboradores (2004) não encontraram toxicidade renal na
infusão intravenosa de Anfotericina B em camundongos (0,5 mg/kg/IV/21 dias). Risovic et al.
(2003) verificou alteração 24 horas após a administração do fármaco, dessa forma o tempo de
coleta tardio pode ter sido uma das causas de não terem sido encontradas diferenças entre os
grupos para a creatinina.
52
FIGURA 48. Creatinina Sérica de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam que
não há diferença estatística (p>0,05). Teste ANOVA One Way com pós teste de Bonferroni (F= 2,935 e p=
0,051). Não ocorreu diferença estatística entre os grupos.
A respeito da concentração de uréia sanguínea (FIGURA 49) diferiram os grupos
Controle
e
Anfotericina
desoxicolato/Curcumina;
Curcumina
e
Anfotericina
desoxicolato/Curcumina, sendo que este grupo apresentou valores maiores da concentração
deste metabólito. Esse aumento na uréia do grupo Anfotericina/Curcumina pode ser um
indício de lesão renal, como citado anteriormente, visto que a creatinina tem uma elevação
tardia na lesão renal quando comparada com a uréia, entretanto não foi observada diferença
estatística no grupo que utilizou apenas Anfotericina B, um fármaco conhecidamente
nefrotóxico, sendo assim esse aumento pode ter ocorrido devido uma sobrecarga renal para
excreção de ambos os fármacos. Como o grupo Curcumina não apresentou diferenças em
relação ao grupo controle tanto para uréia como para creatinina, conclui-se que o composto
natural não parece levar a nefrotoxicidade.
53
FIGURA 49. Uréia serica de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e
Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam
diferença estatística (p<0,05). Observado diferença estatística entre os grupos Curcumina (b) (100mg/kg) (n=10)
e Anfotericina B desoxicolato(1mg/kg)/Curcumina (a) (n=7) e o grupo Controle (b) (n=10) Anfotericina B
desoxicolato/Curcumina (a) (n=7). Teste ANOVA com pós teste de Bonferroni (F= 4,073 e p= 0,016).
5.3.3 Parâmetros Bioquímicos Hepáticos
A concentração da enzima alanina aminotransferase (ALT) sanguínea diferiu entre os
grupos Anfotericina B desoxicolato e Curcumina como descrito na FIGURA 50, à enzima
ALT encontra-se elevada no grupo Curcumina quando comparada ao Anfotericina B
desoxicolato, que poderia estar relacionada a metabolização do composto natural, mas este
fato não ocorreu no Experimento B, desse modo não pode-se confirmar esta hipótese. Larabi
(2004) observou o aumento da ALT em camundongos tratados com Anfotericina B
desoxicolato e o grupo controle, o que não foi observado neste experimento. No experimento
B não ocorreram alterações na ALT dos animais (FIGURA 30). Como a ALT dos animais não
diferiu do grupo controle, podemos afirmar que a Anfotericina B desoxicolato não lesionou os
hepatócitos dos animais.
54
FIGURA 50. ALT de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg) e Curcumina
(100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras diferentes indicam diferença
estatística (p<0,05). Observado diferença estatística entre os grupos Curcumina (b) (100mg/kg) (n=10) e
Anfotericina B desoxicolato(1mg/kg) (n=5). Teste ANOVA One way com pós teste de Bonferroni (F= 3,177 e
p= 0,039).
A Fosfatase Alcalina (FIGURA 51) não apresentou diferença estatística entre os
grupos, assim como no Experimento B (FIGURA 32). Esse resultado apoia o resultado obtido
por Gutierrez (2011) que não observou aumento da FA em ratos tratados com Curcumina
(90mg/kg/VO/30 dias) e camundongos que receberam o pigmento (600mg/kg/VO/6 semanas)
(ESSAM e ASHRAF), 2013). Observa-se que os animais tratados apenas com Curcumina não
apresentaram alterações hepáticas. A Anfotericina B desoxicolato na dose de 1mg/kg/5 dias
não causou alterações hepáticas, não sendo hepatotóxica nessa dose e período de
administração.
55
FIGURA 51. Fosfatase Alcalina de ratos Wistar tratados com Anfotericina B desoxicolato intravenosa (3mg/kg)
e Curcumina (100mg/kg) por via oral por 5 dias. Valores apresentados em média ± DP. Letras iguais indicam
que não há diferença estatística (p>0,05). Não ocorreu diferença estatística. Teste ANOVA One way (F= 1,609 e
p= 0,210).
5.3.4 Exames Histopatológicos
Não foram observadas alterações hepáticas histopatológicas nos animais do
experimento C, conforme verificado nas FIGURAS 52 a 55. Os cortes histológicos
apresentam tecido hepático com arquitetura geral preservada, com ausência de fibrose ou
atividade necro-inflamatória, com espaço porta preservado, sem agressão a placa limitante,
sendo os hepatócitos dispostos em traves regulares. Esse resultado corrobora com os exames
bioquímicos que não apresentaram alterações hepáticas e renais nos animais tratados com
Curcumina e no grupo em que foi administrado Anfotericina B, diferindo do trabalho de
Carraro (2013) que observou alterações renais em ratos tratados com Anfotericina B.
56
FIGURA 52. Fotomicrografia (HE-100x) do fígado de animal do grupo controle do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por
5 dias. Sem sinais de alterações hepáticas.
FIGURA 53. Fotomicrografia (HE-100x) do fígado de animal do grupo Curcumina do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por
5 dias. Parênquima hepático normal.
57
FIGURA 54. Fotomicrografia (HE-100x) do fígado de animal do grupo Anfotericina B do experimento do efeito
da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa
por 5 dias. Sem alterações hepáticas.
FIGURA 55. Fotomicrografia (HE-100x) do fígado de animal do grupo Anfotericina B/Curcumina do
experimento do efeito da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato
(1mg/kg) via intravenosa por 5 dias. Ausência de alterações hepáticas.
58
Nos cortes histológicos do tecido renal dos animais não foram observadas alterações
(FIGURAS 56 a 59), sendo que todos os grupos apresentavam parênquima renal com
glomérulos em número adequado, sem alterações histológicas e alças capilares patentes.
Ausência de alterações túbulo intersticiais. Conclui-se assim, em conjunto com os resultados
obtidos nos exames bioquímicos que a Anfotericina B desoxicolato não foi nefrotóxica nessa
dose e período (1mg/kg/5 dias). Os ratos tratados com Curcumina não apresentaram qualquer
alteração renal, dessa foram o pigmento não causa toxicidade, podendo ser utilizado com
segurança por pacientes com disfunções renais.
FIGURA 56. Fotomicrografia (HE-100x) do rim de animal do grupo controle do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1 mg/kg) via intravenosa por
5 dias. Parênquima renal sem alterações e sem alterações túbulo-intersticiais.
59
FIGURA 57. Fotomicrografia (HE-100x) do rim de animal do grupo Curcumina do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por
5 dias. Parênquima renal sem alterações e sem alterações túbulo-intersticiais.
FIGURA 58. Fotomicrografia (HE-100x) do rim de animal do grupo Anfotericina B do experimento do efeito da
Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato (1 mg/kg) via intravenosa por
5 dias. Parênquima renal sem alterações e sem alterações túbulo-intersticiais.
60
FIGURA 59. Fotomicrografia (HE-100X) do rim de animal do grupo anfotericina/CURCUMINA do
experimento do efeito da Curcumina (100mg/kg) via oral sobre a toxicidade da Anfotericina B desoxicolato
(1mg/kg) via intravenosa por 5 dias. Parênquima renal sem alterações e sem alterações túbulo-intersticiais.
5.3.5 Peso Corporal
Os animais do Experimento C foram pesados diariamente, sendo possível observar na
FIGURA 60 a diminuição de peso dos animais do grupo Anfotericina Desoxicolato. No grupo
Curcumina pode verificar-se o aumento de peso ao longo dos dias, resultado que corrobora
com Gutierrez (2011), em que ratos que receberam Curcumina (90mg/kg/VO/30 dias)
apresentaram incremento no peso, assim como o grupo controle.
61
FIGURA 60. Peso dos animais ao longo do experimento do efeito da Curcumina (100mg/kg) via oral sobre a
toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por 5 dias. O grupo Anfotericina B (n inicial
=10, final n=5) desoxicolato diferiu estatisticamente p<0,05 de todos os outros grupos. O grupo Curcumina
(n=10) diferiu dos grupos Anfotericina e Anfotericina/Curcumina (n inicial =10 e final n=7), não apresentando
diferença estatística do grupo Controle (n=10). Teste ANOVA para medidas repetidas pós teste de Sidak.
Os animais do Grupo Anfotericina apresentaram diminuição do peso, confirmando os
achados de Keim et al. (1976) que utilizando Anfotericina B intraperitoneal verificou queda
no peso dos animais. Não ocorreu diferença estatística entre o grupo Curcumina e o grupo
controle, tal quais os resultados de Gutierrez (2011). Dessa forma o composto natural é seguro
para utilização, por não provocar toxicidade ou diminuição na ingestão de alimentos devido a
sua palatabilidade.
O grupo Anfotericina/Curcumina apresentou queda no peso ao longo desse
experimento, essa queda ocorreu devido à aplicação da Anfotericina B desoxicolato, pois o
grupo que recebeu apenas esse fármaco apresentou diminuição do peso, entretanto a utilização
em conjunto com a Curcumina não foi eficaz para prevenir essa perda de peso.
62
TABELA 2. Peso dos animais ao longo do experimento do efeito da Curcumina (100mg/kg)
via oral sobre a toxicidade da Anfotericina B desoxicolato (1mg/kg) via intravenosa por 5
dias. Expresso em Média e Desvio Padrão. (Valores em gramas). Teste ANOVA para
medidas repetidas pós teste de Sidak. Os animais do grupo Anfotericina diferiram de peso ao
DIA
CONTROLE CURCUMINA ANFOTERICINA ANFO/CUR
(CO)
(CUR)
(COMB)
(ANF)
CONTRASTES
Média
DP
Média
DP
Média
DP
Média DP
SIGNIFICATIVOS
Efeito grupo em
cada dia
CO x ANF ; ANF x
COMB
1
364,1
15,2
372,9
14,1
389,0
27,2
359,6 12,2
2
362,9
15,9
368,2
18,8
378,9
24,9
358,5 10,8
3
366,3
16,7
372,3
17,4
374,7
26,7
348,0 11,5
CUR x COMB ;
ANF x COMB
4
368,0
17,3
371,2
18,6
373,2
27,8
347,4
ANF x COMB
5
363,4
16,9
371,1
18,5
368,2
30,2
341,2 13,2
CUR x COMB ;
ANF x COMB
6
366,7
17,8
372,4
16,6
366,6
28,8
343,3 13,1
ANF x COMB
9,6
CONTRASTES
SIGNIFICATIVOS
Efeito do dia
dentro grupo
1 x TODOS
1 x TODOS
6 x 2,3,4
2 x TODOS
5x6
longo dos dias assim como o Grupo Anfotericina/Curcumina.
Em relação a alteração de peso ao longo dos dias nos grupos (TABELA 2) , percebe-se
que o grupo Curcumina não apresentou diferença estatística em relação ao peso ao longo dos
dias, enquanto o grupo Anfotericina apresentou queda relativa no peso como pode ser
verificado pela diferença entre o dia 1 e todos os outros dias, sendo assim, ele diferiu de seu
peso inicial em todos os dias de aplicação, apresentando uma queda contínua, sendo um
indício de toxicidade. O grupo Anfotericina/Curcumina apresentou diferença significativa
entre os dias, demonstrando uma queda significativa de peso em relação ao peso inicial.
63
Em relação ao peso dos animais entre os grupos, percebe-se diferença entre os grupos
Anfotericina e Anfotecina/Curcumina (exceto no dia 2). Percebe-se assim uma
homogeneidade no peso dos animais entre os grupos, diferindo apenas o grupo
Anfotericina/Curcumina (animais mais leves). Entretanto, quando verifica-se a perda de peso
durante todo o experimento os animas do Grupo Anfotericina e os animais do Grupo
Anfotericina/Curcumina apresentaram uma perda acentuada de peso, indicando a toxicidade
da Anfotericina, sem a proteção da Curcumina.
64
CONSIDERAÇÕES FINAIS
A via intraperitoneal não foi efetiva para causar toxicidade renal e hepática, assim
como verificado por Peixoto (2008). Esse fato pode estar relacionado a biodisponibilidade da
droga, visto que pela via intraperitoneal ela precisa ser absorvida pelo peritônio, metabolizada
pelo fígado para então ganhar a corrente sanguínea, no caso da via intravenosa a droga é
aplicada diretamente na corrente circulatória. Apesar de serem utilizadas doses altas do
fármaco, não ocorreram lesões histopatológicas ou alterações significativas nos parâmetros
bioquímicos que pudessem indicar dano renal ou hepático, não sendo indicada a utilização
desta via para causar a toxicidade. Foram verificados indícios de toxicidade hematológica por
esta via. Novos estudos podem ser feitos neste sentido com o uso dessa via no intuito de
diminuir os efeitos tóxicos da droga.
Na via intravenosa não foi observada toxicidade renal, hepática e hematológica da
Anfotericina B. Dentre das possíveis está a formulação da droga, pois há descrição na
literatura de efeitos diferentes utilizando Anfotericina Lipossomal, mas de marcas distintas
(OLSON et al., 2008).
Não foi possível verificar a toxicidade renal e hepática da Anfotericina B desoxicolato
na dose e tempo de 1mg/kg/5 dias, dessa forma a dose e tempo de experimento foram
insuficientes para provocar esses efeitos.
A Curcumina não alterou os parâmetros hematológicos ou bioquímicos dos ratos no
Experimento B, quando comparados aos controles, o que é um resultado positivo visto que
este composto natural vem sendo estudado e muito utilizado. Não provocou alterações
histopatológicas no experimento C. Dessa forma pode-se concluir, pelos experimentos B e C,
que o pigmento não é hepato ou nefrotóxico.
A Anfotericina B desoxicolato causou efeitos agudos durante a infusão, levando a
morte de 50% dos animais. No grupo tratado com a Curcumina ocorreram menos mortes,
dessa forma surgem novas indagações a respeito da utilização desse pigmento para
diminuição dos efeitos de infusão, sendo necessários novos estudos.
A
Anfotericina
causou
perda
de
peso
nos
animais
Anfotericina
e
Anfotericina/Curcumina, demonstrando toxicidade. A Curcumina não conseguiu prevenir essa
65
perda de peso, entretanto o pigmento sozinho não provocou qualquer alteração no peso dos
animais.
66
CONCLUSÃO
Não foi possível determinar a dose toxica renal e hepática da Anfotericina B.
Observou-se aumento da uréia dos animais tratados com 80mg/kg/10 dias, mas não foi
possível confirmar a toxicidade renal, pois não ocorreram alterações em outros parâmetros.
Observou-se toxicidade hematológica discreta com a aplicação de Anfotericina B
intraperitoneal (40mg/kg/10 dias e 80mg/kg/10 dias). Foi observada perda de peso nos
animais
do
grupo
Anfotericina
(1mg/kg/IV/5
dias)
bem
como
no
grupo
Anfotericina/Curcumina.
A Curcumina não provocou alterações renais e hepáticas. Causou discreta alteração
hematológica no experimento C, mas não pode ser confirmado visto que no experimento B
não se verificou qualquer alteração. Não provocou alteração no peso dos animais.
Não foi observada a reversão dos efeitos tóxicos da Anfotericina B pela Curcumina,
nos parâmetros bioquímicos e histopatológicos, pois não ocorreu toxicidade nas doses
utilizadas da Anfotericina B nos experimentos em que esta foi utilizada em conjunto com a
Curcumina. A Curcumina não preveniu a perda de peso dos animais tratados com
Anfotericina B e Curcumina.
67
REFERÊNCIAS
ABAJO, F.; CARCAS, A. Drug points: Amphotericin B hepatotoxicity. British Medical
Journal, v. 293, p. 1243, 1986.
AGGARWAL, B. B.; HARIKUMAR, K. B. Potential therapeutic effects of curcumin, the
anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic,
autoimmune and neoplastic diseases. Int J Biochem Cell Biol, v. 41, p. 40-59, 2009.
AHMIDA, M. H. Protective role of curcumin in nephrotoxic oxidative damage induced by
vancomycin in rats. Exp Toxicol Pathol, v. 64, p. 149-53, 2012.
ALI, B. H., AL‐WABEL, N., MAHMOUD, O., MOUSA, H. M., & HASHAD, M. Curcumin
has a palliative action on gentamicin‐induced nephrotoxicity in rats. Fundamental & clinical
pharmacology, v. 19, p. 473-477, 2005.
ALVES, A. Análises histopatológicas: porque demoram os resultados, Proceedings of the
Veterinary Sciences Congress, Oeiras, v.12, p. 239-247, 2002.
AMARAL, A. C., BOCCA, A. L., RIBEIRO, A. M., NUNES, J., PEIXOTO, D. L.,
SIMIONI, A. R., et al. Amphotericin B in poly(lactic-co-glycolic acid) (PLGA) and
dimercaptosuccinic acid (DMSA) nanoparticles against paracoccidioidomycosis. J Antimicrob
Chemother, v. 63, p. 526-33, 2009.
AN, M.; SHEN, H.; CAO, Y.; ZHANG, J.; WANG, Y.; JIANG, R.; Allicin enhances the
oxidative damage effect of amphotericin B against Candida albicans. International Journal of
Antimicrobial Agents. v. 33, p. 258-263, 2009.
ARNING, M., KLICHE, K. O., HEER‐SONDERHOFF, A. H., & WEHMEIER, A. Infusionrelated toxicity of three different amphotericin B formulations and its relation to cytokine
plasma levels. Mycoses, v. 38, p. 459-65, 1995.
AWAD, A. S.; EL-SHARIF, A. A. Curcumin immune-mediated and anti-apoptotic
mechanisms protect against renal ischemia/reperfusion and distant organ induced injuries.
International immunopharmacology, v. 11, p. 992-996, 2011.
68
BABU, B.; SHYLESH, B.; PADIKKALA, J. Antioxidant and hepatoprotective effect of
(Acanthus ilicifolius). Fitoterapia, v. 72, p. 272-277, 2001.
BAGNIS, C. I.; DERAY, G. Amphotericin B nephrotoxicity. Saudi Journal of Kidney
Diseases and Transplantation, v. 13, p. 481, 2002.
BAO, W., LI, K., RONG, S., YAO, P., HAO, L., YING, C. et al. Curcumin alleviates ethanolinduced hepatocytes oxidative damage involving heme oxygenase-1 induction. J
Ethnopharmacol, v. 128, p. 549-53, 2010.
BENNETT, J. E., DISMUKES, W. E., DUMA, R. J., MEDOFF, G., SANDE, M. A.,
GALLIS, H. et al. A comparison of amphotericin B alone and combined with flucytosine in
the treatment of cryptoccal meningitis. New England Journal of Medicine, v. 301, p. 126131, 1979.
BERDICHEVSKI, R. H. Nefrotoxicidade associada à Anfotericina B em pacientes de baixo
risco. 2003. 66f. Dissertação de Mestrado do Programa de Pós Graduação em Ciências
Médicas: Nefrologia - Universidade Federal do Rio Grande do Sul. Porto Alegre. 2003.
BIANCHI, M. L. P., ANTUNES, L. M. G. Radicais livres e os principais antioxidantes da
dieta. Rev Nutr, v. 12, p. 123-30, 1999.
BRANDRISS, M. W., WOLFF, S. M., MOORES, R., & STOHLMAN Jr, F. et al. Anemia
Induced by Amphotericin B. JAMA, v. 189, p. 663-6, 1964.
CARRARO, T, C. M. M. Desenvolvimento, caracterização físico-quimicas e biológicas de
nanopartículas poliméricas contendo Anfotericina B. 2013. 114f. Dissertação de Mestrado de
Ciências Farmacêuticas - Universidade Estadual do Centro-Oeste. Guarapuava. 2013.
CARVALHO, R. F. Estudo in vivo da ação de nanocapsulas de PLGA contendo Anfotericina
B, DMSO e nanopartículas magnéticas no tratamento de leishmniose cutânea experimental
em camundongos C57BL/6 causada por Leishmaniose (Leishmania amazonensis., 2011. 72f.
Dissertação de Mestrado em Ciências da Saúde - Universidade de Brasília. Brasília. 2011.
CEKMEN, M., ILBEY, Y. O., OZBEK, E., SIMSEK, A., SOMAY, A., & ERSOZ, C.
Curcumin prevents oxidative renal damage induced by acetaminophen in rats. Food Chem
Toxicol, v. 47, p. 1480-4, 2009.
69
CHAN, M. M.-Y. Inhibition of tumor necrosis factor by curcumin, a phytochemical.
Biochemical Pharmacology, v. 49, p. 1551-1556, 1995.
CHATTOPADHYAY, A.; JAFURULLA, M. A novel mechanism for an old drug:
amphotericin B in the treatment of visceral leishmaniasis. Biochem Biophys Res Commun, v.
416, p. 7-12, 2011.
DA SILVA, M. A. F. Esteatose hepática em ratos: efeitos de dieta com diferentes níveis de
substituição lipídica por dieptanoína e trieptanoína. 2007. 77p. Dissertação de Mestrado.
Universidade Federal de Alagoas. Maceió. 2007.
DANTAS, J. A., AMBIEL, C. R., CUMAN, R. K. N., BARONI, S., & BERSANI-AMADO,
C. A. Reference values of some physiological parameters in the rats of the Central Biotery at
the State University of Maringá, State of Paraná. Acta sci., Health sci, v. 28, p. 165-70, 2006.
DUPONT, B. Overview of the lipid formulations of amphotericin B. Journal of Antimicrobial
Chemotherapy, v. 49, p. 31-36, 2002.
ECHEVARRIA, J., SEAS, C., CRUZ, M., CHAVEZ, E., CAMPOS, M., CIEZA, J. et al. Oral
rehydration solution to prevent nephrotoxicity of amphotericin B. Am J Trop Med Hyg, v. 75,
p. 1108-12, 2006.
ELLIS, M., SHAMOON, A., GORKA, W., ZWAAN, F., & AL-RAMADI, B. Severe hepatic
injury associated with lipid formulations of amphotericin B. Clinical infectious diseases, v.
32, p. e87-e89, 2001.
ERIKSSON, U.; SEIFERT, B.; SCHAFFNER, A. Comparison of effects of amphotericin B
deoxycholate infused over 4 or 24 hours: randomised controlled trial. BMJ: British Medical
Journal, v. 322, p. 579, 2001.
ESSAM, A. M.; ASHRAF, A. Effect Of Curcumin On Hematological, Biochemical And
Antioxidants Parameters In Schistosoma Mansoni Infected Mice. International Journal of
Sciences, v. 2, p.1-8, 2013.
FAILACE, R. Hemograma: manual de interpretação. 4ª. ed. Porto Alegre, Artmed, 2003,
298p.
70
FALCI, D. R. Anfotericina B deoxicolato em infusão contínua para o tratamento da
meningoencefalite criptocócica: análise de segurança e atividade antifúngica. 2009. 69f.
Dissertação de Mestrado. Universidade Federal do Rio Grande do Sul - Mestrado em
Medicina: Ciências da Saúde. Porto Alegre. 2009.
FAROMBI, E.; EKOR, M. Curcumin attenuates gentamicin-induced renal oxidative damage
in rats. Food and chemical Toxicology, v. 44, p. 1443-1448, 2006.
FILIPPIN, F. B.; SOUZA, L. C. Eficiência terapêutica das formulações lipídicas de
Anfotericina B. Brazilian Journal of Pharmaceutical Sciences, v. 42, p. 167-194, 2006.
FISCHER, M. A., WINKELMAYER, W. C., RUBIN, R. H., & AVORN, J. The
hepatotoxicity of antifungal medications in bone marrow transplant recipients. Clinical
infectious diseases, v. 41, p. 301-307, 2005.
FUKUI, H., KOIKE, T., SAHEKI, A., SONOKE, S., TOMII, Y., & SEKI, J. Evaluation of
the efficacy and toxicity of amphotericin B incorporated in lipid nano-sphere (LNS®).
International journal of pharmaceutics, v. 263, p. 51-60, 2003.
GOEL, A.; KUNNUMAKKARA, A. B.; AGGARWAL, B. B. Curcumin as "Curecumin":
from kitchen to clinic. Biochem Pharmacol, v. 75, p. 787-809, 2008.
GOMES, K. R., SANTOS, M. G. C., FRANCO, D. F., PIRES, R. B., SILVA, M. G. D.,
NEVES, M. F., & BASSANI-SILVA, S. Avaliação de hematócrito e proteína plasmática de
sangue hemodiluídos. Rev. Cient. Eletr. Med. Vet., v. 3, p. 1-5, 2006.
GONZÁLEZ, F. H.; SCHEFFER, J. F. Perfil sanguíneo: ferramenta de análise clínica,
metabólica e nutricional. Simpósio de Patologia Clínica Veterinária da Região Sul do Brasil,
v. 1, p. 73-79, 2003.
GOODWIN, S. D., CLEARY, J. D., WALAWANDER, C. A., TAYLOR, J. W., &
GRASELA, T. H. Pretreatment regimens for adverse events related to infusion of
amphotericin B. Clinical infectious diseases, v. 20, n. 4, p. 755-761, 1995. ISSN 1058-4838.
GUANGWEI, X., RONGZHU, L., WENRONG, X., SUHUA, W., XIAOWU, Z.,
SHIZHONG, W. Curcumin pretreatment protects against acute acrylonitrile-induced
oxidative damage in rats. Toxicology, v. 267, p. 140-6, 2010.
71
GUTIERRES, V. O. Avaliação dos efeitos fisiológicos e bioquimicos do tratamento com
curcumina incorporada ao iogurte no diabetes experimental. 2011. 120 f. Dissertação de
Mestrado em Biociências e Biotecnologia aplicadas à Farmacia - Universidade Estadual
Paulista. Araraquara, 2011.
HARBARTH, S., PESTOTNIK, S. L., LLOYD, J. F., BURKE, J. P., & SAMORE, M. H. et
al. The epidemiology of nephrotoxicity associated with conventional amphotericin B therapy.
Am J Med, v. 111, p. 528-34, 2001.
HEIDEMANN, H. T., BRUNE, K. H., SABRA, R., & BRANCH, R. A. Acute and chronic
effects of flucytosine on amphotericin B nephrotoxicity in rats. Antimicrobial agents and
chemotherapy, v. 36, p. 2670-2675, 1992.
HENDRIX, C. M. Procedimentos laboratoriais para técnicos veterinários. São Paulo: Roca,
2005. 576p.
HOSSEINZADEH, L., BEHRAVAN, J., MOSAFFA, F., BAHRAMI, G., BAHRAMI, A., &
KARIMI, G. Curcumin potentiates doxorubicin-induced apoptosis in H9c2 cardiac muscle
cells through generation of reactive oxygen species. Food Chem Toxicol, v. 49, p. 1102-9,
2011.
IMHOF, A.; WALTER, R. B.; SCHAFFNER, A. Continuous infusion of escalated doses of
amphotericin B deoxycholate: an open-label observational study. Clinical infectious diseases,
v. 36, p. 943-951, 2003.
INSELMANN, G.; INSELMANN, U.; HEIDEMANN, H. T. Amphotericin B and liver
function. Eur J Intern Med, v. 13, p. 288-292, 2002.
ITALIA, J. L., YAHYA, M. M., SINGH, D., & KUMAR, M. R. Biodegradable nanoparticles
improve oral bioavailability of amphotericin B and show reduced nephrotoxicity compared to
intravenous Fungizone. Pharm Res, v. 26, p. 1324-31, 2009.
JUNG, S. H., LIM, D. H., JUNG, S. H., LEE, J. E., JEONG, K. S., SEONG, H., & SHIN, B.
C. Amphotericin B-entrapping lipid nanoparticles and their in vitro and in vivo
characteristics. Eur J Pharm Sci, v. 37, p. 313-20, 2009.
KEIM, G. R., SIBLEY, P. L., YOON, Y. H., KULESZA, J. S., ZAIDI, I. H., MILLER, M.
M., & POUTSIAKA, J. W. Comparative toxicological studies of amphotericin B methyl ester
72
and amphotericin B in mice, rats, and dogs. Antimicrobial agents and chemotherapy, v. 10, p.
687-690, 1976.
KHERADPEZHOUH, E., PANJEHSHAHIN, M. R., MIRI, R., JAVIDNIA, K.,
NOORAFSHAN, A., MONABATI, A., & DEHPOUR, A. R. Curcumin protects rats against
acetaminophen-induced hepatorenal damages and shows synergistic activity with N-acetyl
cysteine. European journal of pharmacology, v. 628, p. 274-281, 2010.
KIM, J. H., CHAN, K. L., FARIA, N. C., MARTINS, M. D. L., & CAMPBELL, B. C.
Targeting the oxidative stress response system of fungi with redox-potent chemosensitizing
agents. Front Microbiol, v. 3, p. 88, 2012.
KLEPSER, M. The value of amphotericin B in the treatment of invasive fungal infections. J
Crit Care, v. 26, p. 225 e1-10, 2011.
KUDVA, A. K., MANOJ, M. N., SWAMY, B. N., & RAMADOSS, C. S. Complexation of
amphotericin B and curcumin with serum albumins: solubility and effect on erythrocyte
membrane damage. Journal of Experimental Pharmacology, v. 3, p. 1-6, 2011.
LANIADO-LABORIN, R.; CABRALES-VARGAS, M. N. Amphotericin B: side effects and
toxicity. Rev Iberoam Micol, v. 26, p. 223-7, 2009.
LARABI, M., PAGES, N., PONS, F., APPEL, M., GULIK, A., SCHLATTER, J. Study of the
toxicity of a new lipid complex formulation of amphotericin B. Journal of Antimicrobial
Chemotherapy, v. 53, p. 81-88, 2004.
LEON, C. G., LEE, J., BARTLETT, K., GERSHKOVICH, P., WASAN, E. K., ZHAO, J et
al. In vitro cytotoxicity of two novel oral formulations of Amphotericin B (iCo-009 and iCo010) against Candida albicans, human monocytic and kidney cell lines. Lipids Health Dis, v.
10, p. 144, 2011.
LEWIS, R. E.; WIEDERHOLD, N. P. The solubility ceiling: a rationale for continuous
infusion amphotericin B therapy? Clinical infectious diseases, v. 37, p. 871-872, 2003.
LIN, A. C., GOLDWASSER, E., BERNARD, E. M., & CHAPMAN, S. W. Amphotericin B
blunts erythropoietin response to anemia. J Infect Dis, v. 161, p. 348-51, 1990.
73
MACGREGOR, R. R.; BENNETT, J. E.; ERSLEV, A. J. Erythropoietin concentration in
amphotericin B-induced anemia. Antimicrobial agents and chemotherapy, v. 14, p. 270-273,
1978.
MAHESHWARI, R. K., SINGH, A. K., GADDIPATI, J., & SRIMAL, R. C. Multiple
biological activities of curcumin: a short review. Life sciences, v. 78, p. 2081-2087, 2006.
MANENTE, F. A. Estudo da associação entre a hesperidina e anfotericina nos danos
hepáticos e renal e nas oxidações bioquímicas. 2013. 87 f. Dissertação de Mestrado em
Ciências Farmacêuticas - Universidade Estadual de Ponta Grossa, Ponta Grossa, 2013.
MAZERSKI, J.; BOROWSKI, E. Molecular dynamics of amphotericin B I. Single molecule
in vacuum and water. Biophys Chem, v. 54, p. 49-60, 1995.
MELO, M. G. D. D., DÓRIA, G. A. A., SERAFINI, M. R., & ARAÚJO, A. A. D. S. Valores
de referência Hematológicos e Bioquímicos de Ratos (Rattus novergicus linhagem Wistar)
provenientes do biotério central da Universidade Federal de Sergipe. Scientia Plena, v. 8, p.
1-6, 2013.
MICELI, M. H.; CHANDRASEKAR, P. Safety and efficacy of liposomal amphotericin B for
the empirical therapy of invasive fungal infections in immunocompromised patients. Infect
Drug Resist, v. 5, p. 9-16, 2012.
MILLER, M. A. Reversible hepatotoxicity related to amphotericin B. Canadian Medical
Association Journal, v. 131, p. 1245, 1984.
MILLER, R. P.; BATES, J. H. Amphotericin B toxicity. A follow-up report of 53 patients.
Ann Intern Med, v. 71, p. 1089-95, 1969.
MOTTA, V. T. Bioquímica Clínica: princípios e interpretações. 4ª. ed., Editora: Médica
Massau, 2003, 419 p.
MRAZEK, M. F.; MOSSIALOS, E. Stimulating pharmaceutical research and development
for neglected diseases. Health Policy, v. 64, p. 75-88, 2003.
74
MULLER, C. D. Mecanismos fisiopatogênicos do uso do óleo de coco em dieta hiperlipídica
em modelo animal In: SALÃO DE INICIAÇÃO CIENTÍFICA, 24, 2012, Porto Alegre:
UFRGS, p.1-5.
MYERS, G. L., MILLER, W. G., CORESH, J., FLEMING, J., GREENBERG, N., GREENE,
T. Recommendations for improving serum creatinine measurement: a report from the
Laboratory Working Group of the National Kidney Disease Education Program. Clin Chem,
v. 52, p. 5-18, 2006.
NAHAR, M., MISHRA, D., DUBEY, V., & JAIN, N. K. Development, characterization, and
toxicity evaluation of amphotericin B–loaded gelatin nanoparticles. Nanomedicine:
Nanotechnology, Biology and Medicine, v. 4, p. 252-261, 2008.
ODABASI, Z., KARAALP, A., CERMIK, H., MOHR, J., TIGEN, E. T., KOC, M., &
KORTEN, V. Reduction of amphotericin B-induced renal tubular apoptosis by Nacetylcysteine. Antimicrob Agents Chemother, v. 53, p. 3100-2, 2009.
OLSON, J. A., ADLER-MOORE, J. P., JENSEN, G. M., SCHWARTZ, J., DIGNANI, M. C.,
& PROFFITT, R. T. Comparison of the physicochemical, antifungal, and toxic properties of
two liposomal amphotericin B products. Antimicrobial agents and chemotherapy, v. 52, p.
259-268, 2008.
PARK, E. J., JEON, C. H., KO, G., KIM, J., & SOHN, D. H. Protective effect of curcumin in
rat liver injury induced by carbon tetrachloride. Journal of Pharmacy and Pharmacology, v.
52, p. 437-440, 2000.
PATEL, G. P.; CRANK, C. W.; LEIKIN, J. B. An evaluation of hepatotoxicity and
nephrotoxicity of liposomal amphotericin B (L-AMB). J Med Toxicol, v. 7, p. 12-5, 2011.
PEIXOTO, D. L. G. Avaliação da biocompatibilidade da anfotericina B em duas
formulações: livre e associada com nanopartículas magnéticas. 2008. 115 f. Dissertação de
Mestrado em Patologia Molecular - Universidade de Brasília. Brasília. 2008.
PINTO, S. B. Comparação entre as dosagens de ast (aspartato aminotransferase) e alt
(alanina aminotransferase) em presença e na ausência de piridoxal fosfato. 2010. 33 f.
Trabalho de Conclusão de Curso em Farmácia - Universidade Estadual do Rio Grande do
Sul. Porto Alegre. 2010.
75
REDDY, A.; LOKESH, B. Effect of curcumin and eugenol on iron-induced hepatic toxicity
in rats. Toxicology, v. 107, p. 39-45, 1996.
REITMAN, S.; FRANKEL, S. A colorimetric method for the determination of serum
glutamic oxalacetic and glutamic pyruvic transaminases. Am J Clin Pathol, v. 28, p. 56-63,
1957.
RISOVIC, V., BOYD, M., CHOO, E., & WASAN, K. M. Effects of lipid-based oral
formulations on plasma and tissue amphotericin B concentrations and renal toxicity in male
rats. Antimicrobial agents and chemotherapy, v. 47, p. 3339-3342, 2003.
RONG, S., ZHAO, Y., BAO, W., XIAO, X., WANG, D., NUSSLER, A. K. et al. Curcumin
prevents chronic alcohol-induced liver disease involving decreasing ROS generation and
enhancing antioxidative capacity. Phytomedicine, v. 19, p. 545-550, 2012.
ROSANOVA, M. T., BASILICO, H., VILLASBOAS, M., FINQUELIEVICH, J., MONACO,
A., PÉREZ, G. et al. Fungal infections in a pediatric burn care. Arch Argent Pediatr, v. 109,
p. 441-4, 2011.
ROY, A. V. Rapid method for determining alkaline phosphatase activity in serum with
thymolphthalein monophosphate. Clin Chem, v. 16, p. 431-6, 1970.
SADZUKA, Y., NAGAMINE, M., TOYOOKA, T., IBUKI, Y., & SONOBE, T. Beneficial
effects of curcumin on antitumor activity and adverse reactions of doxorubicin. Int J Pharm,
v. 432, p. 42-9, 2012.
SANTOS, M. R. V., SOUZA, V. H., MENEZES, I. A. C., BITENCURT, J. L., RESENDENETO, J. M., BARRETO, A. S. et al. Parâmetros bioquímicos, fisiológicos e morfológicos de
ratos (Rattus novergicus linhagem Wistar) produzidos pelo Biotério Central da Universidade
Federal de Sergipe. Scientia Plena, v. 6, p. 1-6, 2010.
SCHEFFER, J. F.; GONZÁLEZ, F. H. Enzimologia clínica em medicina veterinária. 2003.
23 f. Monografia - Universidade Federal do Rio Grande do Sul. Porto Alegre. 2003.
SEARCY, R. L., GOUGH, G. S., KOROTZER, J. L., & BERGQUIST, L. M. Evaluation of a
new technique for estimation of urea nitrogen in serum. Am J Med Technol, v. 27, p. 255-62,
1961.
76
SHARMA, S., CHOPRA, K., KULKARNI, S. K., & AGREWALA, J. N. Resveratrol and
curcumin suppress immune response through CD28/CTLA‐4 and CD80 co‐stimulatory
pathway. Clinical & Experimental Immunology, v. 147, p. 155-163, 2007.
SHIGEMI, A., MATSUMOTO, K., IKAWA, K., YAJI, K., SHIMODOZONO, Y.,
MORIKAWA, N. et al. Safety analysis of liposomal amphotericin B in adult patients:
anaemia, thrombocytopenia, nephrotoxicity, hepatotoxicity and hypokalaemia. Int J
Antimicrob Agents, v. 38, p. 417-20, 2011.
SIVAK, O., GERSHKOVICH, P., LIN, M., WASAN, E. K., ZHAO, J., OWEN, D. et al.
Tropically stable novel oral lipid formulation of amphotericin B (iCo-010): biodistribution
and toxicity in a mouse model. Lipids Health Dis, v. 10, p. 135, 2011.
SOUZA, L. C.; SALDIVA, P. H. N.; CAMPA, A. Lipid emulsion reduces subacute toxicity
of amphotericin B: a histopathological study. Experimental and Toxicologic Pathology, v. 52,
p. 169-175, 2000.
STAMM, A. M., DIASIO, R. B., DISMUKES, W. E., SHADOMY, S., CLOUD, G. A.,
BOWLES, C. A. et al. Toxicity of amphotericin B plus flucytosine in 194 patients with
cryptococcal meningitis. The American journal of medicine, v. 83, p. 236-242, 1987. ISSN
0002-9343.
THRALL, M. A. Hematologia e bioquímica clínica veterinária. Editora Roca, 4a. ed., 2007,
582p.
TOLINS, J. P.; RAIJ, L. Chronic amphotericin B nephrotoxicity in the rat: protective effect of
calcium channel blockade. Journal of the American Society of Nephrology, v. 2, p. 98-102,
1991.
TOLOSA, E. R., CJ.; BEHMER, O A.; FREITAS-NETO, A.;GATMAITAN, Z. Manual de
técnicas para histologia normal e patológica. 2a ed. São Paulo: Manole, 2003.
TUON, F. F. et al. Are there risk factors for acute renal failure in adult patients using
deoxycholate amphotericin B? Revista Iberoamericana de Micología, v. 30, p.21-24, 2012.
UD ALLEN. CANADIAN PAEDIATRIC SOCIETY, INFECTIOUS DESEASES AND
IMMUNIZATION COMMITTEE. Antifungals agents for the treatment os systemic fungal
infections ind children. Peadiatric Child Health, v. 15, p.603-610, 2010.
77
VARLAM, D. E., SIDDIQ, M. M., PARTON, L. A., & RÜSSMANN, H. Apoptosis
contributes to amphotericin B-induced nephrotoxicity. Antimicrob Agents Chemother, v. 45,
p. 679-85, 2001.
WALSH, T. J., FINBERG, R. W., ARNDT, C., HIEMENZ, J., SCHWARTZ, C.,
BODENSTEINER, D. et al. Liposomal amphotericin B for empirical therapy in patients with
persistent fever and neutropenia. New England Journal of Medicine, v. 340, p. 764-771,
1999.
WHITE, T. C.; MARR, K. A.; BOWDEN, R. A. Clinical, cellular, and molecular factors that
contribute to antifungal drug resistance. Clin Microbiol Rev, v. 11, p. 382-402, 1998.
WRIGHT, D. G., ROBICHAUD, K. J., PIZZO, P. A., & DEISSEROTH, A. B. Lethal
pulmonary reactions associated with the combined use of amphotericin B and leukocyte
transfusions. New England Journal of Medicine, v. 304, p. 1185-1189, 1981.
YALLAPU, M. M., EBELING, M. C., CHAUHAN, N., JAGGI, M., & CHAUHAN, S. C.
Interaction of curcumin nanoformulations with human plasma proteins and erythrocytes. Int J
Nanomedicine, v. 6, p. 2779-90, 2011.
YANO, T., ITOH, Y., KAWAMURA, E., MAEDA, A., EGASHIRA, N., NISHIDA, M. et
al. Amphotericin B-induced renal tubular cell injury is mediated by Na+ Influx through ionpermeable pores and subsequent activation of mitogen-activated protein kinases and elevation
of intracellular Ca2+ concentration. Antimicrob Agents Chemother, v. 53, p. 1420-1426, 2009.
YEO, E. J., RYU, J. H., CHO, Y. S., CHUN, Y. S., HUANG, L. E., KIM, M. S., & PARK, J.
W. Amphotericin B blunts erythropoietin response to hypoxia by reinforcing FIH-mediated
repression of HIF-1. Blood, v. 107, p. 916-23, 2006.
YOUSEF, M. I., OMAR, S. A., EL-GUENDI, M. I., & ABDELMEGID, L. A. Potential
protective effects of quercetin and curcumin on paracetamol-induced histological changes,
oxidative stress, impaired liver and kidney functions and haematotoxicity in rat. Food and
chemical Toxicology, v. 48, p. 3246-3261, 2010.
78
ANEXO 1.