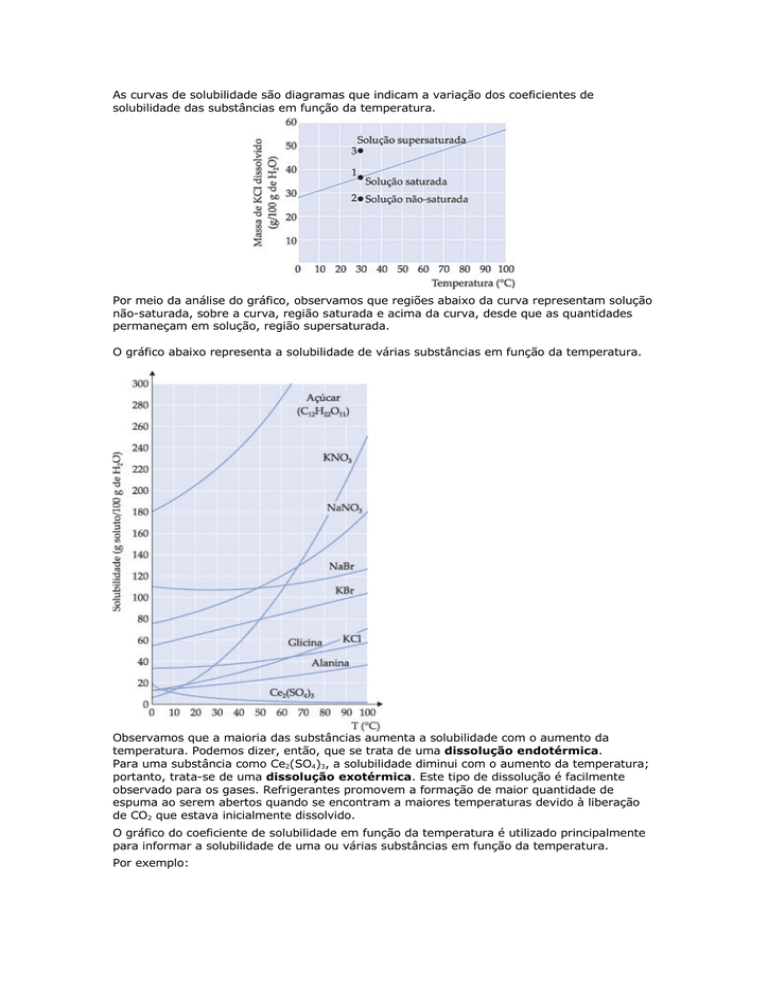
As curvas de solubilidade são diagramas que indicam a variação dos coeficientes de
solubilidade das substâncias em função da temperatura.
Por meio da análise do gráfico, observamos que regiões abaixo da curva representam solução
não-saturada, sobre a curva, região saturada e acima da curva, desde que as quantidades
permaneçam em solução, região supersaturada.
O gráfico abaixo representa a solubilidade de várias substâncias em função da temperatura.
Observamos que a maioria das substâncias aumenta a solubilidade com o aumento da
temperatura. Podemos dizer, então, que se trata de uma dissolução endotérmica.
Para uma substância como Ce2(SO4)3, a solubilidade diminui com o aumento da temperatura;
portanto, trata-se de uma dissolução exotérmica. Este tipo de dissolução é facilmente
observado para os gases. Refrigerantes promovem a formação de maior quantidade de
espuma ao serem abertos quando se encontram a maiores temperaturas devido à liberação
de CO2 que estava inicialmente dissolvido.
O gráfico do coeficiente de solubilidade em função da temperatura é utilizado principalmente
para informar a solubilidade de uma ou várias substâncias em função da temperatura.
Por exemplo:
Interpretando o gráfico:
– na temperatura de 50 °C, a quantidade máxima de KNO3 que se dissolve em 100 g de água
são 80 g. A solução em questão é saturada.
– para obtermos uma solução saturada KNO3 a 40 °C, basta dissolver 60 g de KNO3 em 100 g
de água.
– se resfriarmos uma solução saturada de 50 °C para 40 °C, teremos um corpo de fundo igual
a 20 g de KNO3.
– 200 g de água a 40 °C dissolvem no máximo 120 g de KNO3.
A mistura de duas ou mais substâncias que apresenta aspecto uniforme, isto é, mistura homogênea, é
chamada de Solução, e nela estão presentes o soluto e o solvente, essa definição se faz presente neste
contexto.
Coeficiente de solubilidade é representado pela sigla Cs, e consiste na quantidade necessária do soluto
para formar com o solvente uma solução saturada em determinadas condições de temperatura e
pressão.
Na prática seria uma quantidade máxima de uma substância que se conseguisse dissolver em
um volume fixo de solvente sob uma temperatura constante.
Dependendo da quantidade de soluto em relação à quantidade de solvente, as soluções podem ser
saturadas. A solução saturada possui uma quantidade de soluto máxima em uma determinada quantidade
de solvente, veja um exemplo, a quantidade máxima de sal (NaCl) que se dissolve em 1 litro de água a 20
°C é 360 g, então:
CsNaCl = 360 g/L (20°C)
Se uma solução possui quantidade de soluto inferior ao coeficiente de solubilidade, pode-se dizer que é
uma solução insaturada.
A fórmula usada para se calcular o Cs, com uma quantidade padrão de massa (100 g) é a seguinte:
m1 = m2 → Cs = 100 • m1
Cs 100
m2
Com base nessa fórmula fica fácil resolver a questão: uma solução aquosa saturada de acetato
de chumbo, que foi preparada com os devidos cuidados a uma temperatura de 18°C pesa 45
g. Essa mesma solução ao ser evaporada chega a um resíduo sólido de 15 g. Qual seria o
coeficiente de solubilidade (Cs) deste resíduo obtido à temperatura de 18°C?
Cs = 100 • m1
m2
Cs = 100 • 15
30
Cs = 50 g/100g
O resíduo obtido à temperatura de 18°C possui o coeficiente de solubilidade = 50 g/100g.
Veja mais:
Classificação das Soluções : Saiba como as soluções se classificam de acordo com o estado de
agregação.
Razão soluto/solvente: esta propriedade relaciona a quantidade de soluto em relação à
quantidade de solvente, e classifica as soluções em diluídas, concentradas, saturadas e supersaturadas.
Solução diluída: a quantidade de soluto é muito pequena em relação à de solvente, sendo assim, a
solução se encontra completamente diluída.
Solução concentrada: quando a quantidade de soluto é grande em relação à de solvente, ou seja, a
solução não se encontra dissolvida.
Solução saturada: neste caso, a quantidade de soluto é a máxima permitida para uma certa quantidade
de solvente, em determinada temperatura.
Solução supersaturada: este é um sistema instável, pois a quantidade de soluto é maior que a máxima
permitida.
Natureza das partículas dispersas: as soluções podem se classificar em moleculares e
iônicas em função da natureza das partículas dispersas.
Solução molecular: as partículas dispersas neste caso são moléculas.
Solução iônica: as partículas dispersas se encontram na forma de íons. Estas soluções também são
chamadas de soluções eletrolíticas, porque possuem a capacidade de conduzir corrente elétrica.
Exemplo:
Solução aquosa de cloreto de sódio (NaCl). Observe os íons formados na reação:
NaCl → Na+ + Cl
-