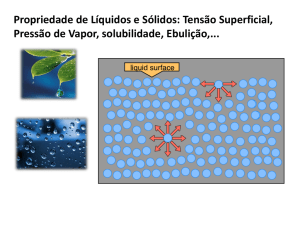
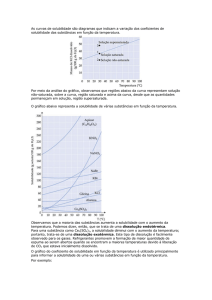
2015-­‐08-­‐29 TIPOS DE SOLUÇÕES Soluto SOLUÇÃO Mistura homogênea de duas ou mais substâncias Podem ser classificadas de acordo com a capacidade de dissolver um soluto Saturada = contém a quanIdade máxima de soluto dissolvida num determinado solvente; Insaturada = contém menos soluto do que pode dissolver; Supersaturada = contém quanIdade de soluto superior à solução saturada. Solvente Estado da solução Exemplo Gás Gás Gás Ar Gás Líquido Líquido Água gaseificada Gás Sólido Sólido H2 dissolvido em Pd Líquido Líquido Liquido ETOH dissolvido em água Sólido Líquido Liquido NaCl dissolvido em água Sólido Sólido Sólido Aço, bronze (Cu/Zn), ... Quando uma substância (o soluto) se dissolve em outra (o solvente), as parVculas do soluto dispersam-­‐se inteiramente no solvente 1 2 Curva de solubilidade TRANSIÇÕES DE FASE Região saturada Conversão de uma substância de uma fase em outra Pressão de vapor •
•
•
Fusão do gelo Vaporização da água Conversão do grafite em diamante É a pressão exercida pelo vapor que está em equilíbrio dinâmico com a fase condensada 1. Quanto maior a pressão de vapor, mais voláIl será o líquido; 2. Quanto mais forte for a força intermolecular, menor será a pressão de vapor do líquido; 3. Quanto maior a temperatura, maior a pressão de vapor do líquido Note que algumas substâncias diminuem sua solubilidade com o aumento da temperatura Qual das duas substâncias abaixo é a mais voláIl, em temperatura normal ? H3C CH2 OH
H3C O CH3
3 Éter meBlico, pois o etanol apresenta ligações de H entre suas moléculas, o que diminui a sua pressão de vapor 4 1 2015-­‐08-­‐29 Solubilidade Solubilidade de gases Lei de Henry Ebulição Acontece quando a pressão de vapor de um líquido é igual à pressão atmosférica Quando uma pequena quan,dade de NaCl é adicionada (béquer direito) todo sal é dissolvido. Ao se adicionar mais sal, parte dele não se dissolve, pois a solução já está saturada A solubilidade de um gás é diretamente proporcional à sua pressão parcial s = kH P kH = constante de Henry (depende do gás, do solvente e da T P = pressão parcial do gás A T constante, quando a pressão parcial de um gás dobra, a solubilidade também dobra Forças intermoleculares fortes levam, normalmente, a pontos de ebulição mais altos Fusão A solubilidade da maior parte dos gases é menor em temperaturas mais altas É a temperatura na qual um líquido congela a 1 atm Os pontos de congelamento dos líquidos aumenta, em geral, com a pressão. Devido às ligações de H, a água é anômala: seu ponto de congelamento diminui com a pressão 5 6 Abaixamento do ponto de Congelamento Dependem da relação entre o número de moléculas de soluto e solvente, e não da idenIdade química do soluto Abaixamento da pressão de vapor Lei de Raoult Osmose É o fluxo de solvente através de uma membrana semipermeável para uma solução mais concentrada Pressão osmóIca A pressão de vapor de um solvente é proporcional a sua fração molar numa solução P = χsolvente Ppuro É a diminuição do ponto de congelamento de um solvente provocado por um soluto P = pressão de vapor do solvente na solução Ppuro = pressão de vapor do solvente puro χsolvente = fração molar do solvente É a pressão necessária para deter o fluxo do solvente. É proporcional à concentração molar do soluto na solução π = i R T c A pressão de vapor de um solvente diminui na presença de um soluto não voláIl. Elevação do ponto de ebulição A presença de um soluto não voláIl numa solução abaixa a pressão de vapor do solvente, aumentando o ponto de ebulição 7 π = pressão osmo,ca I = fator de Van’t Hoff (determinado experimentalmente) R = constante dos gases T = Temperatura absoluta C = concentração molar 8 2