Soluções: conceito e classificação
Solução: qualquer mistura homogênea(1 fase), em qualquer estado físico.
Soluto: substância(ou íon) que está uniformemente distribuída em outra
substância, chamada solvente.
Quando as substâncias (solutos) quando estão dissolvidas em água(solvente
polar) podem ocorrer os seguintes processos:
a) Dissociação iônica: a água separa os íons do substância.
exemplo: dissolução do sal de cozinha(NaCl ) em água.
Essa solução é denominada eletrolítica( condutora de elétrons).
b) Dissociação molecular: a água separa as moléculas que formam as
substâncias moleculares.
Essa solução é não
eletrolítica, ou seja, não
condutora de eletricidade
c) Ionização: ocorre em algumas substâncias moleculares. Em água, as
moléculas transformam-se em íons.
Essa solução será eletrolítica
As soluções podem se apresentar em três estados físicos: sólido , líquido e
gasoso. O estado de agregação do solvente determina o estado físico da
solução.
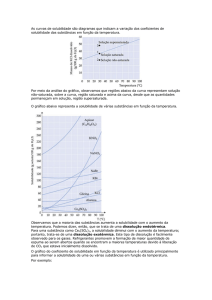
Solução insaturada: é a solução que contém menor quantidade
de soluto em relação à solução saturada.
Solução supersaturada: é a solução que contém maior
quantidade de soluto dissolvido em relação à solução saturada.
A solução supersaturada é instável e pode passar facilmente
para o estado saturado, com eliminação do excesso dissolvido.
Exemplo: uma solução supersaturada de KNO3 será instável na
presença desse sal sólido. A adição de grãos de sólido(gérmen
de cristalização) a uma solução supersaturada fará com que
ocorra a precipitação (cristalização) do soluto que estiver em
excesso em relação à solução saturada.
SOLUÇÕES SATURADAS, INSATURADAS e SUPERSATURADAS
Coeficiente de solubilidade: é a quantidade máxima, em gramas, de soluto
que se dissolve completamente em uma quantidade fixa de solvente (100 g
100 mL, 1L), em determinadas condições de temperatura e pressão.
Solução saturada: é a solução que contém o máximo de soluto dissolvido
em uma quantidade de solvente, a dada temperatura. Exemplo: 36 g de
NaCl dissolvidos em 100 g de água, a 25°C. Qualquer massa adicional de
soluto a essa solução irá se depositar no fundo do recipiente e constituirá o
corpo de chão ou corpo de fundo ou precipitado. Portanto o coeficiente de
solubilidade do NaCl será :
36 g / 100 g de água a 25°C
Em uma mesma temperatura,cada soluto, possuirá um valor característico
de solubilidade, como se observa nos exemplos da tabela a seguir.
Curvas de solubilidade
A solubilidade das substâncias depende da temperatura. No caso de solutos
sólidos, na maioria dos casos a solubilidade aumenta com o aquecimento do
sistema.
Exemplo:
Nos casos em que a solubilidade
aumenta com a temperatura, o
processo de dissolução é
endotérmica: curva ascendente
Nos casos em que a solubilidade
diminui com a temperatura, o
processo de dissolução é
exotérmico: curva descendente