SOLUÇÃO
“Solução é uma mistura homogênea
constituída por duas ou mais substâncias
numa só fase.”
O uso de medicamentos na forma de líquidos
por via oral tem sido justificado com base na
facilidade de administração as doentes que tem
dificuldade em deglutir as formas farmacêuticas
sólidas. O argumento melhor pode ser usado
considerando-se o uso de sistemas homogêneos
(sistema em que o fármaco, ou fármacos se
encontram em solução). Com raras exceções o
fármaco tem que estar em solução de modo a ser
absorvido. Um fármaco administrado em solução
está disponível imediatamente para absorção e, na
maioria dos casos, é absorvida mais rápida e
eficientemente do que a mesma quantidade de
fármaco administrado num comprimido ou cápsula.
Solução é o nome dado a dispersões onde o disperso recebe o
nome de soluto e o dispersante o nome de solvente.
Existem 3 tipos de dispersões.
A classificação é feita conforme o tamanho médio de partículas
dispersas:
• Solução Verdadeira: entre 0 e 1nm, as partículas dispersas não
são visíveis (mistura homogênea). Ex: água mineral e ar
atmosférico filtrado.
• Solução Coloidal: entre 1 e 100nm, as partículas dispersas são
visíveis através de ultramicroscópios (mistura heterogênea). Ex:
neblina, gelatina.
• Suspensões: acima de 100nm, as partículas dispersas são
visíveis através de microscópios ou até mesmo a olho nu. Exemplo:
Terra + água.
Solubilidade
Quer uma substancia se dissolva, ou
não, num dado sistema e, a extensão com
que se dissolve depende largamente da
natureza e intensidade das forças
presentes no soluto, do solvente e da
interação resultante soluto-solvente.
Há três fases na formação de uma
solução:
• Separação das moléculas do
soluto
• Separação das moléculas do
solvente
• Formação das interações
soluto-solvente
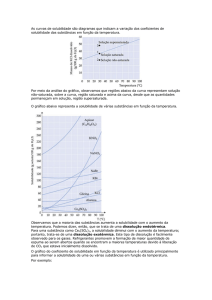
Curvas de solubilidade
Normalmente a solubilidade de uma substância varia com a
temperatura. O gráfico que representa a solubilidade de uma substância
em função da temperatura, é denominado de curva de solubilidade.
Existem três tipos de curvas :
• Curvas Ascendentes: representam as substâncias cujo coeficiente de
solubilidade aumenta com a temperatura. São substâncias que se
dissolvem com a absorção de calor, isto é, a dissolução é endotérmica.
• Curvas Descendentes: representam as substâncias cujo coeficiente de
solubilidade diminui com o aumento de temperatura. São substâncias que
se dissolvem com liberação de calor, isto é, a dissolução é exotérmica.
•
Curvas com Inflexões: representam as substâncias que sofrem
modificações em sua estrutura com a variação da temperatura. O sulfato de
sódio, por exemplo, até a temperatura de 32,4ºC, apresenta em sua
estrutura dez moléculas de água, em temperatura acima de 32,4ºC o
sulfato de sódio perde suas moléculas de "água de cristalização" e a curva
de solubilidade sofre uma inflexão.
Estado Físico da Solução
LÍQUIDOS
Nessas soluções, pelo menos
um dos componentes está no
estado líquido, as partículas se
encontram dispostas próximas
umas das outras, caracterizando o
estado líquido. Quando se diz que
uma solução é aquosa, é porque o
componente que se encontra em
maior quantidade é a água.
Exemplo - Solução aquosa de
álcool, onde o soluto é o álcool, e a
água é o solvente.
Líquido de limpeza Uvex-Clear
(CTAT Clear). Contem uma
solução aquosa com Álcool
Isopropílico em até 6%. Galão de 5
litros.
SÓLIDOS
Os componentes dessas
soluções estão no estado sólido à
temperatura ambiente, essas
soluções são também chamadas de
ligas.
Exemplos - Liga de cobre (Cu) e
níquel (Ni), o soluto é o níquel e o
solvente é o cobre. A liga de cobre e
estanho (Sn) é conhecida como
bronze, e dá origem a vários objetos.
IODO
GASOSO
Todos os componentes se
encontram no estado gasoso, elas
têm a estrutura típica dos gases,
mas com uma diferença, as
moléculas na solução não são
todas iguais.
Exemplo - o ar que respiramos é
uma solução gasosa formada
basicamente pelos gases
nitrogênio (N2) e gás oxigênio
(O2).
Cloro - gás amarelo esverdeado
Proporção entre soluto e solvente
• Solução Insaturada - (ou não saturada) - É quando a quantidade de
soluto usado não atinge o limite de solubilidade, ou seja, a quantidade
adicionada é inferior ao coeficiente de solubilidade.
• Solução Saturada - É quando o solvente (ou dispersante) já dissolveu
toda a quantidade possível de soluto (ou disperso), e toda a quantidade
agora adicionada não será dissolvida e ficará no fundo do recipiente.
• Solução Supersaturada - Isto só acontece quando o solvente e
soluto estão em uma temperatura em que seu coeficiente de solubilidade
(solvente) é maior, e depois a solução é resfriada ou aquecida, de modo
a reduzir o coeficiente de solubilidade. Quando isso é feito de modo
cuidadoso, o soluto permanece dissolvido, mas a solução se torna
extremamente instável. Qualquer vibração faz precipitar a quantidade de
soluto em excesso dissolvida.
• Soluções diluídas - São soluções que apresentam pequena
quantidade de soluto em relação à quantidade de solvente. São,
geralmente, consideradas como soluções diluídas aquelas que
apresentam menos de 0,1 mol de soluto por litro de solução.
• Soluções concentradas - São soluções que apresentam grande
quantidade de soluto em relação à quantidade de solvente. As
soluções concentradas apresentam, porém, menor quantidade de
soluto que a solução saturada.
• Soluções Aquosas - As soluções aquosas administradas por via
intramuscular devem apresentar uma tonicidade próxima da do soro
sanguíneo. Soluções hipertônicas são mais rapidamente
absorvidas, considerações em conta a tolerância local dos tecidos,
com eventual aparecimento de dor.
• Soluções Oleosas - Normalmente, exige-se que o óleo utilizado
apresente uma acidez inferior a 0,1%, expressa em ácido oléico. A
viscosidade do óleo utilizado é uma característica que interessa
precisar, podendo dizer-se que a tolerância local e a velocidade de
absorção do fármaco são favorecidas pela fluidez da preparação.
• Alcoóleos Açucarados (Elixires) – Trata-se de soluções alcoólicas
de princípios medicamentosos edulcoradas com açucares.
Alcoóleos - Chamaremos alcoóleos às preparações farmacêuticas
líquidas, cujo veículo, único e principal, é o álcool etílico de diversas
graduações.
• Soluções Simples – Dissolução total do fármaco.
• Tinturas
São Obtidas por dissolução extrativa, respectivamente
• Alcoolaturas.
das drogas secas ou recentes.
Soluções alcoólicas mais correntemente utilizada
•
•
•
•
•
•
•
•
Solução Alcoólica de Amônia – Usa-se como diaforética e expectorante.
Solução Alcoólica de Cânfora – Emprega-se, diretamente, em fricções.
Solução Alcoólica de Iodo – Anti-sépticos
Solução Alcoólica de Isossulfocianato de Alilo – Substitui a essência de
mostarda
Solução Alcoólica de Nitroglicerina – Altamente explosivo
Solução Alcoólica de Sulfato Básico de Quinina – Tônico, febrífugo e
antipalúdico
Solução Alcoólica de Veratrina – Inseticidas
Solução Alcoólica de Mentol – Antipruriginosa e refrescante
Condutividade Elétrica
A saturação é uma propriedade das soluções
que indica a capacidade das mesmas em
suportar quantidades crescentes de solutos,
mantendo-se homogêneas.
Bibliográfia
•
LACHMAN, L. Teoria e prática na indústria farmacêutica. Lisboa:
Fundação Calouste Gulbenkian, 2001.
•
PRISTA L.N. et al. Técnica Farmacêutica e Farmácia Galênica. 4 ed
Lisboa Fundação Calouste Gulbenkian., 1985. 9986p v.1,v2,v3.
•
FONSECA, Martha Reis Marques da Química Integral, 2º grau: volume
único/Martha Reis. – São Paulo: FTD, 1993.
•
ECHEVERRÍA, A. Concepção sobre fomação de soluções. Química nova
na escola, n. 3, maio 1996.
•
WIKIPÉDIA. Enciclopédia Livre. Dísponivel em:
<pt.wikipedia.org/wiki/Solução>.
Acesso em: 10 set. 2009.
•
PORTAL São Francisco. Soluções Quimicas. Dísponivel em:
<www.colegiosaofrancisco.com.br/.../solucoes/solucoes.php> Acesso
em: 10 set. 2009.
TRABALHO REALIZADO POR:
•
•
•
•
•
•
•
Alayana Cassia O. Corrêa
Beatriz Ramos dos Santos
Claudio Lima
Mayra Schwarzwalder Fabre
Paulo Cezar da Silva
Sandra Freire
Thais Ferreira
RA - 554285-5
RA - 582414-1
RA - 582240-8
RA - 391080-6
RA - 554755-5
RA RA –