Módulo Q2 - Soluções
SOLUÇÕES
Soluções – o que são?
Uma grande parte dos materiais que nos rodeiam – desde a água do mar ao ar que respiramos –
são soluções.
Uma solução é uma mistura homogénea de duas ou mais substâncias que constituem uma
só fase. As soluções podem apresentar-se nos três estados físicos: sólido, líquido ou
gasoso.
O ar que respiramos (diazoto
+ dioxigénio + …) é uma
solução no estado gasoso.
A água do mar (água +
cloreto de sódio + …) é uma
solução no estado líquido.
O latão (cobre + zinco) é
uma solução no estado
sólido.
As soluções e os seus estados físicos
Uma solução é uma mistura homogénea constituída por um solvente, que é a fase dispersante,
e por um ou mais solutos, que são a fase dispersa.
As soluções cujo solvente é a água designam-se soluções aquosas.
Açúcar
(soluto)
Água
açucarada
(solução)
Água
(solvente)
Critérios para escolha do solvente e do(s) soluto(s)
1º critério O solvente é a substância que apresenta o mesmo estado físico da solução.
2º critério Quando o solvente e soluto(s) se encontram no mesmo estado físico, o solvente
será a substância que se encontra em maior quantidade química (expressa em
mol).
3º critério Quando nenhum dos critérios anteriores serve para identificar o soluto e o
solvente, seleciona-se o solvente aquele que for mais volátil.
Dissolução de sais
Sempre que falamos em soluções são, também, abordados os conceitos dissolução e
solubilidade.
•O que é uma dissolução? Como acontece?
•E a solubilidade é uma propriedade ou uma medida?
Numa dissolução há interação entre o soluto e o solvente e é sempre acompanhada por um
aumento da desordem, que dá origem a uma solução.
Exemplo: dissolução de um sal em água.
Estrutura cristalina do
cloreto de sódio
O cloreto de sódio é um sal em
que iões positivos e negativos
se encontram unidos por
ligações iónicas e arranjados
numa estrutura cristalina. A
dissolução deste sal em água
consiste na separação dos iões
sódio e cloreto e na destruição
da malha tridimensional por
interação desses iões com as
Interação entre as moléculas moléculas polares de água.
de água e os iões do sal.
Dissolução de sais
Só é possível obter uma solução se as moléculas
de soluto ficarem completamente rodeadas e
ligas às moléculas de solvente. Numa dissolução
ocorre a separação das partículas de soluto e
solvente, simultaneamente com a interação e
mistura das partículas de soluto com as
partículas do solvente formando-se a solução.
Solução. Cada ião fica rodeado
de moléculas de água.
Solubilidade de um soluto
A solubilidade exprime a maior ou menor capacidade que as substâncias têm de se dissolverem
num dado solvente, a uma determinada temperatura.
Quantidade máxima de soluto que é possível dissolver num dado solvente, a uma determinada
temperatura. Pode representar-se pela letra s.
No caso de soluções líquidas, a solubilidade pode exprimir-se em:
Quantidade de soluto (mol) por volume de solução (dm3) – mol/dm3 ou mol/L.
Massa (g) de soluto por volume de solução (dm3) – g/dm3 ou g/L.
Massa (g) de soluto por 100 g de água.
Soluções não saturadas (insaturada), saturadas e sobressaturadas
Há substâncias que se dissolvem umas nas outras em quaisquer proporções.
Exemplos: água e vinagre; água e álcool.
Para outras, a uma dada temperatura, há uma quantidade limite de soluto que é possível
dissolver num dado volume de solvente.
A proporção entre as quantidades relativas de soluto e de solvente poderá conduzir a três tipos
de soluções.
Solução insaturada – A proporção entre as quantidades é inferior ao valor da
solubilidade e ainda é possível dissolver mais soluto na mesma quantidade de
solvente, à mesma temperatura.
Solução saturada – A proporção entre as quantidades é igual ao valor da solubilidade,
uma vez que quando se adiciona um pouco mais de soluto este não se dissolve,
mesmo após agitação.
Solução sobressaturada – A proporção entre as quantidades é superior ao valor da
solubilidade e a solução é instável.
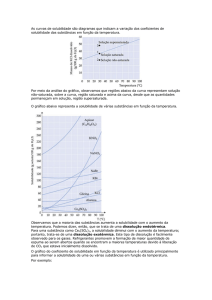
A solubilidade e a temperatura
A solubilidade de um composto depende da interação do soluto com o solvente. Assim,
substâncias polares dissolvem substâncias polares e substâncias apolares dissolvem substâncias
apolares.
A temperatura influencia a solubilidade dos sais.
Conforme
o
caráter
exotérmico
ou
endotérmico do processo de dissolução de um
sal, uma alteração da temperatura terá
diferentes efeitos.
A maioria dos sais aumenta a sua solubilidade
com o aumento da temperatura uma vez que
os respetivos processos de dissolução são
fenómenos endotérmicos. Contudo, há casos,
como o do sulfato de sódio, cujos processos de
dissolução são exotérmicos. Para estes sais,
com um aumento da temperatura, a sua
solubilidade diminui.
A solubilidade e a temperatura
A dissolução de nitrato de potássio (KNO3) em água
é um processo endotérmico.
KNO3 s
H2O (l)
K aq NO3 aq
Em processos desta natureza, o aumento da
temperatura favorece a dissolução do sal.
A dissolução de sulfato de sódio (Na2SO4) em água é
um processo exotérmico.
Na 2SO 4 s
H2O (l)
2 Na aq SO 24 aq
Em processos desta natureza, o aumento da
temperatura diminui a solubilidade do sal.