SOLUÇÕES
XAROPE
ELIXIR
Profa. Dra. Patricia da Fonseca Leite
SOLUÇÃO - DEFINIÇÕES:
- Mistura de dois ou mais componentes que formam uma
única fase, que é homogênea.
- Constitui um sistema disperso, entretanto o tipo de
interação é molecular.
- Impossível separar o disperso do dispersante por
processos físicos.
- Em farmácia, uma solução é uma forma farmacêutica
líquida, caracterizada pela formação de um sistema onde
todas as substâncias sólidas presentes na formulação
devem estar totalmente dissolvidas em um veículo
adequado. Portanto a solução deve ser líquida e
transparente.
Quando dissolvemos o sal na água, as características
elétricas da molécula de H2O interferem com a atração
eletrostática dos íons do sal, que se enfraquecem e se
dispersam pelo líquido de novo na condição de íons
livres.
USOS DAS SOLUÇÕES:
-INTERNO: ORAL E INJETÁVEIS.
-EXTERNO: TÓPICO (PELE E MUCOSAS).
VANTAGENS:
>
FACILIDADE
DE
INGESTÃO:
PACIENTES
PEDIÁTRICOS,
GERIÁTRICOS,
PROBLEMAS
DE
DEGLUTIÇÃO;
MELHOR
ABSORÇÃO
(BIODISPONIBILIDADE):
FÁRMACO JÁ DISSOLVIDO;
É
UM
SISTEMA
HOMOGÊNEO:
FÁRMACO
UNIFORMEMENTE DISTRIBUÍDO – UNIFORMIDADE DOSE;
- MENOR IRRITABILIDADE NO TGI.
DESVANTAGENS
-TRANSPORTE
PESADOS;
E
ARMAZENAGEM:
VOLUMOSOS,
-QUEBRA DA EMBALAGEM: PERDA IRREVERSÍVEL;
-ESTABILIDADE (HIDRÓLISE): USO DE ADJUVANTES
(ANTIHIDROLÍTICOS);
-FACILIDADE
DE
CONSERVANTES;
-DIFICULDADE
EM
DESAGRADÁVEIS;
CONTAMINAÇÃO:
MASCARAR
- MEDIDA CORRETA DA
HABILIDADE DO PACIENTE.
DOSE:
USO
DE
SABOR/ODOR
DEPENDE
DA
TIPOS DE SOLUÇÕES:
Uso oral
- xaropes
- elixires
- soluções extemporâneas
-soluções para rehidratação
Uso interno
-soluções injetáveis
Uso externo (tópico)
Destinam-se para aplicação
na pele e mucosas:
- oral: colutórios ou
bochechos, gargarejos
- nasal: soluções nasais
(gotas)
- ocular (preparações
oftálmicas): colírios
- auricular: soluções
auriculares (gotas otológicas)
- retal: enemas
- vaginal: soluções antisépticas
-pele: loções, soluções antisépticas,
Outras soluções
- soluções extrativas
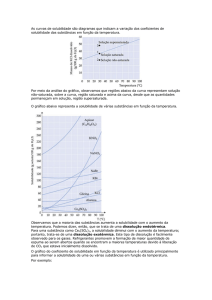
SOLUBILIDADE
A solubilidade de uma determinada substância em um
determinado solvente corresponde à concentração
máxima na qual uma solução com aquela substância e
aquele solvente pode ser preparada.
Dependendo da quantidade de soluto:
- solução: soluto totalmente dissolvido;
- solução saturada: solvente dissolveu o máximo de
soluto;
- solução supersaturada: apresenta corpo de fundo, um
excesso de soluto não dissolvido.
FORMAS DE EXPRESSAR A CONCENTRAÇÃO
Quantidade por quantidade
Peso ou volume de soluto que está contido em um dado
peso ou volume do solvente. Ex. g/mL, g/100mL, mg/mL,
mg/10mL, g/L, mg/mL etc.
Percentual por volume
% p/v = gramas do soluto em 100 mL de solução final.
Pode ser também: % v/v, % p/p
Solubilidade relativa
Expressões descritivas da solubilidade relativa
Expressão descritiva
Muito solúvel
Livremente solúvel
Solúvel
Moderadamente solúvel
Ligeiramente solúvel
Pouco solúvel
Praticamente insolúvel ou
insolúvel
Partes do solvente
necessárias para dissolver
uma parte do soluto
menos de 1
de 1 a 10
de 11 a 30
de 31 a 100
de 101 a 1.000
de 1.001 a 10.000
mais de 10.000
FORMULAÇÕES DAS SOLUÇÕES
SOLUÇÕES AQUOSAS
A água constitui o solvente mais utilizado como veículo
para medicamentos devido à sua atoxicidade,
compatibilidade fisiológica e a capacidade para dissolver
várias substâncias.
Tipos de água
Água potável: adequada para ingestão.
Água purificada: destilada e/ou deionizada – eliminação
de material orgânico e íons contaminantes.
Água para injetáveis: parenterais, oftálmicos e inalantes.
MÉTODOS PARA MELHORAR A SOLUBILIDADE
1.Utilização de co-solvente (eletrólitos fracos ou moléculas
pouco polares):
- solventes hidrossolúveis em associação com a água.
- limitação da escolha do solvente: toxicidade, irritabilidade.
- utilização de misturas de solventes com polaridades ou
constante dielétrica semelhantes ao soluto (“semelhante
dissolve semelhante”).
- Misturas mais utilizadas:
Etanol:H2O.
Sorbitol 70%:H2O.
Glicerina, propilenoglicol.
2. Controle do pH
- Fármaco ácido ou básico - influência do pH do meio.
- Solubilidade de uma base ou ácidos fracos - podem ser
aumentados por diminuição ou aumento do pH da solução.
- Importância do pka do fármaco.
-Controle por pH deve ser criterioso – assegurar a viabilidade
da preparação.
- Utilização de sistema tampão.
ATENÇÃO:
- estabilidade química
- biodisponibilidade
3. Uso de tensoativos
- Atóxicos e não irritantes – escolhidos de acordo com a via de
administração.
- Miscível no sistema solvente e compatível com os outros
componentes da formulação.
-Livre de odor e sabor desagradáveis e não ser volátil.
- Importância da quantidade de tensoativo:
Excesso – aumento da toxicidade, alterações durante a
produção e diminuição da biodisponibilidade.
Quantidade pequena – pode não solubilizar o fármaco.
4. Complexação
É essencial que o complexo seja facilmente reversível para que
o fármaco livre seja liberado durante e após o contato com os
fluidos biológicos.
5. Controle do tamanho de partícula
Menor tamanho
maior solubilidade.
- Método tem menor importância no preparo de soluções, mas
é particularmente relevante para suspensões.
SOLUÇÕES NÃO AQUOSAS
Solventes alternativos
São empregados quando não é possível assegurar a
dissolução completa dos componentes da solução em sistema
aquoso.
Vantagens do uso de solventes não aquosos:
- Sistemas de liberação prolongada IM – injeções oleosas
- A solução oleosa permanece no tecido muscular, liberando
lentamente o fármaco nos tecidos vizinhos.
- Limitações destes solventes seguem a seguinte ordem:
Parenteral > uso interno > uso externo
PRINCIPAIS ADJUVANTES DE UMA FORMULAÇÃO - SOLUÇÃO
- Objetivo do uso de adjuvantes em soluções
- tornar a solução mais compatível com o meio fisiológico que
será aplicada
- promover a dissolução em água de um fármaco que é muito
pouco solúvel ou insolúvel neste solvente
- retardar ou impedir hidrólise ou oxidação
- evitar o desenvolvimento de microorganismos
- melhorar as características organolépticas, quando
necessário, para melhorar a aceitabilidade do medicamento
pelo paciente
PRINCIPAIS ADJUVANTES DE UMA FORMULAÇÃO – SOLUÇÃO
Sistemas tamponantes (pH final deve proporcionar máxima estabilidade,
solubilidade e biodisponibilidade do fármaco).
Agentes modificadores de densidade - substâncias que aumentam o
tempo de permanência da solução aquosa de uso tópico (pele ou olhos).
Aumentam a viscosidade de soluções. Ex: Povidona, carbômeros.
Conservantes (antimicrobianos):
- não ser incompatível com o pH da preparação e demais
componentes
- devem ser adequados para a via de administração em questão.
Agentes antioxidantes:
Veículos aquosos: - pH ácido: metabissulfito,
- pH neutro: bissulfito,
- pH básico: sulfitos,
Veículos oleosos: - BHT, tocoferol, - quelantes: EDTA.
Edulcorantes (correção de sabor)
Aromatizantes e essências
- usados em conjunto com edulcorantes.
- muito usados em formulações pediátricas.
- auxiliam na identificação do produto.
Corantes
- usados principalmente para soluções de uso oral e uso
externo.
- normalmente associado a um aroma.
- facilitam a identificação.
*Verificar se o corante é aprovado para uso farmacêutico, cosmético ou
alimentar.
PREPARO GERAL DE UMA SOLUÇAÕ
1) Calcule a quantidade de P.A (soluto)
2) Pese ou meça o P.A.
3) Escolha o melhor solvente ou conjunto de solventes para
solubilizar o P.A verificando se não há nenhuma
incompatibilidade fármaco / solvente.
4) Verifique a necessidade de adjuvantes farmacotécnicos.
5) Defina a ordem de adição de cada componente da fórmula.
6) Escolha a técnica e operação farmacêutica mais adequada ao
preparo (dispersão, solubilização, aquecimento, agitação
mecânica, etc)
7) Filtre a solução (observar se houve retenção de soluto no
filtro).
8) Verifique e corrija o pH, se necessário.
9) Embale adequadamente e identifique a solução preparada.
XAROPE
Os xaropes são preparações aquosas concentradas de um
açúcar ou de outra substância que o substitua, com ou
sem acréscimo de flavorizantes e PA.
Componentes:
- açúcar
- H2O
- conservante
- flavorizante
- corante
Alta concentração de açúcar
- sacarose ou substituto doce e viscoso;
- mascarar sabor desagradável;
- diminuir constante dielétrica da H2O;
- resistência ao crescimento bacteriano ([ ] açúcar próxima
à saturação);
- estabilidade.
Vantagens:
- veículo edulcorado.
- hipertônico: evita o desenvolvimento de microrganismos.
- viscoso: apropriado para deglutição.
- solubiliza vários fármacos.
- atrativo para pediatria.
Métodos de preparação:
- dissolução a quente.
- dissolução a frio (sob agitação).
-adição de açúcar a uma solução medicamentosa ou
aromatizada.
- percolação
1. Obtenção por dissolução a quente
A inversão do açúcar provoca a quebra da sacarose em dois açúcares que
formam a sua molécula: GLICOSE e FRUTOSE. A fórmula da reação química é a
seguinte:
C12H22O11 (sacarose) + H2O (água) = C6H12O6 (glicose) + C6H12O6 (frutose).
2. Obtenção por dissolução a frio
- evita hidrólise da sacarose
- xarope é obtido sob agitação vigorosa
- processo mais demorado, mas o produto é mais estável
- obtenção de xaropes incolores
3. Adição de açúcar a uma determinada solução medicamentosa
- a adição de açúcar a uma solução medicamentosa ou
aromatizada.
- obtenção de tinturas e extratos fluidos medicinais: tornam-se
xaropes após adição de açúcar.
4. Percolação
- a sacarose é percolada com água para se preparar o xarope.
Xaropes isentos de sacarose:
- sacarose pode ser total ou parcialmente substituída por
dextrose, sorbitol, glicerina e propilenoglicol.
- para diabéticos são utilizadas substâncias não glicogênicas,
como a metilcelulose e a hidroxietilcelulose.
- viscosidade resultante é semelhante a do xarope simples.
- xarope é obtido sob agitação vigorosa.
- a adição de edulcorantes artificiais complementa a
mimetização do xarope.
EMBALAGEM PARA XAROPES
- vidro âmbar.
- tampa de rosca e batoque.
- preencher quase todo o volume, para evitar a cristalização do
açúcar na superfície.
- usar tampas, colheres ou pipetas dosadoras.
Demonstração de cálculos para preparação de xarope simples.
85g de sacarose em 100mL de água pura.
Se a densidade é de 1,313 g/mL, ou seja, 131,1g – 100mL.
Temos: 131,1g – 85g = 46,3g ou mL de água.
Solubilidade da sacarose é de 1g em 0,5 mL água.
85g de sacarose se dissolvem em 42,5mL de água.
Excesso de água nesta preparação é muito pequeno – BAIXA
CONTAMINAÇÃO MICROB. – Sol. Hipertônica.
Elixires
-
Soluções
hidroalcoólicas
medicamentosas
edulcoradas com açúcares, sacarina ou glicóis.
Apresentam-se claros, adocicados e flavorizados.
☺ adequados para fármacos insolúveis em água, mas solúveis
em misturas hidroalcoólicas.
☺ Feito por dissolução simples.
☺ Normalmente não necessitam da adição de conservantes.
☹ menos doce e menos viscoso que os xaropes.
☹ menos efetivo no mascaramento do sabor.
☹ alta graduação alcoólica – 15-50%.