Difusão, Osmose e Tonicidade.
A difusão é um movimento de componentes de uma mistura
qualquer que obedece a 2a. Lei da TD que diz:
“De onde tem mais, vai para onde tem menos”.
Esses movimentos são mais rápidos em meios gasosos, mais lentos
em meios líquidos e muito lentos em meios sólidos.
A difusão depende de propriedades das partículas como:
número: quanto maior o número de partículas (concentração),
mais rápida é a difusão.
tamanho: partículas menores se difundem mais rapidamente
forma: cilindros se difundem mais rapidamente que esferas.
Outros fatores:
Temperatura: aumenta a difusão por maior energia cinética nas
moléculas.
Tempo: a distância atingida pelas moléculas em difusão é
proporcional ao inverso do quadrado do tempo.
1 nm 1ms
2 nm 4ms
3 nm 9ms
4 nm 16 ms
Osmose
Considera-se apenas o número (concentração) de partículas:
As partículas de soluto e solvente estão sempre se chocando contras
as paredes de um vaso sangüíneo. Esses choques são Força exercida
sobre uma Área, chamados de Pressão.
A pressão de solventes puros é sempre máxima, pois são as únicas
partículas do sistema. Quando se acrescenta soluto, a pressão do
solvente diminui sobre a parede do vaso diminui, porque parte do
espaço é ocupada pelo soluto e a área de pressão do solvente
aumenta.
Assim, quanto maior a concentração do soluto, menor é a pressão do
solvente e maior a do soluto.
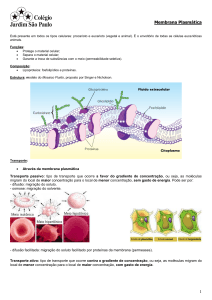
Quando isso ocorre através de uma membrana permeável, as
moléculas se movimentam de um lado para o outro da membrana,
visando o equilíbrio de pressões.
Osmose através de membranas
a) todos os componentes são difusíveis: ocorre troca geral de
todos os componentes.
b) componentes não difusíveis: macromoléculas que não passam
pela membrana. Passa apenas o solvente para o outro lado da
membrana, até que o equilíbrio de pressão hidrostática e
osmótica seja atingido.
Pressão oncótica ou coloidosmótica: “capacidade de a proteína
abaixar a pressão do solvente no lado em que está”.
Há troca de substâncias entre os compartimentos celular e
extracelular baseadas neste equilíbrio.
Tonicidade das Soluções e Plasmólise:
As células em diferentes soluções podem:
permanecer do mesmo tamanho
inchar
Diminuir de tamanho (crenar).
Isto depende diretamente da:
a) Concentração de solução externa à célula;
b) Permeabilidade da membrana celular (quais substâncias que
penetram diretamente pela membrana).
Exemplo: hemácia mamífero tem concentração interna de 0,3 osm.
Solução isotônica: quando a célula não varia seu volume;
Solução hipertônica: quando a célula encolhe.
Solução hipotônica: quando a célula incha.
Exemplos: Soluções para injeção endovenosa (têm um limite e
mínimo e máximo de osmolaridade).
Difusão e Osmose em Biologia
Exemplo 1:
Difusão de íons pela membrana celular.
Difusão de oxigênio para os tecidos cerebrais
Difusão de gases nos alvéolos pulmonares
Difusão de anestésicos locais (com ou sem vasoconstritores) em
mucosas e a sua remoção pelos vasos.
Difusão de medicamentos pela barreira hematoencefálica.
Difusão em técnicas de laboratório (imunodifusão de antígeno com
anticorpo em meio semi-sólido - gel).