Universidade Federal do Amazonas
Faculdade de Ciências Agrárias
Programa de Pós-Graduação em Agronomia Tropical
INDUTORES DE RESISTÊNCIA EM PEPINEIRO (Cucumis
sativus L.) CONTRA A MANCHA DE CORINÉSPORA
[Corynespora cassiicola (Berk. e Curt.) Wei]
ELISÂNGELA DE JESUS DA SILVA BEZERRA
MANAUS
2009
Universidade Federal do Amazonas
Faculdade de Ciências Agrárias
Programa de Pós-Graduação em Agronomia Tropical
ELISÂNGELA DE JESUS DA SILVA BEZERRA
INDUTORES DE RESISTÊNCIA EM PEPINEIRO (Cucumis
sativus L.) CONTRA A MANCHA DE CORINÉSPORA
[Corynespora cassiicola (Berk. e Curt.) Wei]
Dissertação apresentada ao Programa de PósGraduação
Universidade
em
Agronomia
Federal
do
Tropical
Amazonas,
da
como
requisito parcial para obtenção do título de Mestre
em Agronomia Tropical.
Orientadora: Jânia Lília da Silva Bentes Dra.
MANAUS
2009
Ficha Catalográfica
(Catalogação realizada pela Biblioteca Central da UFAM)
Bezerra, Elisângela de Jesus da Silva
B574e
Indutores de resistência em pepineiro (Cucumis sativus L.)
contra a mancha de corinéspora [Corynespora cassiicola (Berk.
e Curt.) Wei] / Elisângela de Jesus da Silva Bezerra. – Manaus:
UFAM, 2009.
89 f.; il. color.
Dissertação (Mestrado em Agronomia Tropical)
Universidade Federal do Amazonas, 2009.
Orientadora: Profª. Dra. Jânia Lília da Silva Bentes
––
1. Pepino - Cultivo 2. Defensivos vegetais 3. Plantas – Doenças e
pragas I. Bentes, Jânia Lília da Silva II. Universidade Federal do
Amazonas III. Título
CDU 635.63(043.3)
i
ii
Ao meu pai (João Bezerra), minha
mãe (Terezinha Bezerra) e irmãos
pelo incentivo para realização
deste trabalho.
iii
AGRADECIMENTOS
À Deus por sempre guiar-me por meus caminhos e por ter sido fonte inesgotável de auxílio em
todos aqueles momentos que, à primeira vista, pareciam intransponíveis;
Aos membros de minha família pelo incentivo e por ter compreendido a importância e as
dificuldades do desenvolvimento desse trabalho;
Aos órgãos Fundação de Amparo a Pesquisa (FAPEAM) e (PROCAD) pelo apóio financeiro;
À Instituição Universidade Federal do Amazonas (UFAM) pela infra-estrutura para o
desenvolvimento do projeto de pesquisa;
A minha orientadora, Professora Dra. Jânia Lília da Silva Bentes, por ter compartilhado comigo
muito do seu conhecimento, e pelas orientações que, sem as quais, esta dissertação jamais teria se
concretizado;
Ao professor Dr. José Ferreira da Silva que contribuiu na utilização do programa estatístico;
Ao Alessandro Machado da Silva pela amizade e valiosos momentos durante a maioria das etapas
deste trabalho;
Ao meu irmão João de Sousa Bezerra Filho pela presença e apoio nos finais de semana e feriados
para a realização deste trabalho.
A Liane Cristine Rebouças Demosthenes pelos momentos de apoio;
Aos amigos da graduação e mestrado que me apoiaram e estiveram presentes em momentos
difíceis;
E a todos que contribuíram para a realização deste trabalho e que, embora não citados aqui, não
deixam de merecer meu profundo agradecimento.
AGRADEÇO
iv
RESUMO
INDUTORES DE RESISTÊNCIA EM PEPINEIRO (Cucumis sativus L.) CONTRA A
MANCHA DE CORINÉSPORA [Corynespora cassiicola (Berk. e Curt.) Wei]
A busca por métodos alternativos para o controle de doenças de plantas tem sido alvo de diversas
pesquisas, visando reduzir o uso de agrotóxicos. Neste sentido buscou-se avaliar o efeito de
indutores químicos de resistência no controle da mancha de corinéspora [Corynespora cassiicola
(Berk. e Curt.) Wei] em pepineiro. Inicialmente foi avaliado o efeito dos indutores in vitro sobre
o desenvolvimento de C. cassiicola. Foram estudas os produtos Bion® nas doses de 0,050 e
0,025g/500, Ecolife® nas doses de 1,0 e 2,5mL/500 e Fertisil® nas doses de 0,025 e 0,050g/500
incorporado no meio de cultura BDA. O delineamento experimental foi ao acaso com dez
repetições. As avaliações foram realizadas através de medição do diâmetro das colônias e a
produção de esporos foi avaliada pelo método de contagem em gota. Os genótipos comerciais de
pepineiro Aodai, General Lee F1, Hokushim, Japonês Híbrido F1 (Soudai), Jóia, Marketmore 76
(verde comprido), Natsubayashi, Natsu suzumi, Sprint 440 II e Tsuyataro foram avaliados quanto
à resistência e suscetibilidade à doença. As plantas foram inoculadas aos 30 dias de idade com
uma suspensão de esporos na concentração de 104 conídios/mL do patógeno. A avaliação da
severidade da doença foi feita de acordo com escala de notas descrita por Oliveira et al. (2006).
Foram selecionados os genótipos Tsuyataro, como suscetível e Aodai, como resistente à doença,
para serem usados nos experimentos com os indutores de resistência. Os indutores foram testados
em casa de vegetação, utilizando plantas dos genótipos Tsuyataro e Aodai, em delineamento ao
acaso com cinco repetições. Os tratamentos constituíram nas doses de 0,025, 0,050, 0,075 e 0,15g
de Bion®/500mL; 1,0, 2,5, 3,0 e 7,5mL de Ecolife®/500mL; 4,0, 7,5, 12,0 e 22,5g de
Fertisil®/500mL aplicados 48 horas antes da inoculação com o patógeno. Foi avaliado a
severidade, número e tamanho de lesões e período de incubação do fungo em cada tratamento. Os
dados foram analisados estatisticamente e as médias dos tratamentos comparadas pelo teste
Tukey (5%) utilizando o programa estatístico SAEG. Nos ensaios in vitro o fungo foi sensível ao
Fertisil® nas dosagens utilizadas causando em efeito fungitóxico. Nos tratamentos com Bion® e
Ecolife® não houve efeito sobre o crescimento micelial e a produção de esporos do fungo. A
aplicação dos indutores em casa de vegetação não foi eficiente para controlar a doença nas doses
testadas.
Palavras chave: Corynespora cassiicola, manejo, resistência induzida.
v
ABSTRACT
RESISTANCE INDUCTORS IN CUCUMBER PLANTS AGAINST CORINESPORA’S
LEAF SPOT [Corynespora cassiicola (BERK. end CURT.) WEI]
The search for alternative methods for plant disease control has been the target of several
researches aiming to reduce the use of pesticides. Accordingly, this research evaluated the effect
of chemical resistance inductors in the control of the corinespora’s leaf spot [Corynespora
cassiicola (Berk. end Curt.) Wei] in cucumber plants in a green house. Initially, an experiment
was established to evaluate the effect in vitro of the inductors in the development of C.
cassiicola. The products studied were the following Bion® in dose of 0.050 and 0.025g/500,
Ecolife® in dose of 1.0 and 2.5 mL/500 and Fertisil® in dose of 0.025 and 0.05g/500 incorporated
the BDA culture medium. The experiment was was randomly delineated with ten repetitions. The
evaluations were achieved by measuring the colony diameters and evaluating the spore’s
production by the counting method in drop. The following commercial genotypes of cucumber
plants were evaluated regarding the resistance and susceptibility to the aforementioned disease:
Aodai, General Lee F1, Hokushim, Hybrid Japanese F1 (Soudai), Joia, Marketmore 76 (long
green), Natsubayashi, Natsu suzumi, Sprint 440 II and Tsuyataro. The plants were inoculated at
an age of 30 days with an inoculum’s suspension in the concentration of 104 conidia/mL of the
pathogen..The evaluation of the disease severity was made in agreement with the scale of
gradings described by Oliveira et al. (2006). The genotypes Tsuyataro and Aodai were selected as
susceptible and disease resistance, respectively, and used in the experiments with the resistance
inductors. The inductors were tested in a green house, using plants of the Tsuyataro and Aodai
genotypes, in random delineation with five repetitions. Doses in the range of 0.025, 0.050, 0.075
and 0.15g of Bion®/500mL; 1.0, 2.5, 3.0 and 7.5 mL of Ecolife®/500mL; 4.0, 7.5, 12.0 and 22.5g
of Fertisil®/500mL were tested in cucumber plants. These products were applied 48 hours before
inoculation with the pathogen. The severity, number and lesion size and the fungal incubation
period were evaluated for each treatment. The data was statistically analyzed and the average
compared by the Tukey’s test (5%) using the SAEG statistic program. In the in vitro assays, the
fungus was highly sensible to Fertisil® for the dosage used, causing a fungitoxic effect. The
treatments with Bion® and Ecolife® had no effect upon mycelial growth and the fungal spore
production. The application of inductors in a green house was not efficient to control the disease
in the tested dose.
Keywords: Corynespora cassiicola, management, induced resistance.
vi
LISTA DE FIGURAS
Figura 1 – (A) - Colônia de Corynespora cassiicola. (B) - Conídios visualizados em microscópio
óptico e objetiva de 40X. ............................................................................................................... 19
Figura 2 - Planta de pepineiro com sintomas de mancha de corinéspora. ..................................... 21
Figura 3 - Desbaste de pepineiro. .................................................................................................. 44
Figura 4 - Plantas de pepineiro em câmara úmida após a inoculação em casa de vegetação........ 46
Figura 5 - Medição do diâmetro das colônias de Corynespora cassiicola. ................................... 58
Figura 6 - Preparo de suspensão de esporos de Corynespora cassiicola. ..................................... 60
Figura 7 – Avaliação do número de lesões por cm2 de área foliar (A) e tamanho médio de lesões
(B) em folha de pepineiro. ............................................................................................................. 63
Figura 8 – Reação dos genótipos de pepineiro à mancha de corinéspora com aplicação de
indutores de resistência. 1- testemunha sem indutor e patógeno; 2 - testemunha sem indutor e
com patógeno; 3 - Fertisil® 22,50g; 4 - Fertisil® 12,00g; 5 - Ecolife® 7,50ml; 6 - Ecolife® 4,00ml;
7 - Bion® 3.00g; 8 - Bion® 2.50g; 9 - testemunha sem indutor e patógeno; 10 - testemunha sem
indutor e com patógeno; 11 - Fertisil® 22,50g; 12 - Fertisil® 12,00g; 13 - Ecolife® 7,50ml; 14 Ecolife® 4,00ml; 15 - Bion® 3.00g; 16 - Bion® 2.50g. .................................................................. 71
vii
LISTA DE GRÁFICOS
Gráfico 1 – Curva de progressão da mancha de corinéspora (CPMC) em plantas de pepineiro em
casa de vegetação com dez genótipos............................................................................................ 50
Gráfico 2. Curva de progresso da doença da mancha de corinéspora (Corynespora cassiicola) nos
genótipos Aodai (A) e Tsuyataro (B) de pepineiro no primeiro experimento............................... 69
Gráfico 3. Curva de progresso da doença da mancha de corinéspora (Corynespora cassiicola) nos
genótipos Aodai (A) e Tsuyataro (B) de pepineiro no segundo experimento. .............................. 72
viii
LISTA DE TABELAS
Tabela 1- Severidade média de genótipos de pepineiro inoculados com Corynespora cassiicola.
....................................................................................................................................................... 48
Tabela 2 - Área abaixo da curva de progresso da doença dos dez genótipos de pepineiro. .......... 49
Tabela 3 - Efeito de acibenzolar-s-metil, produto a base de extrato cítrico e silicato de potássio no
índice de crescimento micelial (I.C.M.) e número de conídios in vitro de Corynespora cassiicola.
....................................................................................................................................................... 65
Tabela 4 - Efeito dos indutores químicos de resistência na severidade, número e tamanho das
lesões causadas por Corynespora cassiicola em pepineiro. .......................................................... 68
Tabela 5 - Área abaixo da curva de progresso da doença (AACPD) da mancha de corinéspora
(Corynespora cassiicola) em pepineiro tratados com indutores químicos de resistência. ............ 70
Tabela 6 - Efeito dos indutores à severidade da doença em pepineiro. ......................................... 71
Tabela 7 - Área abaixo da curva de progresso da doença (AACPD) da mancha de corinéspora
(Corynespora cassiicola) em pepineiro tratados com indutores químicos de resistência. ............ 73
ix
SUMÁRIO
1 INTRODUÇÃO .......................................................................................................................... 12
2 OBJETIVOS ............................................................................................................................... 14
Objetivo geral: ........................................................................................................................... 14
Objetivos específicos: ................................................................................................................ 14
3 REVISÃO DE LITERATURA .................................................................................................. 15
3.1 Cultura do pepino ................................................................................................................ 15
3.2 Problemas fitossanitários da cultura .................................................................................... 18
3.3 Aspectos gerais sobre resistência de plantas a fitopatógenos .............................................. 22
3.4 Mecanismos de defesa das plantas contra patógenos .......................................................... 25
3.5 Indução de resistência em plantas a patógenos ................................................................... 31
3.6 Resistência induzida por produtos químicos ....................................................................... 34
3.7 O Silício como indutor de resistência .................................................................................. 38
Capítulo 1 ...................................................................................................................................... 41
REAÇÃO DE GENÓTIPOS DE PEPINEIRO À MANCHA DE CORINÉSPORA (Corynespora
cassiicola) ...................................................................................................................................... 41
1 INTRODUÇÃO .......................................................................................................................... 41
2 OBJETIVOS ............................................................................................................................... 43
Objetivo geral ............................................................................................................................ 43
Objetivo específico .................................................................................................................... 43
3 MATERIAL E MÉTODOS ........................................................................................................ 44
Preparo e cultivo das plantas ..................................................................................................... 44
Obtenção e cultivo do patógeno ................................................................................................ 45
x
Inoculação das plantas ............................................................................................................... 46
Avaliação ................................................................................................................................... 47
4 RESULTADOS E DISCUSSÃO ............................................................................................... 48
5 CONCLUSÕES .......................................................................................................................... 53
Capítulo 2 ...................................................................................................................................... 54
EFEITO DE INDUTORES QUÍMICOS DE RESISTÊNCIA NA SEVERIDADE DA MANCHA
DE CORINÉSPORA (Corynespora cassiicola) EM PEPINEIRO ............................................... 54
1 INTRODUÇÃO .......................................................................................................................... 54
2 OBJETIVOS ............................................................................................................................... 56
Objetivo geral: ........................................................................................................................... 56
Objetivos específicos: ................................................................................................................ 56
3 MATERIAL E MÉTODOS ........................................................................................................ 57
Determinação do efeito dos indutores de resistência no crescimento micelial de Corynespora
cassiicola, in vitro ..................................................................................................................... 57
Determinação do efeito dos indutores de resistência na esporulação de Corynespora cassiicola,
in vitro ....................................................................................................................................... 59
Efeito dos indutores de resistência na severidade da mancha de corinéspora (Corynespora
cassiicola) em pepineiro ............................................................................................................ 60
Preparo das mudas ..................................................................................................................... 61
Aplicação dos indutores............................................................................................................. 61
Inoculação com o patógeno ....................................................................................................... 62
Avaliação ................................................................................................................................... 63
xi
4 RESULTADOS E DISCUSSÃO ............................................................................................... 65
Efeito dos indutores de resistência na severidade da mancha de corinéspora (Corynespora
cassiicola) em pepineiro ............................................................................................................ 67
5 CONCLUSÕES .......................................................................................................................... 76
REFERÊNCIAS ............................................................................................................................ 77
12
1 INTRODUÇÃO
A produção do pepino (Cucumis sativus L.) tem crescido na comercialização. Segundo o
IDAM (2006) observou-se um aumento de 152% no período de 2002 e 2006 no Estado do
Amazonas. É muito apreciado e consumido em todo Brasil, na forma de fruto imaturo cru, em
saladas, curtido em salmoura ou vinagre e, raramente, maduro e cozido (CARDOSO, 2002).
Segundo Lopes (1991), além do valor econômico e alimentar, o cultivo de cucurbitáceas possui
uma outra vantagem, pois, também, tem grande importância social, na geração de empregos
diretos e indiretos, pois demanda grande quantidade de mão-de-obra, desde o cultivo até a
comercialização. Entretanto, o maior entrave é a suscetibilidade a mancha de corinéspora causada
pelo fungo Corynespora cassiicola, o qual ocorre em várias espécies cultivadas de cucurbitáceas,
com grande importância para a cultura de pepino (KUROZAWA et al., 2005).
Antes do ano 2000, a mancha alvo era citada como uma doença de pouca importância
para esta cultura, tanto em cultivo convencional quanto em ambiente protegido (KUROZAWA e
PAVAN, 1997). No entanto, nos últimos anos, esta doença tem se tornado importante para os
produtores de pepino, tanto em estufas como em cultivo convencional, devido à frequentes
epidemias desta doença. Segundo Verzignassi et al. (2003), e, Vida et al. (2004), na região Norte
do Estado do Paraná, essa doença tem ocorrido com frequência, em cultivos de pepino tipo
‘japonês’ acarretando perdas de até 60% na produção.
A resistência de plantas a patógenos baseia-se, em grande parte, na multiplicidade de
barreiras e mecanismos de defesa já existentes e que independem da chegada do inóculo ao sítio
de infecção. Essas defesas são genericamente denominadas de constitutivas, inespecíficas ou
estáticas. As plantas superiores possuem, ainda, outros mecanismos de defesa, supostamente mais
13
eficientes, os quais aparentemente permanecem inativos ou latentes, somente sendo acionados
após serem elas expostas a agentes ativadores (abióticos ou bióticos). Nestes casos, a resistência é
dita dinâmica, pós-infeccional ou induzida (AGRIOS, 1997). Uma forma de ativar tais
mecanismos de defesa é por meio de resistência induzida que se trata de um fenômeno biológico
complexo o qual envolve a ativação de genes relacionados com várias respostas de defesa da
planta com síntese de fitoalexinas, aumento de compostos fenólicos, lignina, e proteínas
relacionadas com a patogênese (proteínas-RP), como a hidrolase β-1,3-glucanase que degrada
paredes celulares de patógenos fúngicos (HAMMERSCHMIDT, 1999).
Segundo Quezado-Duval et al. (2005), o emprego de produtos ativadores de mecanismos
de defesa das plantas é uma abordagem que vem sendo recentemente avaliada para o controle de
fitopatógenos. Esse tipo de resistência seria sistêmica, duradoura e de amplo espectro (LOPES,
2001). O produto comercial Bion® (acibenzolar-S-metil do grupo químico benzotiadiazol - BTH)
tem sido avaliado para o controle de diversas doenças, com resultados experimentais promissores
de ensaios em condições de casa-de-vegetação (SILVA et al., 2000; OBRADOVIC et al., 2005,
CASTRO et al., 2007). Pesquisas têm demonstrado outros compostos capazes de induzir o
sistema de defesa das plantas tais como o ácido DL-aminobutírico (BABA) (QUERINO et al.,
2005), Ecolife® (DANTAS et al., 2002) e Agro-Mos® (DANTAS et al., 2004).
Tendo em vista o potencial do uso de indutores de resistência para o controle de doenças
de plantas e a importância do fungo C. cassiicola como agente da mancha de corinéspora em
pepino, o presente trabalho visa verificar o efeito de indutores de resistência no controle da
mancha de corinéspora em pepineiro.
14
2 OBJETIVOS
Objetivo geral:
- Verificar o efeito de indutores químicos de resistência no controle da mancha de corinéspora em
pepineiro.
Objetivos específicos:
- Avaliar a resistência de genótipos de pepineiro a Corynespora cassiicola;
- Determinar o efeito dos indutores de resistência Acibenzolar-S-Metil, silicato de potássio, e
Ecolife® no crescimento de C. cassiicola in vitro;
- Determinar o efeito de diferentes indutores de resistência na severidade da mancha de
corinéspora em pepineiro em casa de vegetação.
15
3 REVISÃO DE LITERATURA
3.1 Cultura do pepino
O pepino (Cucumis sativus L.) é uma planta da classe das Dicotiledoneae, pertencente à
família Cucurbitáceae (FILGUEIRA, 2003). O seu centro de origem é a Índia, tendo sido levado
para a China e para as Filipinas e as Ilhas Formosas. Da região Norte da China originou-se uma
linhagem ou grupo de pepinos com frutos mais alongados e diâmetro reduzido. Outro grupo, que
se desenvolveu no sul da Ásia, chegou às Ilhas Formosas e depois à Ilha Okinawa, no
arquipélago de Rui Kyu, e em 1923, foi levado para o Japão dando origem ao pepino do grupo
"Aodai" e "Aonaga", hoje conhecidos no mercado como pepinos Comum e Japonês,
respectivamente. Outros tipos de pepino que existem no mercado são "Caipira" e "Conserva"
(GOTO, 2007).
A planta é herbácea, anual, com hastes longas. O hábito de crescimento é
“indeterminado”, e a planta desenvolve-se no sentido vertical ou prostrado, dependendo da
presença ou ausência de suporte. As ramas apresentam gavinhas, que se fixam a qualquer tipo de
suporte (WHITAKER; BEMIS, 1976). As folhas são inteiras, cordiformes (formato de coração),
ásperas ao tato na sua face inferior, verde-claras a verde-escuras. O hábito de florescimento é
monóico, ou seja, há flores unissexuadas, masculinas e femininas na mesma planta, com nítida
predominância das primeiras, o que é uma característica normal da espécie. Entretanto, os
fitomelhoristas criaram híbridos ginóicos. Tanto as cultivares monóica como ginóica exigem a
polinização para desenvolverem os frutos. Os híbridos ginóicos exigem a proximidade de plantas
monóicas que assegurem o fornecimento de pólen, podendo-se plantar uma cultivar polinizadora
na mesma área. Uma solução melhor, utilizada por firmas produtoras de sementes, é adicionar às
16
sementes de tais híbridos ginóicos 15% de sementes da cultivar monóica. Atualmente, também,
há híbridos ginóicos e partenocárpicos – desenvolvidos especialmente para o cultivo em casa de
vegetação, nos quais o desenvolvimento dos frutos independe da polinização (FILGUEIRA,
2003).
O pepino é uma baga suculenta, cheia, de formato cilíndrico, com três a cinco lóculos,
sendo o fruto trilocular, o mais comum. A coloração varia de verde-clara a verde-escura,
conforme a cultivar. Apresenta acúleos moles (“espinhos”), de coloração branca ou escura. A
característica genética “acúleos brancos” é ligada à maior resistência ao amarelecimento póscolheita, sendo, portanto, desejável e buscada pelos fitomelhoristas. Inversamente, a característica
“acúleos escuros” está ligada ao amarelecimento rápido, sendo menos desejável. O sistema
radicular é superficial (FILGUEIRA, 2003).
As cultivares atualmente plantadas podem ser reunidas em quatro grupos ou tipos,
conforme as características e a finalidade dos frutos produzidos. Híbridos modernos vêm
substituindo cultivares não-híbridas apresentando produtividade mais elevada, frutos de melhor
qualidade – geralmente com acúleos brancos – e maior amplitude em termos de resistência a
doenças (FILGUEIRA, 2003).
Pepino do grupo Caipira, os frutos são colhidos com 10-16 cm de comprimento, de acordo
com as preferências regionais, apresentando coloração predominantemente verde-clara, com
manchas verde-escuras na região do pedúnculo. Na maioria das cultivares o fruto é trilocular,
porém há cultivares pentaloculares. O sabor é adocicado, livre de amargo. A cultura tutorada
predomina, embora, também, ocorra a cultura rasteira. O tipo caipira é preferido em alguns
mercados tendo boa aceitação em várias regiões do País (FILGUEIRA, 2003).
O grupo Aodai, caracteriza-se pelos frutos cilíndricos, colhidos com 20-25 cm, de
coloração verde-escura pronunciada, triloculares. Cultivares tradicionais, como Aodai Nazaré,
17
monóicas, tem sido substituído por híbridos ginóicos brasileiros, como Rio Verde e Jóia
(FILGUEIRA, 2003).
Os pepinos do grupo Japonês apresentam frutos tipicamente afilados e alongados, com
20-30 cm, de coloração verde-escura e triloculares, com acúleos brancos. O sabor é típico e
agradável, sendo os frutos preferidos em mercados exigentes. Caracteristicamente, não há
formação de sementes, já que a maioria dos híbridos desse grupo são ginóico-partenocárpicos. A
cultura tutorada é conduzida em casas de vegetação fechadas, sendo a polinização indesejável,
por alterar o formato dos frutos. Bons exemplos são os híbridos Yoshinari e Flecha
(FILGUEIRA, 2003).
Os pepinos do grupo Industrial são curtos, com 5-9 cm, de coloração verde-escura e
triloculares. Os frutos são utilizados na fabricação de picles. Um exemplo é o híbrido ginóico
Supremo. A cultura rasteira e de semeadura direta predomina na produção destinada à
agroindústria, devido ao menor custo de produção (FILGUEIRA, 2003).
De modo geral o cultivo de pepino se dá em clima quente, se desenvolve bem em
temperaturas superiores a 16 °C; não tolera geada; comporta-se melhor em locais com
temperaturas entre 20 e 30 °C (mínimo de 20 °C à noite e 24 °C durante o dia) e umidade relativa
entre 60 e 65% (SOUZA e MATA, 2007). As plantas se desenvolvem e frutificam bem em
condições de solos férteis, ricos em matéria orgânica, solos com boa drenagem, profundos e com
boa disponibilidade de água durante todo seu ciclo, porém não tolera solos encharcados. Para
contornar o problema de baixa temperatura ou época de muita chuva no verão, os produtores têm
produzido pepino em estufas cobertas com plástico. A diferença entre essas duas situações está
no manejo da estufa. No frio, faz-se o fechamento lateral com uma cortina de plástico e abertura
nas horas mais quentes do dia; enquanto, que no verão, deixa-se sempre aberta lateralmente. Com
esse procedimento, consegue-se produzir pepino o ano todo (FILGUEIRA, 2003).
18
Quando cultivado em campo aberto, o pepino deve ser plantado nas épocas em que a
temperatura se mantém entre 22 e 30 °C, inclusive no período do noturno. Abaixo de 15 °C a
planta não se desenvolve adequadamente, podendo ter seu crescimento paralisado. Além do
estresse que causam á planta, temperaturas acima de 30 °C provocam diminuição do número de
flores femininas, quando conjugadas com dias longos (FILGUEIRA, 2003).
A planta do pepino é uma trepadeira, possui hábito de crescimento com gavinhas que
sustentam a planta na posição vertical, com o uso de tutores; isto possibilita a obtenção de frutos
de maior qualidade, facilita os tratos fitossanitários e a colheita (SOUZA e MATA, 2007).
A produtividade esperada para os pepinos dos tipos: Caipira, Aodai e Japonês são de 40 a
50 t/ha e para o pepino indústria, de 20 a 40 t/ha (ARAGÃO, 2003). No Amazonas a cultura do
pepino ocupa o oitavo lugar em importância econômica totalizando 203,35 hectares de área
plantada com uma produção aproximadamente de 4.984 toneladas de acordo com estimativa do
IDAM (2007).
3.2 Problemas fitossanitários da cultura
A cultura do pepino como as demais cucurbitáceas, apresenta diversos problemas
relacionados ao ataque de fitopatógenos, dentre os quais se destacam oídio, antracnose, cancro
das hastes (podridão de micosfarela), míldio, mancha-angular, mancha de leandria, virose (vírus
da mancha-anelar do mamoeiro). O contrbole destas doenças é baseado principalmente no uso de
produtos químicos como: captan, carbenzadin, chlorothalonil, enxofre, fenarimol, folpet,
hidróxido de cobre, mancozeb, oxicloreto de cobre, oxicloreto de cobre + mancozeb, pyrazophos,
quinomethionate,
thiophanate
methyl,
thiophanate
(www.herbario.com.br acessado em agosto de 2007).
methyl
+
chlorothalonil
e
ziram
19
Nos últimos anos tem-se observado ataques severos de mancha de corinéspora causada
por Corynespora cassiicola em cultivos de pepino em diversas propriedades em Manaus-AM e
no Município de Iranduba-AM, reduzindo drasticamente a produção e o tempo de colheita nas
lavouras, tanto em cultivo protegido como em campo aberto (Informação pessoal do produtor
Edenilson Silva Gomes – Iranduba - AM).
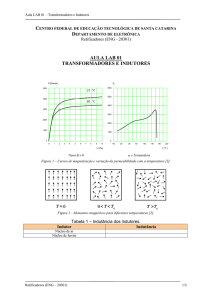
O fungo C. cassiicola (Berk. e Curt.) Wei (Figura 1A) pertencente ao grupo mitospóricos
anteriormente denominado de classe Deuteromycetes, ordem Moniliales e família Dematiaceae.
Possui conidióforo curto, cinza, que produz conídios solitários (Figura 1B) ou em cadeias de dois
a seis, de forma variada, podendo ser clavado, cilíndrico, reto ou curvo, liso, alongado e com até
20 pseudo-septos (REGO e CARRIJO, 2000).
Figura 1 – (A) - Colônia de Corynespora cassiicola. (B) - Conídios visualizados em microscópio óptico e
objetiva de 40X.
Segundo Kurozawa et al. (2005), o fungo possui ampla gama de hospedeiros em diversas
famílias de plantas cultivadas e em várias plantas daninhas. Cutrim e Silva (2003), estudaram a
patogenicidade de isolados C. cassiicola em diferentes espécies de plantas, e observaram que as
plantas daninhas trapoeraba (Commelina benghalensis L.) e “assa peixe” (Vernonia cinérea L.),
foram hospedeiras do fungo, podendo contribuir para o aumento da fonte de inóculo do patógeno
20
no campo. Além destas, outras espécies como abóbora (Cucurbita pepo L.), maxixe (Cucumis
anguria L.), pimentão (Capsicum annum L.), quiabeiro [Abelmoschus esculentus (L.) Monch] e
vinagreira (Hibiscus sabdariffa L.), também, apresentaram sintomas da doença, sendo não
recomendado o cultivo destas, especialmente, nas áreas de ocorrência de C. cassiicola. De acordo
com Rego e Carrijo (2000), a doença pode ser encontrada em todas as espécies cultivadas de
cucurbitáceas, embora seja mais severa em pepino.
Os primeiros sintomas da doença surgem logo após o transplantio, inicialmente sob a
forma de pequenas manchas angulares, com o centro de cor palha e pequeno halo claro,
posteriormente as manchas crescem, tomando formato arredondado, e apresentam centro marrom
claro e bordos encharcados de coloração olivácea. O coalescimento das manchas pode provocar a
seca do limbo foliar. Não tem sido observados sintomas da doença em caule, frutos e raízes
(VERZIGNASSI et al., 2003). Segundo Kurozawa et al. (2005), as manchas em ramos e pecíolos
são mais alongadas.
Verzignassi et al. (2003) relatam que a mancha de corinéspora tem ocorrido com
intensidade nas estufas plástica nos períodos de primavera e verão, atingindo níveis epidêmicos
dentro de poucos dias após a visualização dos primeiro sintomas nas plantas de pepino. O
patógeno sobrevive em restos de cultura, por pelo menos dois anos (REGO e CARRIJO, 2000).
A disseminação de esporos se dá pelo vento (KUROZAWA et al., 2005). Segundo Boiteux e Reis
(2007), a mancha de corinéspora é típica de clima tropical úmido sendo muito destrutiva sob alta
temperatura (acima de 28 °C) e alta umidade (acima de 90%).
Como medidas de controle recomendam-se rotação de culturas por período superior a
dois anos (KUROZAWA et al., 2005) Os fungicidas utilizados para o controle de outras manchas
foliares em cucurbitáceas não têm apresentado resultados práticos no controle dessa doença.
Outras práticas de manejo da cultura como eliminação de restos culturais, maior espaçamento
21
entre plantas e manejo de cortinas laterais das estufas, não tem reduzido a severidade da doença
(VERZIGNASSI et al., 2003).
Na região Norte do país C. cassiicola é um dos principais patógenos na cultura do tomate,
com ou sem cobertura plástica, podendo ser altamente destrutivo (LOURD et al., 1988; LOPES e
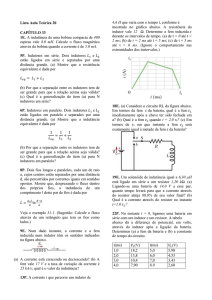
SANTOS, 1994). Em pepineiro este fungo também tem se tornado o principal patógeno desta
cultura em áreas produtoras no Amazonas (Figura 2). Um dos grandes agravantes para o controle
deste patógeno, além do ambiente favorável, é a falta de produtos químicos eficientes e
registrados para este patossistema. Pesquisas sobre a doença nas condições regionais são
inexistentes, sendo necessário estudos visando entendimento das relações patógeno-hospedeiro,
epidemiologia e medidas de controle, com o objetivo final de definir estratégias para o manejo da
doença.
Figura 2 - Planta de pepineiro com sintomas de mancha de corinéspora.
FONTE: Bentes, 2007.
22
3.3 Aspectos gerais sobre resistência de plantas a fitopatógenos
De acordo com Pascholati e Leite (1995), pode-se dizer que uma planta resistente é aquela
capaz de atrasar ou evitar a entrada e/ou a subsequente atividade de um patógeno em seus tecidos.
As plantas podem ser resistentes ou não a certos patógenos, por pertencerem a grupos
taxonômicos que estão fora da gama de hospedeiros (resistência tipo não-hospedeira); por
possuírem genes de resistência (R) cujas proteínas interagem diretamente com proteínas
produzidas por genes de avirulência no patógeno (resistência verdadeira, raça-específica ou
resistência vertical), ou por outras razões pelas quais as plantas escapam ou toleram a infecção
pelo patógeno (AGRIOS, 2005). Ainda o mesmo autor afirma que as plantas não são hospedeiras
da grande maioria dos patógenos conhecidos, desta forma a resistência é uma regra na natureza
enquanto que a susceptibilidade é uma exceção. Muitas vezes a ausência da doença, deve-se ao
patógeno não possuir a habilidade de ligar-se à superfície hospedeira, de não produzir enzimas e
toxinas ou de não tolerar as defesas da planta (LAMB et al., (1989) apud MORAES, 1998). A
variação na suscetibilidade ou resistência a um patógeno é devida a diferentes tipos e número de
genes para resistência presente em cada cultivar. O efeito individual dos genes, varia de
extremamente grande à mínimo, dependendo das funções que ele controla (AGRIOS, 2005).
Do ponto de vista genético, a resistência a doenças é denominada monogênica ou
poligênica. A resistência monogênica, também, chamada de qualitativa ou resistência raçaespecífica, é controlada pela presença de um ou poucos genes, chamados de genes R, que
controlam o reconhecimento entre patógeno e hospedeiro, tornando esta interação incompatível.
Neste caso, a planta e o patógeno são incompatíveis devido à falta de reconhecimento proteínaproteína entre o patógeno e o hospedeiro (AGRIOS, 2005). Estes genes exercem um efeito sobre
o fenótipo de resistência tal que pode ser distinguido em uma população de plantas, causando
23
uma descontinuidade fenotípica, mesmo na presença de outros genes de efeito menor e de
variação ambiental. Neste caso o hospedeiro pode responder com uma reação de
hipersensibilidade, imunidade ou com a inibição da reprodução do patógeno. A resistência
monogênica também é chamada de resistência qualitativa, devido à fácil diferenciação entre
plantas resistentes e suscetíveis, inexistindo reações intermediárias, onde a planta está livre da
doença ou completamente tomada por ela (CAMARGO, 1995; AGRIOS, 2005).
Todas as plantas possuem certo nível de resistência inespecífica que é efetiva contra
alguns dos seus patógenos, e que em geral, mas nem sempre, é controlada por alguns genes,
sendo assim denominada de resistência poligênica. Estes genes parecem estar envolvidos no
controle de processos fisiológicos que fornecem materiais e estruturas relacionadas com
mecanismos de defesa das plantas. A característica mais marcante da resistência poligênica é a
variação contínua nos graus de resistência, apresentados em uma população de plantas, indo
desde a extrema suscetibilidade até extrema resistência, sendo por isso, também denominada de
resistência quantitativa, pois para distinguir os fenótipos resistentes de suscetíveis é necessário
quantificar a doença (CAMARGO, 1995; AGRIOS, 2005).
Epidemiologicamente, a resistência é classificada de acordo com sua efetividade contra
raças do patógenos, conforme Vanderplank (1963). Esta classificação epidemiológica permite
prever o efeito dos tipos de resistência no progresso da doença no campo, permitindo calcular as
suas consequências e subsidiar a tomada de decisão quanto medidas de controle a serem adotadas
(CAMARGO e BERGAMIM FILHO, 1995). A resistência que é efetiva contra uma ou poucas
raças do patógeno é dita resistência vertical ou raça-específica, já a resistência que é efetiva
contra todas as raças é denominada de resistência horizontal ou raça-inespecífica.
Em geral, a literatura relaciona resistência vertical como sendo monogênica e resistência
horizontal como sendo poligênica. Apesar desta relação ser verdadeira para muitos casos, existem
24
relatos onde esta não foi confirmada (CAMARGO e BERGAMIM FILHO, 1995). Em Coffea
canephora Pierre ex. Froehn., estudos genéticos sobre resistência à ferrugem são limitados, mas
indicam uma herança complexa. De acordo com Bettencourt e Rodrigues Jr. (1988), de maneira
geral Coffea canephora é resistente a Hemileia vastatrix, mas os resultados de inoculações de
raças fisiológicas do patógeno indicaram que algumas populações são altamente suscetíveis,
outras totalmente resistentes, e ainda há aquelas que apresentam um tipo de reação heterogênea,
com um ataque moderado do patógeno. Estudos da avaliação da resistência de 150 progênies de
Catimor em geração F4 e F5 mostraram que a maioria das plantas de populações segregantes
apresentou reação intermediária (CHAVES, 1976). Entretanto Abreu (1984), realizando
inoculações em germoplasma de Catimor com seis raças de H. vastatrix obteve plantas altamente
resistentes e plantas altamente suscetíveis.
Quanto à durabilidade estima-se que a resistência vertical (monogênica) seja possível de
ser mais facilmente suplantada, devido à seleção de raças capazes de vencer os mecanismos de
defesa do hospedeiro, controlados por este tipo de resistência. Já a resistência horizontal
(poligênica) é mais difícil de ser vencida, pois tem maior capacidade de resistir às mudanças
genéticas no patógeno. Desta forma, assume-se que resistência poligênica é muito mais estável do
que a monogênica, pois para que surjam formas variantes do patógeno são requeridas mudanças
genéticas em vários loci de patogenicidade, ao contrário do sistema monogênico, onde a mudança
deve ocorrer em apenas um lócus (CAMARGO e BERGAMIM FILHO, 1995).
Em relação ao efeito sobre a epidemia observa-se que a resistência vertical, por ser efetiva
contra algumas raças do patógeno, atua reduzindo a quantidade de inóculo inicial, atrasando o
início da epidemia, sendo que o hospedeiro manifesta a resistência como imunidade ou reação de
hipersensibilidade (RH). Já a resistência horizontal, apesar de ser efetiva contra todas as raças do
patógeno, não previne a ocorrência da doença e sim reduz seus sintomas, como: diminui o
25
tamanho das lesões, aumenta o período latente, reduz a produção de esporos e a severidade. Estes
efeitos são todos parecidos e quantitativos. E quando somados resultam na redução da taxa de
desenvolvimento da doença, sem afetar o inóculo inicial.
3.4 Mecanismos de defesa das plantas contra patógenos
Conforme Pascholati e Leite (1995) e Agrios (1997), mecanismos de resistência de uma
planta ao ataque patogênico são geralmente divididos em duas categorias, as quais são
denominadas de pré-formados (passivos ou constitutivos), ou seja, estão presentes na planta
mesmo antes do contato com o patógeno, e pós-formados (ativos ou induzidos), sendo ativados
ou sintetizados após o contato entre patógeno-hospedeiro, ambas classificadas, quanto à natureza,
em estrutural e bioquímica.
De modo geral as plantas se defendem do ataque de patógenos utilizando mecanismos
estruturais de defesa, os quais atuam como barreira física e inibem a entrada e disseminação do
patógeno no interior do hospedeiro, e pelo uso de mecanismos bioquímicos, os quais reagem nas
células e tecidos da planta, produzindo substâncias que são tóxicas para o patógeno ou inibem seu
crescimento no hospedeiro (AGRIOS, 2005).
Dentre os fatores estruturais de resistência pré-formados, pode-se citar a cutícula, os
tricomas, estômatos, fibras e vasos condutores. Já os estruturais pós-formados, incluem as
papilas, camadas de cortiças, camadas de abscisão, tiloses entre outros (PASCHOLATI e LEITE,
1995; AGRIOS, 2005).
É na cutícula, em geral, que ocorre o primeiro contato entre o patógeno e o hospedeiro. É
constituída por uma mistura de ceras e cutina, e recobre os órgãos da parte aérea. O efeito da
cutícula no desenvolvimento da doença pode ser devido à sua molhabilidade, formando uma
camada hidrofóbica na superfície dos órgãos devido à sua composição, o que impede a formação
26
de um filme de água, necessário para a germinação, movimentação e multiplicação de fungos e
bactérias. Devido à sua composição química, a cutícula, também pode ser vista como uma
barreira tóxica, devido à liberação de substância antifúngica. Portanto, a presença de
componentes mais resistentes à degradação enzimática na cutícula e/ou sua maior espessura, pode
reduzir a eficiência de penetração e colonização, ou pelo menos atrasar esses eventos,
contribuindo assim para a resistência (LIMA et al., 2005).
De acordo com Lichston e Godoy (2006), ao estudarem o efeito da aplicação de
fungicidas na morfologia e no teor de cera epicuticular em cultivares de café resistente e
suscetível à ferrugem, observaram que a aplicação de fungicidas diminuiu o teor da cera e alterou
sua morfologia da cutícula das plantas, provocando rupturas e desaparecimento dos cristalóides, o
que pode tornar as plantas mais suscetíveis a patógenos, além de que o tipo de cera nas cultivares
estudada apresentava com características diferentes, o que pode estar relacionado com a
resistência à ferrugem do café.
Tricomas são prolongamentos unicelulares ou multicelulares que se estendem a partir da
epiderme, podendo ocorrer em diferentes superfícies de plantas e exibir várias formas. Embora a
possível contribuição dos pêlos, que são os tricomas mais comuns, na resistência tenha sido
aventada, pouca evidência existe demonstrando o envolvimento dessas estruturas. Por exemplo,
em função do número de pêlos por área de tecido, os mesmos poderiam interferir na continuidade
do filme d’água sobre a superfície do hospedeiro, dificultando, portanto, a germinação dos
esporos e a multiplicação das bactérias. Além disso, como os tricomas podem repelir insetos,
poderiam contribuir de maneira indireta para com a resistência das plantas, visto manterem as
mesmas livres de insetos vetores de microrganismos patogênicos (PASCHOLATI e LEITE,
1995).
27
Jerba et al. (2005), ao avaliarem as características estruturais da superfície foliar cultivares
de feijoeiro, suscetível, moderadamente resistente e resistente a antracnose em relação à préinfecção pelo fungo Glomerella cingulata f.sp. phaseoli, observaram que a cultivar resistente
apresentou menor área de nervuras secundárias e maior quantidade de tricomas e que as demais
cultivares, nos quais o patógeno permaneceu retido, evidenciando que existe relação entre a
resistência e características estruturais da superfície foliar, como pilosidade neste patossistema.
Os estômatos, em função do número, morfologia, localização e período de abertura, são
estruturas que podem contribuir para a resistência das plantas em algumas interações com
fitopatógenos. Os estômatos normalmente ocorrem em densidade de 100-300/mm2 na superfície
das folhas e, quando completamente abertos, apresentam o ostíolo com uma área para a
penetração ativa de tubos germinativos de fungos, bem como para a penetração passiva de células
bacterianas (PASCHOLATI e LEITE, 1995).
Embora a maioria dos patógenos tente penetrar mesmo com os estômatos fechados,
somente alguns penetram quando estão abertos. Algumas variedades de trigo resistentes ao
Puccinia graminis f.sp. tritici apresentam abertura estomática tardia, acarretando dessecação do
tubo germinativo devido à evaporação do orvalho combinada com a demora na abertura dos
estômatos. As próprias estruturas do estômato (abertura estreita, células guarda elevadas) também
se constituem em fatores de resistência (BALARDIN, 2002).
Papilas são caracterizadas pela deposição de material heterogêneo entre a membrana
plasmática e a parede celular no sítio de infecção, sob a hifa de penetração. As papilas podem ser
formadas dentro de 2-3 horas após a inoculação com fungos. Existem evidências que a deposição
de material papilar pode ser iniciada antes da penetração e continuar após a penetração. Em geral,
são constituídas de calose (β-1,3-glucana), podendo também conter lignina, derivados fenólicos,
celulose, silício e suberina (RIOUX e BIGGS, 1994). As papilas funcionam como barreiras
28
visco-elásticas contra a penetração e troca de metabólitos entre o hospedeiro e o patógeno, além
de servirem como um mecanismo de reparo da parede celular após a invasão do patógeno
(RESENDE et al., 2008).
As camadas de cortiça podem ser formadas em resposta à injúria mecânica e à presença de
patógenos, principalmente fungos e bactérias. As camadas de cortiça originam-se de células
formadas a partir do felogênio (tecido meristemático). Essas se caracterizam pela presença de
suberina (polímero insolúvel associado com ceras solúveis) e protoplasma morto. A atividade do
felogênio nos pontos de penetração e crescimento dos patógenos origina as células de cortiça, as
quais impedem a invasão dos tecidos sadios da planta por esses patógenos, além de interromper o
fluxo de nutrientes e água em direção ao invasor e o fluxo de metabólitos tóxicos em direção ao
hospedeiro. Os tecidos mortos envoltos pelas camadas de cortiça, os quais incluem o patógeno,
podem permanecer na planta, originando manchas necróticas (PASCHOLATI e LEITE, 1995).
Outra estrutura de resistência pós-formada é a camada de abscisão. Na maioria das
espécies vegetais, a abscisão de folhas, flores, frutos ou partes de alguns desses órgãos é
precedida pela formação de uma camada ou zona de abscisão. No caso de folhas, zonas de
abscisão podem ser formadas em torno dos sítios de infecção fúngica, bacteriana ou viral. Essas
zonas podem ser precedidas pela formação de zonas de lignificação internamente às mesmas. A
zona de abscisão é caracterizada pela dissolução da lamela média entre duas camadas de células
adjacentes, através da ação de enzimas, principalmente celulolíticas e pectinolíticas. Essa
dissolução causa a separação das células, com o conseqüente afrouxamento dos tecidos
envolvidos, o que pode levar à queda dos tecidos contendo o patógeno. Dessa forma, nas
interações planta-patógeno, a camada de abscisão separa o tecido sadio do doente, protegendo o
restante da planta contra a subsequente invasão pelo patógeno e contra a ação de metabólitos
tóxicos do mesmo (PASCHOLATI e LEITE, 1995).
29
Dentre os mecanismos de defesa intravascular, a oclusão dos vasos do xilema em resposta
a estresse biótico ou abiótico, é um fenômeno de ocorrência generalizada, que pode ser causada
pelo acúmulo de géis de pectina e hemicelulose ao redor da placa perfurada da terminação do
vaso e/ou pelo supercrescimento de protoplastos de células do parênquima vascular adjacente,
que se expandem para dentro dos vasos através das pontuações, formando as chamadas tiloses
(RESENDE et al., 2008). Essas projeções protoplasmáticas podem aumentar em tamanho e
número no interior dos vasos, levando à obstrução parcial ou total dos mesmos. Essa obstrução
irá restringir o transporte de água, bem como poderá conter o avanço do patógeno para outros
locais do hospedeiro. Obviamente, a formação de tiloses pode contribuir com a resistência da
planta apenas quando esta ocorre precocemente e nas áreas próximas ao sítio inicial de infecção
(PASCHOLATI e LEITE, 1995).
As plantas podem se defender bioquimicamente também, ou seja, as reações bioquímicas
que ocorrem nas células do hospedeiro produzem substâncias que mostram-se tóxicas ao
patógeno ou criam condições adversas para o crescimento do mesmo no interior da planta.
Embora os mecanismos estruturais possam atuar, em diferentes níveis, na defesa das plantas
contra alguns patógenos, pesquisas mostram que, na maior parte das interações, são as
substâncias produzidas nas células do hospedeiro, antes ou após a infecção, que contribuem
significantemente para a resistência (PASCHOLATI e LEITE, 1995).
Dentre os fatores de resistência bioquímicos destacam-se as fitoalexinas, reação de
hipersensibilidade (RH) e as proteínas relacionadas à patogênese (PRPs). As fitoalexinas são
definidas como compostos antimicrobianos de baixo peso molecular, que são sintetizados pelas
plantas e que se acumulam nas células vegetais em resposta à infecção microbiana. Diversas
classes de produtos naturais como alcalóides, compostos fenólicos e flavonóides, entre outros,
têm sido descritas como fitoalexinas (AGRIOS, 2005).
30
Acredita-se que a maioria das plantas seja capaz de sintetizar fitoalexinas, mas algumas a
fazem de maneira muito lenta, permitindo que o microrganismo complete a infecção antes que
haja o acúmulo dessas substâncias em quantidades suficientes para inibi-lo. Para diversas
interações planta-patógeno foi demonstrado que a velocidade de acúmulo das fitoalexinas é um
dos fatores decisivos para o estabelecimento ou não da infecção (BRAGA, 2007).
Uma defesa comum é a reação de hipersensibilidade (RH), na qual é caracterizada pela
morte programada das células em torno da infecção e atua contra patógenos biotróficos, pois
restringe o acesso a água e nutrientes, sendo ativada pelo sinal do AS (GLAZEBROOK, 2005). A
reação é considerada como uma resposta de defesa induzida, culminando na parada do
crescimento e do desenvolvimento do patógeno nos tecidos da planta. A resposta ocorre em
função do reconhecimento da infecção, por parte do hospedeiro, como uma consequência da
incompatibilidade entre a planta e o patógeno. Portanto, a RH ocorre somente em interação
incompatíveis. O processo de morte celular na RH é caracterizado pela agregação do citoplasma,
parada dos movimentos citoplasmáticos, perda da permeabilidade das membranas, degeneração
do núcleo e organelas, além de aumento acentuado da respiração e do acúmulo de compostos
fenólicos e fitoalexinas (PASCHOLATI e LEITE, 1995). Se a resposta de hipersensibilidade tiver
sucesso uma pequena região do tecido morto permanece no local do ataque do patógeno, mas o
restante da planta não é afetado (TAIZ e ZEIGER, 2004).
As proteínas relacionadas com patogênese (PRPs) começaram a ser investigadas no início
da década de 70, por Van Loon e Van Kammen (1970), como macromoléculas envolvidas em
resistência induzida, tendo fumo-TMV como patossistema-modelo. Hoje, tem-se conhecimento
de que as PRPs são produzidas por muitas plantas como resposta à infecção por patógenos
(STICHER et al., 1997). Van Loon et al. (1994) propuseram uma nomenclatura para as PRPs,
classificando-as em 11 “famílias”. As mais comumente investigadas são PR-1, PR-2 (β-1,3-
31
glucanases), PR-3 (Quitinases) e PR-5 (Osmotina). Estas proteínas são polipeptídeos produzidos
pelo hospedeiro e que não estão presentes em tecidos sadios, sendo sintetizados somente em
resposta a estresses diversos ou à especificamente devido ao ataque de um patógeno. São
proteínas localizadas intra ou extracelularmente, que se acumulam em resposta a substâncias
químicas, elicitores, senescência natural, ferimentos ou ataque de patógenos (BALARDIN,
2002). As PRPs acumulam-se em locais distantes do sítio de infecção, (STICHER et al., 1997).
Sua síntese e acúmulo possuem caráter de resposta ativa e de sistemicidade, em casos de
resistência induzida (LAWRENCE et al., 1996; van LOON, 1997).
3.5 Indução de resistência em plantas a patógenos
A indução de resistência envolve a ativação dos mecanismos latentes de resistência
(bioquímicos e estruturais) em uma planta através de tratamentos com agentes bióticos ou
abióticos. A manifestação da resistência induzida depende do intervalo de tempo entre o
tratamento indutor e a subsequente inoculação com patógeno (desafiador), indicando que
mudanças específicas no metabolismo da planta, como a síntese e/ou acúmulo de substância, são
importantes e necessárias (PASCHOLATI e LEITE, 1995).
Os indutores de resistência em plantas a patógenos podem ser bióticos ou abióticos.
Assim, pode ele ser um ativador químico como os derivados benzotiadiazólicos e outros
compostos (ARAÚJO et al., 2005; TÖFOLI, e DOMINGUES, 2005; GURGEL et al., 2005;
CAVALCANTI et al., 2006; RODRIGUES et al., 2006), extratos de células de (MOTOYAMA et
al., 2003; BONALDO et al., 2003) ou microrganismos vivos (HOFFLAND, et al., 1996; LIU, et
al., 1995). Nesse último caso, quase sempre os agentes são rizobactérias promotoras do
crescimento de plantas (ALSTRÖM, 1991; KLOEPPER 1996; KLOEPPER et al., 1997). Essas
32
rizobactérias
são,
internacionalmente,
designadas
PGPR
(“Plant
Growth-Promoting
Rhizobacteria”).
A proteção induzida pode se manifestar de forma local e/ou sistêmica. De acordo com
Agrios (2005), a resistência induzida inicialmente é localizada próximo ao ponto necrótico
causado pela infecção ou indutor abiótico. Em seguida a resistência se “espalha” sistemicamente
para locais distantes não tratados na planta, tendo efeito prolongado, podendo se estender por
toda a vida da planta, dependendo do indutor utilizado, e ainda ser inespecífica, ou seja, de amplo
espectro, protegendo a planta contra diversos fitopatógenos (PASCHOLATI e LEITE, 1995;
AGRIOS, 2005).
A resistência sistêmica induzida (ISR- Induced Systemic Resistance) e a adquirida (SARSystemic Acquired Resistance) são fenômenos distintos, porém, fenotipicamente semelhantes,
onde a planta após a exposição a um agente indutor tem seus mecanismos de defesa ativados não
só no sítio de indução como, também, em locais distantes de forma generalizada (STICHER et
al., 1997). No entanto, SAR e ISR, são fenômenos distintos quanto à forma pela qual são
induzidos e desencadeados por mecanismos bioquímicos diferentes, mas semelhantes no
resultado final que se expressa sob a resistência sistêmica (ROMEIRO, 1999).
De modo geral, de acordo com Metraux (2007), o termo SAR foi usado inicialmente para
descrever a resistência sistêmica observada em muitas plantas após a infecção local por um
patógeno necrosante, sendo dependente de ácido salicílico (AS). Já o termo ISR, descreve a
resistência sistêmica, induzida pela exposição a um microrganismo não patogênico, como
rizobactérias, e não é dependente de AS estando associada à jasminatos e etileno. Assim, ISR foi
proposto como um termo genérico, e SAR é usada somente para resistência sistêmica induzida
por um patógeno sendo AS-dependente. Durrant e Dong (2004) e Pieterse et al., (2005), afirmam
que SAR envolve o acúmulo de proteína PR (Protéinas Relacionadas com Patogênese), é
33
salicitato-dependente, pode resultar em alterações visuais, como necroses na planta que sofreu a
indução, e pode ser induzida por patógenos ou ativadores químicos. No caso ISR, não há
acúmulo de proteínas PR, a planta não exibe necrose, o indutor em geral é um microrganismo
não-patogênico, a indução não é dependente de ácido salicílico.
O primeiro estudo a caracterizar em detalhes a ocorrência de SAR, foi realizado por Ross
(1961), trabalhando com o patossistema fumo (Nicotiana tabacum L.) e o vírus do mosaico do
fumo (TMV). Neste estudo, o autor inoculou folhas fumo var. Samsun NN com o TMV e
observou a indução de alto nível de resistência nas demais folhas não inoculadas, sete dias após o
tratamento inicial, resultando em lesões com tamanho e em número reduzido.
Uma cascata de eventos moleculares e bioquímicos está envolvida na expressão de SAR.
A iniciação da SAR ocorre pela percepção de indutores (patógenos ou químicos) pela planta, e
formação de lesões necróticos resultando na geração de moléculas sinal que são translocadas para
pontos distantes do local necrosado. A percepção dos indutores é efetuada através da ligação
entre moléculas derivadas do patógenos (elicitores) ou produtos químicos, com um sítio receptor
na membrana plasmática ou parede celular vegetal (MORAES, 1998; EDREVA, 2004). A
geração e natureza dos sinais bem como o modo de translocação e interação entre eles ainda são
alvo de extensos estudos (EDREVA, 2004).
De acordo com Moraes (1998), para que uma molécula atue como sinalizadora, ela deve
ser sintetizada pela planta, aumentar sistemicamente após o ataque do patógeno ou outro agente
indutor, mover-se através da planta, induzir fitoalexinas e proteínas relacionadas à defesa vegetal,
resultando no aumento da resistência a patógenos. A resistência de plantas contra doenças está
associada a um conjunto de resposta de defesa ativadas pelo hospedeiro após o contato com
agentes patogênicos, que depende da eficiência do hospedeiro em reconhecer a presença de
patógenos pelos mecanismos de percepção e transdução de sinais, ocorrendo a ativação de fatores
34
de transcrição no núcleo da célula vegetal, com a expressão subsequente de genes de defesa
(GUZZO, 2004).
O ácido salicílico (AS) é reconhecidamente tido como uma molécula sinal ou prérequisito para produção de sinais em SAR (CHASAN, 1995; DURRANT e DONG, 2004;
EDREVA, 2004). A aplicação exógena de AS induz a expressão gênica de proteínas envolvidas
em SAR e reforça a resistência contra patógenos. Após aplicação o AS endógeno acumula-se em
níveis altos no local da infecção com um subsequente aumento (em menor quantidade) nos
tecidos não infectados.
Evidências sobre o envolvimento do AS em SAR estão descritas em diversos estudos,
como os de Gaffiney et al. (1993), onde os autores demonstraram que plantas transgênicas
expressando o gene nahG (bacteriano), que codifica o salicilato hidroxilase (Nahg), enzima que
catalisa a conversão de AS para catecol, e portanto deixaram de acumular AS e não expressaram
SAR em resposta à patógenos, sugerindo a necessidade deste composto para indução de SAR
(MORAES, 1998).
A indução de resistência em plantas, além de ser utilizada como uma ferramenta para
estudo bioquímicos e fisiológicos dos mecanismos de resistência e suscetibilidade contra
fitopatógenos, pode também ser vista como uma possível medida de controle de doenças das
culturas.
3.6 Resistência induzida por produtos químicos
O controle químico de doenças de plantas está baseado amplamente no uso de fungicidas,
bactericidas e inseticidas através de sua ação direta sob os patógenos ou sobre os vetores de
doenças (CASTRO et al., 2007). Pesquisas intensivas em busca de novos conceitos e alternativas
35
para o controle de doenças têm levado ao desenvolvimento de substâncias capazes de induzirem
o sistema de defesa da planta, tornando-a resistente à ação de patógenos sem a alteração de sua
constituição genética básica (LEROUX, 1996; RYALS et al., 1996).
A ativação de resistência pode ocorrer em condições controladas ou no campo, além de
exibir vantagens como: efetividade contra vírus, bactérias, fungos e nematóides; estabilidade
devido à ação de diferentes mecanismos de resistência; caráter sistêmico, persistente e natural da
proteção; transmissão por enxertia; economia de energia metabólica e utilização do potencial
genético para resistência em todas as plantas suscetíveis (PASCHOLATI, 2002). A desvantagem
é uma resistência parcial, incompleta e que pode requerer reativações temporárias, porém, por ser
parcial e inespecífica, a resistência induzida não impõe pressão de seleção sobre o patógeno,
dificultando, assim, a quebra de resistência (SILVA e RESENDE, 2001).
Qualquer composto ou fator capaz de ativar mecanismos de defesa da planta é
denominado agente indutor, e a molécula presente em um indutor responsável diretamente pela
ativação dos mecanismos de defesa é denominado eliciador (BONALDO et al., 2005).
Ativação de defesa natural da planta tem sido demonstrada após a aplicação exógena de
compostos como 2, 6-dicloroisonicotinico (INA), ácido DL-â-aminobutírico (BABA),
acibenzolar-S-methyl (ASM), ácido poliacrílico, tianina, Ecolife® (DANTAS et al., 2002), AgroMos® (DANTAS et al., 2004) e quitosana (JAKAB et al., 2001) dentre outros.
O indutor abiótico BABA é um aminoácido que ao ser aplicado sobre a superfície foliar
ou no solo, induz a resistência contra vários patógenos foliares e radiculares. O BABA induz a
acumulação de PR-proteínas por diferentes caminhos, dependendo do sistema patógenohospedeiro (COHEN, 2001). A aplicação de BABA na dosagem de 2,100 mg.ml -1, em banana
‘Maçã’, propiciou redução de 35,29% na severidade de do mal- do- Panamá quando aplicado
quatro semanas antes da inoculação com F. oxysporum f.sp. cubense (QUERINO et al., 2005).
36
Existem relatos de que o benzothiadiazole (acibenzolar-S-methyl) (BHT), análogo do
ácido salicílico, tem demonstrado ser um potente ativador de resistência sistêmica induzida,
possibilitando a proteção de plantas em condições de campo com relação a um amplo espectro de
doenças em várias espécies vegetais (SILVA, et al., 2000). Segundo Yamagushi (1998), o
benzotiadiazol (acibenzolar-S-methyl), não possui ação antifíngica direta, atuando supostamente,
com papel semelhante ao ácido salicílico na via de transdução do sinal que leve à resistência
sistêmica adquirida. A aquisição de resistência através de BTH deve-se principalmente ao
acúmulo nas células de PR-proteínas como as proteinases, quitinases e peroxidases. Tais
proteínas apresentam a capacidade de degradar as paredes celulares de fungos e bactérias,
impedindo o processo infeccioso (MADAMANCHI e KUC, 1991).
O indutor abiótico acibenzolar-S-methyl-ASM (nome comercial BION®), considerado
ativador de defesas de plantas, possui propriedades de elicitar respostas de resistência em plantas
contra um amplo espectro de patógenos (QUERINO et al., 2005). BION® é utilizado no Brasil
em escala comercial na cultura do tomate, promovendo, além de menor severidade das doenças,
incrementos na produção e na qualidade dos frutos (CASTRO et al., 2007). O uso do ASM,
formulado com 50 % do i.a. em grânulos (BION WG 50), foi aplicado na concentração de 5,0 mg
do i.a.mL-1 de água, aos cinco dias após a germinação do feijão caupi, no qual proporcionou um
controle da murcha de fusário na cultivar BR-17 Gurguéia, suscetível à murcha de fusário, na
qual apresentou um controle de 68,90%, enquanto a cultivar IPA-206, com resistência
intermediária, apresentou 71,59% do controle (RODRIGUES et al., 2006). A ativação da
resistência em cultivares suscetíveis foi também observada por Dann e Deverall (2000), em
ervilha tratada com ASM e demonstrada pela menor percentagem de área foliar afetada por U.
viciae-fabae: 1,5% comparado a 9,39% do controle.
37
Em um trabalho desenvolvido por Smith-Becker et al. (1998), com aplicação de ASM em
50 ou 100 µg.mL-1, resultou na proteção completa em melões contra C. lagenarium (Pass.) Ell.
And Halst. Redução de até 55,4% na severidade da doença e um acréscimo na ordem de 10,5%
no peso fresco e 35,7% na altura das plantas foram observadas, quando da utilização da dosagem
de 20 g do i.a./100 l de água, em comparação com as plantas somente inoculadas com o fungo,
evidenciando a eficácia do ASM como indutor e resistência em plântulas de cacaueiro suscetíveis
à murcha-de-Verticillium (CAVALCANTI e RESENDE, 2005). Castro et al. (1999), por sua vez,
verificaram proteção do tomateiro contra Pseudomonas syringae pv. tomato (Okabe) Young, Dye
e Wilkie, agente causal da pinta bacteriana, empregando igual dosagem do ASM (2,5 g i.a/100 L
água).
Segundo alguns autores (OOSTENDORP et al., 2001; LOUWS et al., 2001), o ASM
apresenta as vantagens de perfil ecotoxicológico aceitável, amplo espectro de ação, com base em
mecanismo que não apresenta risco maior de seleção de estirpes resistentes de fitopatógenos.
O Ecolife® é uma formulação comercial constituída de diversos composto orgânicos
(bioflavonóides cítrico, ácido ascórbico, fitoalexinas cítricas, ácidos orgânicos e açúcares), obtido
industrialmente por extração e/ou fermentação de um substrato orgânico derivado de plantas
cítricas (SOBRINHO et al., 2005), que bioestimulam as plantas a produzirem suas próprias
defesas. Pode ser aplicado alternadamente com outros produtos, é atóxico, não corrosivo e não
volátil e tem uso na pré e pós-colheita sem período de carência (DANTAS et al., 2004).
Entre os indutores bióticos, o Agro-Mos® que é um mananoligossacarídeo fosforilado
derivado da parede da levedura Saccharomyces cerevisae 1026 (Hansen), tem demonstrado
eficiência no controle de doenças (DANTAS et al., 2004).
A ação do indutor quitosana pode se dar através da criação de uma barreira estrutural, pela
lignificação da parede celular, ou pelo efeito inibitório sobre o crescimento de fungos
38
fitopatogênicos (BENHAMOU et al., 1998). De acordo com Rodrigues et al. (2006), o uso da
quitosana na concentração de 2 mg/mL, proporcionou o segundo maior controle da murcha de
Fusarium do feijão caupi, com redução de 65,40% para a cultivar BR-17 Gurguéia e 47,59% para
a cultivar IPA-206.
3.7 O Silício como indutor de resistência
A nutrição mineral é um fator ambiental passível de ser manipulado pelo homem com
relativa facilidade e utilizado como complemento ou método alternativo no controle de doenças
(MARSCHNER, 1995).
O silício (Si) como fertilizante é muito utilizado em vários países como Japão e,
atualmente, está sendo muito pesquisado no Brasil, Austrália e África do Sul. O Japão utiliza o
silício no cultivo de arroz há várias décadas. Em Maurícius, uma pequena ilha localizada no
Oceano Índico, grande produtor de cana-de-açúcar, usa-se cimento como fonte de Si. Ainda nesse
país a análise de Si no solo é rotina nos laboratórios de fertilidade do solo. Os EUA já incorporam
a adubação com Si nas culturas de arroz e cana-de-açúcar, utilizando, principalmente, o silicato
de cálcio e magnésio, um subproduto da indústria siderúrgica e da produção de fósforo elementar.
No Brasil existem várias marcas comerciais de produtos contendo Si. Por exemplo, o adubo
fosfatado termofosfato
possui aproximadamente 22% de SiO2 na sua composição
(KORNDÖRFER, 2003).
Um número grande de materiais tem sido utilizado como fonte de Si para as plantas tais
como: escórias de siderurgia, volastonita, sub-produtos da produção de fósforo elementar, em
fornos elétricos, metasilicato de cálcio, metasilicato de sódio, cimento, termofosfato, silicato de
magnésio (serpentinitos) e silicato de cálcio. A wolastonita é o silicato de cálcio considerado
39
padrão internacional, e dessa forma, muito empregado em experimentação (KORNDÖRFER et
al., 2002).
Entre os elementos minerais, o silício tem proporcionado resultados promissores no
controle de doenças em plantas, embora não atenda aos critérios de essencialidade. O silício é
considerado elemento útil e benéfico para as plantas. Plantas em ambiente enriquecido com
silício diferem das cultivadas com deficiência do elemento, principalmente, quanto à composição
química, resistência mecânica das células, características de superfície foliar, tolerância ao
estresse abiótico e a ocorrência de pragas e doenças (EPSTEIN 1999; EPSTEIN e BLOOM,
2006).
O Si é absorvido pela planta na forma de ácido monossilícico (H4SiO4) (YOSHIDA,
1975; TAKAHASHI, 1996). No interior da planta, 99% de Si acumulado encontram-se na forma
de ácido silícico polimerizado, o restante, 1%, encontra-se na forma coloidal ou iônica
(YOSHIDA, 1975).
Segundo Faria (2000), a produção de grãos do arroz cresceu de forma positiva com o
aumento das doses de Si aplicada. Independentemente do tipo de solo, houve um aumento linear
da produção que variou de 38,6 para 54,3 g vaso-1 na Areia Quartzosa e de 60,6 para 79,0 g vaso-1
no Latossolo Vermelho-amarelo, respectivamente para as doses 0 de 600 Kg ha-1 de Si. Com esse
comportamento linear, o autor sugere que a produção de grãos poderia ser maior, caso fossem
utilizadas doses de Si superiores a 600 Kg ha-1.
Também foram encontrados em plantas de pepino, cultivadas em solução nutritiva,
suplementada com 100 mg.kg-1 de silicato de potássio houve redução no crescimento das
colônias de oídio nas folhas das plantas tratadas, atribuída à presença de silício ao redor das hifas
(SAMUELS et al., 1991b). Os mesmos autores em outro experimento (1991a) observaram em
plantas de pepino suplementadas com 0,1g kg-1 de solo de silicato de potássio, o depósito de Si na
40
base do tricoma, ao redor das hifas e dos conidióforos de Sphaerotheca fuliginea. Em estudos
realizados na superfície de folhas de videira e de pepino pulverizadas com 1g de Si.l -1, também
foi observado o acúmulo de Si, de maneira a constituir barreira física e impedir o crescimento das
hifas de Uncinula necator (BOWEN et al., 1992) e S. fuliginea (SAMUELS et al., 1991a).
Feijoeiro (Phaseolum vulgaris) com silicato apresentaram menor área abaixo da curva de
progresso da incidência (AACPI) e área abaixo da curva de progresso da severidade (AACPS)
quando comparadas ao tratamento com óxido de cálcio (1,76g.kg-1 de CaO) incorporado ao solo,
inoculadas com a maior concentração de inóculo, ou seja, 106 conídios/mL de Colletotrichum
lindemuthianum, evidenciando o efeito do Si em reduzir a intensidade da antracnose (MORAES
et al., 2006).
O Si tem sido avaliado como um potencial agente envolvido na manifestação de defesa de
plantas a patógenos, segundo Rodrigues e Datnoff (2007), o uso de Si pode ser uma prática
desejável no controle de doenças de plantas, principalmente para aquelas culturas capazes de
acumular este elemento.
41
Capítulo 1
REAÇÃO DE GENÓTIPOS DE PEPINEIRO À MANCHA DE
CORINÉSPORA (Corynespora cassiicola)
1 INTRODUÇÃO
As hortaliças exercem um importante papel econômico, social e nutricional na cadeia
produtiva de alimentos. Sua produção, entretanto, tem sido constantemente ameaçada pelo ataque
de grande número de doenças causadas por diferentes patógenos.
A cultura do pepino (Cucumis sativus L.) em algumas localidades do Estado do
Amazonas tem sido grandemente afetada pelo fungo Corynespora cassiicola (Berk e Curt.) Wei
principalmente em época de chuva, atingindo níveis epidêmicos de mancha de corinéspora dentro
de poucos dias após a visualização dos primeiros sintomas nas plantas. O patógeno é considerado
de difícil controle, uma vez que pode atacar outras culturas importantes, como pimentão
(Capsicum annum L.), quiabeiro [Abelmoschus esculentus (L.) Monch], vinagreira (Hibiscus
sabdariffa L.), abóbora (Cucurbita pepo L.), maxixe (Cucumis anguria L.), tomate (Solanum
lycopersicum L.) e alface (Lactuca sativa L.) (CUTRIM e SILVA, 2003; BOITEUX e REIS,
2007; SANTOS et al., 2007). Segundo Verzignassi et al. (2003), os fungicidas utilizados para o
controle de outras manchas foliares em cucurbitáceas não têm apresentado resultados práticos no
controle dessa doença.
Sabendo-se que o uso de cultivares resistente constitui o método mais eficiente, racional e
econômico para evitar ou ao menos diminuir os danos causados por patógenos, e devido à grande
importância que a mancha de corinéspora tem assumido em cultivo de pepino, estudos sobre o
42
comportamento de híbridos comercializados em Manaus são necessários visando avaliar a
suscetibilidade destes materiais e a busca de medidas de manejo da doença e a identificação de
híbridos com maior nível de resistência à doença que possam ser recomendados aos agricultores
locais.
43
2 OBJETIVOS
Objetivo geral
- Avaliar a resposta de genótipos comerciais de pepineiro (Cucumis sativus) à mancha de
corinéspora (Corynespora cassiicola), em casa de vegetação.
Objetivo específico
- Selecionar genótipos de pepineiro resistentes e suscetíveis à mancha de corinéspora.
44
3 MATERIAL E MÉTODOS
O experimento foi conduzido em casa de vegetação no Setor de Produção da Faculdade de
Ciências Agrárias da UFAM no período de janeiro a março de 2008.
A severidade da mancha de corinéspora foi avaliada em dez genótipos de pepineiro, sendo
estes a cultivar Aodai, General Lee F1, Hokushim, Japonês Híbrido F1 (Soudai), Jóia,
Marketmore 76 (verde comprido), Natsubayashi, Natsu suzumi, Sprint 440 II e Tsuyataro. Sendo
todos os genótipos obtidos no comércio.
Preparo e cultivo das plantas
Para produção das mudas duas sementes de cada cultivar foram semeadas em copos de
plástico com capacidade de 180 mL, contendo o substrato para produção de mudas Plantimax
HT®. Sete dias após a germinação procedeu-se o desbaste das plântulas (Figura 3), permanecendo
uma planta em cada copo. As plantas foram mantidas em casa de vegetação, sendo irrigadas
diariamente.
Figura 3 - Desbaste de pepineiro.
FONTE: Silva, 2008.
45
Obtenção e cultivo do patógeno
O isolado do fungo C. cassiicola foi obtido a partir de plantas de pepineiro naturalmente
infectadas, apresentando sintomas típicos da doença, coletadas em cultivos na periferia de
Manaus-AM. As amostras foram coletadas em sacos de papel e transportadas para o Laboratório
de Microbiologia da Faculdade de Ciências Agrárias da UFAM, onde foi feito o isolamento
indireto do fungo.
Inicialmente as folhas foram analisadas sob lupa e foram confeccionadas lâminas de
microscopia para a confirmação da presença do patógeno nas lesões. Em seguida as folhas foram
lavadas em água corrente e selecionadas àquelas com lesões mais novas, visando reduzir a
presença de microrganismos saprófitas. Com um auxílio de um bisturí foram retirados fragmentos
foliares de 5mm2 da área de transição entre parte lesionada e a sadia, onde se espera que o
patógeno esteja em crescimento ativo. Os fragmentos foram submetidos a uma desinfestação
superficial em álcool 70% durante 30 segundos, hipoclorito de sódio 2% por 30 segundos,
seguida de três lavagens em água destilada esterilizada. O excesso de água foi removido em papel
de filtro esterilizado. Após a desinfestação, em ambiente asséptico (câmara de fluxo laminar
vertical) foram depositados cinco fragmentos equidistantes em placas de Petri contendo meio de
cultura AA (ágar-água 1L de água destilada, 20g Agar), e mantidos em ambiente de laboratório
durante 48 horas. Ao surgirem os primeiros fragmentos de hifas no meio, estes foram repicados
para novas placas contendo meio BDA (batata-dextrose-agar: 200g de batata, 20g de dextrose e
20g de Agar), para a individualização das colônias. Os isolados obtidos foram mantidos em tubos
de ensaio contendo o meio BDA inclinado em incubadora BOD em temperatura de 27 oC até a
montagem dos ensaios.
46
Inoculação das plantas
Por ocasião da inoculação foi selecionado um isolado do patógeno que apresentou melhor
capacidade de esporulação. O isolado foi repicado para placas de Petri contendo meio de cultura
BDA e mantido sob iluminação contínua durante dez dias para induzir a produção de esporos.
Foi utilizada uma suspensão de inóculo na concentração de 104 conídios/mL, obtida a
partir da coleta dos conídios produzidos na placa de Petri, onde foi adicionado 40mL de água
destilada esterilizada e com o auxílio de um pincel de cerdas macias foi feita a remoção dos
conídios para a solução, que em seguida foi coletada em um béquer e a suspensão foi ajustada
para concentração utilizada (104 conídios/mL), por meio do método de contagem em gota.
Foram inoculadas plantas de pepineiro dos dez genótipos, com 30 dias de idade (30 dias
após a germinação). As plantas foram pulverizadas com a suspensão de inóculo, na face adaxial e
abaxial, evitando o escorrimento do inóculo pelas folhas. Em seguida as plantas foram mantidas
em câmara úmida, feitas com sacos de plástico transparentes umedecidos (Figura 4), durante 48
horas. Após este período a câmara úmida foi removida e iniciou a avaliação da severidade da
doença.
Figura 4 - Plantas de pepineiro em câmara úmida após a inoculação em casa de vegetação.
47
O delineamento experimental utilizado foi o inteiramente ao acaso, com dez repetições,
sendo cada unidade experimental constituída por uma planta/copo. A testemunha constou de dez
plantas de cada genótipo avaliado, pulverizadas com água destilada esterilizada.
Avaliação
A avaliação foi feita diariamente por meio da quantificação da severidade da doença nos
diferentes materiais estudados, através da escala de notas descrita por Oliveira et al. (2006), onde:
0 = ausência de sintomas; 1 = < 1% de área foliar afetada (afa), 2 = 1 a 3% afa; 3 = 3 a 6% afa; 4
= 6 a 12% afa; 5 = 12 a 25% afa; 6 = 25 a 50% afa e 7 = >50% afa. Os dados obtidos foram
analisados estatisticamente, utilizando o programa SAEG® versão 9.0 (Sistema de Análises
Estatísticas e Genéticas, Universidade Federal de Viçosa – MG, 2003), construídas a curva de
progresso da doença e calculada a área abaixo da curva de progresso da doença AACPD, de
acordo com a fórmula descrita por Campbell e Madden (1990) e Jesus Junior (2004).
n 1
y yi 1
AACPD i
ti 1 t1
2
i
Onde:
n= número de avaliações
y= intensidade da doença (severidade)
t = tempo quando da avaliação da severidade da doença (24 horas)
(yi + yi + 1) = altura média do retângulo entre os pontos yi e yi + 1
(ti+1 + ti) = diferença da base do retângulo entre os pontos ti+1 e ti.
48
4 RESULTADOS E DISCUSSÃO
A análise da severidade da doença permitiu distinguir quatro grupos entre os dez
genótipos
de
pepino
avaliados
(Tukey
5%),
apresentando
diferentes
níveis
de
resistência/suscetibilidade à C. cassiicola, conforme a Tabela 1.
Genótipos
Severidade (%)
Reação
5,44a
R
Hokushim
15,55b
MR
Soudai (Japonês Híbrido F1)
20,95b
MR
Natsubayashi
22,53b
MR
Verde Comprido (Marketmore 76)
34,85b
MR
General Lee F1
54,60c
MS
Natsu-suzumi
67,33c
MS
Jóia
72,80c
MS
Sprint 440 II
75,40c
MS
Tsuyataro
90,00d
S
Aodai
Tabela 1- Severidade média de genótipos de pepineiro inoculados com Corynespora cassiicola.
Reação: R – resistente, MR – moderadamente resistente, MS – moderadamente suscetível, S – suscetível.
Letras distintas representam diferenças significativas ao nível de 5% de probabilidade pelo teste de Tukey.
A severidade da doença foi maior no híbrido Tsuyataro, diferindo estatisticamente dos
demais genótipos avaliados, com severidade média de 90%. A cultivar Aodai apresentou
severidade média da doença de 5,4%, sendo considerada como mais resistente. Os demais
genótipos apresentaram reações intermediárias à doença, sendo agrupados como moderadamente
resistentes e moderadamente suscetíveis (Tabela 1).
Estes resultados concordam parcialmente com os obtidos por Oliveira et al. (2006), em
estudo avaliando a reação de híbridos de pepino contra C. cassiicola em cultivo protegido no
49
Norte do Paraná, onde o híbrido Tsuyataro foi o mais suscetível aos isolados testados, e o híbrido
Natsubayashi foi o mais resistente. Neste estudo o híbrido Tsuyataro demonstrou ser o de maior
suscetibilidade e o Natsubayashi foi moderadamente resistente. É provável que esta diferença
entre os resultados deste trabalho esteja relacionada com a agressividade do isolado utilizado,
condições ambientais durante a condução dos ensaios e com a gama de genótipos avaliados, já
que no trabalho destes autores somente quatro híbridos foram testados.
A análise de variância da AACPD constatou diferenças significativas (Tukey 5%) entre os
genótipos, demonstrando que há variabilidade na resposta à infecção de C. cassiicola, assim,
como a magnitude da severidade foi suficiente para discriminar os híbridos resistentes e
suscetíveis.
A cultivar Aodai que foi a mais resistente pela análise de severidade, também, foi a que
apresentou menor AACPD (386,88), em contraposição ao híbrido Tsuyataro que foi o mais
suscetível e apresentou maior valor da AACPD (7390,80).
Híbridos
Aodai
AACPD
386,88d
Hokuchin
1244,64c
Soudai
1608,24c
Verde Comprido
1735,68c
Natsubayashi
1950,96c
General Lee F1
2981,52b
Sprint
4555,68b
Jóia
4724,88b
Natsu-suzumi
5401,92b
Tsuyataro
7390,80a
Média
3198,12
Tabela 2 - Área abaixo da curva de progresso da doença dos dez genótipos de pepineiro.
Letras distintas representam diferenças significativas ao nível de 5% de probabilidade pelo teste de Tukey.
100
90
80
70
60
50
40
30
20
10
0
Aodai
General
Hokushin
Soudai
Jóia
1
2
3
4
5
Número de avaliações
Severidade (%)
Severidade (%)
50
100
90
80
70
60
50
40
30
20
10
0
V.C.
Natsubayashi
Natsu-suzumi
Sprint
Tsuyataro
1
A
2
3
4
Número de avaliações
5
B
Gráfico 1 – Curva de progressão da mancha de corinéspora (CPMC) em plantas de pepineiro em casa de
vegetação com dez genótipos.
Conforme demonstrado na curva do progresso da doença (Gráfico 1 A e B), que a partir
da segunda avaliação o híbrido Tsuyataro já apresentava severidade superior a 10% seguido pelo
híbrido Natsu suzumi com 10% de severidade (Gráfico 1 B). Ao final da avaliação o híbrido
Tsuyataro apresentou 90% de severidade (Gráfico 1 B), enquanto que a cultivar Aodai não
chegou a 10% de severidade. A curva de progresso da doença foi menos acentuada para os
genótipos Natsubayashi, Verde Comprido, Soudai, Hokushin e Aodai que foram os menos
suscetíveis à doença (Gráfico 1).
Diversos mecanismos de defesa tanto estrutural como bioquímicos podem estar
envolvidos na manifestação de resistência das plantas aos fitopatógenos (PASCHOLATI e
LEITE, 1995; AGRIOS, 2005). Para o patossistema C. cassiicola e pepineiro a literatura ainda é
escassa, no entanto Vallad et al. (2008), citam que na Europa o controle desta doença em
pepineiro tem sido feito com as plantas resistentes por mais de 15 anos e que plantas resistentes a
este fungo, também, tem sido relatados para soja e tomateiro, sendo que neste último o fungo C.
cassiicola é um importante patógeno, principalmente, na Região Norte do Brasil (LOPES et al.,
51
2005). Boiteux e Reis (2007) relatam que no país não existem cultivares comerciais de tomate
resistentes à mancha alvo, apesar de que fontes de resistência já tenham sido identificadas em
outros países, além disso a literatura é escassa sobre fontes de resistência à mancha alvo. Esta
escassez de informações pode ser explicada pelo fato desta doença, tanto em tomateiro como em
pepineiro ser de importância regional, o que não desperta o interesse por ações de pesquisa
visando o desenvolvimento de cultivares resistentes.
Recentemente a empresa Agristar lançou no mercado nacional o híbrido de pepino
japonês KOUKI F1, como sendo resistente a C. cassiicola. Este híbrido tem sido utilizado por
produtores no município de Iranduba-AM e tem apresentado baixa incidência da doença
(informação pessoal técnico Agrícola Aildo).
Sabe-se que uso de cultivares resistentes constitui o método mais eficiente, racional e
econômico para evitar ou ao menos diminuir os danos causados por fitopatógenos. No entanto é
necessário avaliar continuamente o comportamento de genótipo em relação às doenças, não só
para direcionar estudos futuros de melhoramento visando à obtenção de cultivares resistentes,
mas também para orientar a escolha e a recomendação de cultivares. Além disso, a durabilidade
da resistência das cultivares em campo pode ser comprometida pelo surgimento de raças do
patógeno capazes de vencer a resistência das plantas (CAMARGO, 1995; AGRIOS, 2005), sendo
necessário o desenvolvimento de novas cultivares.
Embora o melhoramento de plantas tente explorar a variabilidade genética existente
dentro de cada espécie, esta tem se tornado limitado em alguns casos, com o rápido aparecimento
de patógenos e seus variantes. Recursos genéticos adicionais têm sido requeridos para preencher
as necessidades de geração de variabilidade, sendo esta imprescindível no combate às doenças de
plantas (PRESTES, 1995).
52
Conforme o comportamento dos pepineiros testados em relação à C. cassiicola, é possível
sugerir que o cultivo dos genótipos Tsuyataro, Sprint 440II, Natsu suzumi e Jóia sejam evitados
em locais onde exista histórico da ocorrência de C. cassiicola no Amazonas, devido à
suscetibilidade observada.
53
5 CONCLUSÕES
Os dez genótipos de pepineiro avaliados apresentaram variabilidade quanto à resistência e
suscetibilidade à mancha de corinéspora.
O genótipo Aodai foi o mais resistente à doença.
O genótipo Tsuyataro foi suscetível ao patógeno.
54
Capítulo 2
EFEITO DE INDUTORES QUÍMICOS DE RESISTÊNCIA NA
SEVERIDADE DA MANCHA DE CORINÉSPORA (Corynespora cassiicola)
EM PEPINEIRO
1 INTRODUÇÃO
O controle químico de doenças de plantas é uma das medidas mais empregadas na
agricultura por prevenir infecção de patógenos que podem se instalar na cultura e ou erradicar
infecções já instaladas nos tecidos da planta hospedeira.
Apesar da diversidade de fungicidas disponíveis no mercado, o produtor agrícola ainda
enfrenta dificuldade no controle de doenças, especialmente quando as condições climáticas
tornam-se extremamente favoráveis aos patógenos, reduzindo assim o resultado potencial de
controle (CASTRO et al., 2007).
De modo geral as plantas se defendem do ataque de patógeno, utilizando mecanismos
estruturais de defesa, os quais atuam como barreira física e inibem a entrada e disseminação do
patógeno no interior do hospedeiro, e pelo uso de mecanismos bioquímicos, os quais reagem nas
células e tecidos da planta, produzindo substâncias que são tóxicas para o patógeno ou inibem seu
crescimento no hospedeiro (AGRIOS, 2005). Apesar da contribuição dos mecanismos estruturais
na defesa da planta ser significativa, os mecanismos bioquímicos, sem dúvida, representam a via
mais importante de resistência (LIMA et al., 2005).
55
Nos últimos anos o uso de indutores de resistência à patógenos vem sendo estudado nos
mais variados patossistemas e envolve múltiplos eventos bioquímicos e fisiológicos compondo
um mecanismo de resistência induzida contra a infecção. Diversos mecanismos podem ser
ativados durante o fenômeno de indução de resistência (CAVALCANTI e RESENDE, 2005). A
planta procura ativar todas as rotas de defesa para evitar o estabelecimento de relações
parasitárias e o patógeno tenta anular o efeito inibitório gerado (GÓMEZ-GOMEZ, 2004).
Costuma-se diferenciar o tipo de resistência envolvido com cada via. Assim, tem-se
assumido que a RSA envolve o acúmulo de PR-proteínas (proteínas relacionadas à patogênese)
como mecanismos induzidos de defesa da planta, sendo sua indução salicilato dependente,
podendo resultar em alterações visuais (necrose, por exemplo) na planta que sofreu indução e é
geralmente induzida por patógenos ou ativadores químicos. No caso da RSI, não há acúmulo de
PR-proteínas, a planta que sofreu indução não exibe alterações, o agente indutor é usualmente um
microrganismo não-patogênico e sua indução não é salicilato-dependente, havendo outra rota de
sinalização associada à jasmonatos e etileno (BONALDO et al., 2005).
Diante do potencial que os indutores químicos apresentam para o controle de doenças de
plantas, é de grande interesse que estes produtos sejam avaliados nas condições regionais, como
uma medida alternativa para o controle da mancha de corinéspora em pepineiro.
56
2 OBJETIVOS
Objetivo geral:
- Avaliar o efeito de indutores químicos de resistência a doenças de plantas no desenvolvimento
de Corynespora cassiicola, in vitro e in vitro em plantas de pepineiro.
Objetivos específicos:
- Verificar o efeito de acibenzolar-s-metil, produto a base de extratos cítricos e silicato de
potássio no crescimento micelial e na esporulação de Corynespora cassiicola in vitro;
- Avaliar o efeito de indutores químicos de resistência, em diferentes dosagens, sobre a
severidade da mancha de corinéspora em genótipos de pepineiro.
57
3 MATERIAL E MÉTODOS
Determinação do efeito dos indutores de resistência no crescimento micelial de
Corynespora cassiicola, in vitro
Este ensaio foi realizado visando verificar o efeito dos indutores de resistência à doenças
de plantas no desenvolvimento do patógeno C. cassiicola, como um pré-requisito para a seleção
de indutores químicos de resistência à doenças de plantas que, de acordo com Steiner e
Schönbeck (1995), o agente indutor não deve ter efeito tóxico sobre o patógeno desafiante.
Foram utilizados os indutores Ecolife®: a) que é um produto constituído de bioflavonóides
cítricos, fitoalexinas cítricas e polifenóis, ácido ascórbico, ácido lático, ácido cítrico e glicerina
vegetal; fabricado pela empresa Quinabra - Química Natural Brasileiro LTDA); b) AcibenzolarS-Metil o qual trata-se do produto comercial BION®, fabricado pela empresa Syngenta; c) silicato
de Potássio, produto comercial chamado Fertisil® – constituído por óxido de potássio e óxido de
silício solúvel, fabricado por INEOS Sílicas Ltda.
Para cada produto foram testadas duas doses: Ecolife® nas doses de 1,0 e 2,5 mL/500 de
meio de cultura; BION® nas doses 0,050 e 0,025g/500 e Fertisil® nas doses de 0,025 e 0,050
g/500. Estas foram incorporadas ao meio de cultura BDA (200g de batata, 20g de dextrose, 20g
de agar) fundente (temperatura de 37 ºC). A verificação do pH do meio foi feita após a adição dos
indutores, utilizando-se tiras indicadoras de pH (VETEC), em seguida o meio foi vertido em
placas de Petri de nove centímetro de diâmetro.
Os isolados do fungo utilizado foram obtidos conforme descrito no item 3.2, do capítulo 1
deste trabalho. Antecipadamente, os isolados foram mantidos em tubos de ensaio com BDA,
inclinado, os quais foram repicados para placas de Petri, contendo o mesmo meio de cultura e
deixados sob iluminação contínua durante dez dias, visando estimular a produção de esporos. Foi
58
selecionado para o ensaio in vitro, aquele isolado que apresentou melhor capacidade de
esporulação.
A partir das colônias com dez dias de idade, foram retirados discos de meio de cultura
com 0,5 cm de diâmetro e depositados no centro das placas de Petri contendo BDA acrescidos
dos indutores. As placas foram mantidas em incubadora BOD, em temperatura de 27 ºC, durante
todo o período de avaliação.
O delineamento experimental foi inteiramente ao acaso, com sete tratamentos e dez
repetições, sendo cada placa de Petri uma unidade experimental. A testemunha constou do cultivo
do fungo em placas contendo somente o meio BDA.
As avaliações foram realizadas em intervalos de 24 horas, por meio da medição do
diâmetro das colônias, (Figura 5), em sentidos opostos, até que o crescimento da colônia de um
dos tratamentos atingisse a borda da placa.
Figura 5 - Medição do diâmetro das colônias de Corynespora cassiicola.
Com os dados obtidos foi calculado o diâmetro das colônias, através da média entre as
medidas tomadas no sentido longitudinal e transversal da colônia. Estes valores foram usados
para o cálculo do índice de crescimento micelial (ICM) de acordo com a fórmula descrita por
(PERES et al., 2003).
59
ICM =
C
C1 C 2
+
+ ... + N
N1 N 2
NN
Onde:
ICM = Índice de crescimento micelial.
C1 = Crescimento micelial no primeiro dia.
N1 = Número de dias.
Os dados obtidos foram submetidos à análise de variância e as médias comparadas pelo
teste de Tukey ao nível de 5% de probabilidade utilizando-se o programa de análises estatísticas
SAEG 9.0.
Determinação do efeito dos indutores de resistência na esporulação de
Corynespora cassiicola, in vitro
Imediatamente após a avaliação do crescimento micelial foi iniciada a quantificação da
produção de esporos do fungo, nos diferentes tratamentos, utilizando a técnica de contagem em
gota; a qual consistiu no preparo de uma suspensão de conídios, obtida adicionando-se 20 mL de
água destilada em cada placa, e com auxílio de um pincel de cerdas macias foram realizados
movimentos suaves na colônia para liberação dos conídios dos conidióforos, como mostra a
Figura 6.
60
Figura 6 - Preparo de suspensão de esporos de Corynespora cassiicola.
A suspensão foi coletada em um béquer e com o auxílio de uma micropipeta foram retidas
três alíquotas de 10µl e depositadas em lâminas para microscopia, onde foram contados todos os
conídios presentes em cada gota, em microscópio de luz sob objetiva de 40X. Após a contagem
dos conídios foi calculada a média do número de esporos nas três gotas determinando a
concentração de esporos na suspensão, através de regra de três simples.
Os dados obtidos foram submetidos à análise de variância e as médias comparadas pelo
teste de Tukey, ao nível de 5% de probabilidade; por meio do programa de análises estatísticas
SAEG 9.0.
Efeito dos indutores de resistência na severidade da mancha de corinéspora
(Corynespora cassiicola) em pepineiro
Os ensaios foram conduzidos em casa de vegetação, no Setor de Produção da Faculdade
de Ciência Agrárias da UFAM no período de março a outubro de 2008. Foram utilizadas
sementes de pepino Aodai e Tsuyataro, consideradas respectivamente, resistente e suscetível ao
patógeno, de acordo com os resultados obtidos no capítulo 1, deste trabalho.
61
Preparo das mudas
As sementes foram semeadas em bandejas de poliestireno expandida de 128 células, duas
por células, contendo substrato para produção de mudas (Plantimax HT®). Seis dias após a
germinação realizou-se o desbaste, permanecendo uma planta por célula, e no dia seguinte foram
transplantadas para copos de 300 mL contendo terriço previamente autoclavado e corrigido de
acordo com análise de solo e o recomendado para a cultura. As características químicas do solo
utilizado apresentaram pH (H2O) 5,33; Al 1,1 cmol (c)/Kg; H+Al 15,84 cmol (c)/Kg; Ca 1,6
cmol (c)/Kg; Mg 0,4 cmol (c)/Kg; P 3,0 mg/Kg; K 13,4 mg/Kg; M.O. 48,78 g/Kg.
Aplicação dos indutores
Os indutores químicos de resistência a doenças foram aplicados em plantas de pepineiro
com treze dias de idade. Foram realizados dois experimentos separadamente, utilizando
diferentes doses dos indutores. No primeiro experimento os produtos foram aplicados nas doses
1,0 e 2,5 mL de Ecolife®/500 mL de água destilada; 0,025 e 0,050 g de BION®/500 mL de água e
4,0 e 7,5 g Fertisil® /500 mL de água. No segundo experimento foram testadas as doses de 3,0 e
7,5 mL de Ecolife®/500mL de água; 0,075 e 0,15g de BION®/500mL de água; e 12,0 e 22,5g de
Fertisil®/500mL de água.
Inicialmente as plantas foram tratadas com a solução dos indutores, para a ativação de
mecanismos de defesa. Antes da aplicação o pH da calda foi verificado, usando-se tiras
indicadoras de pH (VETEC). A aplicação dos produtos foi feita por pulverização nas plantas com
a solução dos indutores nas diferentes dosagens, utilizando um pulverizador manual com
capacidade para 2L.
62
Inoculação com o patógeno
A inoculação do desafiante (C. cassiicola) foi realizada 48 horas após a aplicação dos
tratamentos com os possíveis indutores de resistência. Para isso o isolado do patógeno foi
repicado para placas de Petri contendo meio de cultura BDA e mantido sob iluminação contínua
durante dez dias para induzir a produção de esporos.
A inoculação foi feita utilizando uma suspensão de inóculo na concentração de 104
conídios/mL, obtida a partir da coleta dos conídios produzidos na placa de Petri, onde foram
adicionados 40 mL de água destilada esterilizada e com o auxílio de um pincel de cerdas macias
foi feita a remoção dos conídios para a solução, que em seguida foi coletada em um béquer e a
suspensão foi ajustada para concentração utilizada de 104 conídios/mL, pelo método de contagem
em gota, descrito no item 5.2.
A suspensão de conídios foi inoculada por pulverização, na superfície adaxial das duas
primeiras folhas definitivas e completamente expandidas de cada planta, em um volume de 2mL
de inóculo por planta. Em seguida as plantas foram mantidas em câmara úmida, feita com saco
plástico transparente umedecido, durante 48 horas. Após este período, foi removido o saco
plástico e iniciada a fase de avaliação da doença.
O delineamento experimental foi inteiramente ao acaso, em esquema fatorial 8x3x2 com
cinto repetições, cada repetição correspondeu a uma planta. Os fatores constituídos por oito
tratamentos (seis doses dos indutores e as duas testemunha), três indutores e dois genótipos da
planta. A testemunha constou de plantas inoculadas com o patógeno e não tratadas com os
indutores e de plantas não inoculadas e tratadas com água destilada e esterilizada.
63
Avaliação
As avaliações foram realizadas em dias alternados até o décimo dia após a inoculação,
observando-se o surgimento de sintomas da doença, e os seguintes componentes de resistência:
número de lesões por cm2 de área foliar, tamanho médio de lesões, severidade e período de
incubação.
Para o número de lesões foi adaptado um molde com área conhecida (1 cm2), conforme
descrito por Castro (1997), que colocado sobre cada folha em três pontos equidistantes, registrouse o número de lesões/ cm2 de área foliar (Figura 7A).
O diâmetro das lesões foi avaliado com auxílio de uma régua melimetrada, procedendo à
medição das quatro maiores lesões da folha (Figura 7B).
Figura 7 – Avaliação do número de lesões por cm2 de área foliar (A) e tamanho médio de lesões (B) em
folha de pepineiro.
A severidade foi avaliada de acordo com a escala de notas descrita por Oliveira et al.
(2006), com atribuição de notas: 0 = Ausência de sintomas, 1 = < 1% de área foliar afetada, 2 = 1
a 3% de afa , 3 = 3,1 a 6% de afa, 4 = 6,1 a 12% de afa , 5 = 12,1 a 25% de afa , 6 = 25,1 a 50%
de afa e 7 = > 50,1% de afa .
O período de incubação (tempo decorrido desde a inoculação até o aparecimento dos
primeiros sintomas) foi registrado diariamente, sendo o número de lesões (de 1 a 3 mm de
diâmetro) por folha até que todas estivessem lesionadas.
64
Para cada tratamento foram utilizadas cinco plantas. O delineamento experimental foi
inteiramente casualizado em esquema fatorial 3x2x2, com cinco repetições. Cada repetição
correspondeu a uma planta. Os fatores estudados foram: três indutores, duas cultivares e duas
doses de cada indutor. Os dados foram submetidos à análise de variância e as médias comparadas
pelo teste de Tukey, ao nível de 5% de probabilidade.
65
4 RESULTADOS E DISCUSSÃO
Determinação do efeito dos indutores de resistência no crescimento
micelial e produção de esporos de Corynespora cassiicola in vitro
O crescimento micelial apresentou diferença significativa nos tratamentos quando
comparado com a testemunha (Tabela 3).
Tratamentos
Testemunha BDA
Bion 0.025 g/500
Bion 0.050 g/500
Ecolife 1 mL/500
Ecolife 2,5 mL/500
Fertisil 0,025 g/500
Fertisil 0,050 g/500
I.C.M.
6.93a
5.55b
5.30b
3.89c
2.83d
0.00e
0.00e
Nº de conídios
172.20a
79.63b
50.43bc
40.90bc
20.26bc
0.00d
0.00d
Tabela 3 - Efeito de acibenzolar-s-metil, produto a base de extrato cítrico e silicato de potássio no índice
de crescimento micelial (I.C.M.) e número de conídios in vitro de Corynespora cassiicola.
Médias seguidas da mesma letra nas colunas não diferem entre si pelo teste de Tukey a 5% de
probabilidade.
O silicato de potássio (Fertisil®) incorporado ao meio de cultura BDA inibiu
completamente o crescimento micelial do fungo na concentração de 0.025 e 0.05g/500, diferindo
significativamente dos demais tratamentos. Esse comportamento demonstra que o silicato de
potássio pode apresentar ação direta sobre o crescimento micelial de C. cassiicola, in vitro
(Tabela 3).
Nas diferentes dosagens do Acibenzolar-S-metil e do silicato de potássio não diferiram
entre si. Porém entre as dosagens do indutor Ecolife® houve diferença, e quanto maior a
concentração do indutor menor o diâmetro da colônia, inferindo-se que o fungo pode ser inibido
sob diferentes dosagens e comportar a diferentes níveis de concentrações do indutor em
condições de substrato do hospedeiro durante o processo de patogênese (Tabela 3).
66
Considerando o efeito in vitro dos indutores testados sobre a germinação de conídios de
C. cassiicola, os tratamentos foram inferiores à testemunha, diferindo estatisticamente em a todas
as dosagens empregadas.
Pelo fato do silicato de potássio ter inibido completamente o desenvolvimento micelial,
consequentemente, não houve germinação de conídios, diferenciando estatisticamente de todos os
demais tratamentos inclusive à testemunha (Tabela 3). Pode ser que essa inibição seja devido às
condições desfavoráveis ao fungo no ensaio in vitro, pela qual esteve em contato direto com o
indutor, o que talvez não se repetisse em casa de vegetação ou em campo.
Tanto o acibenzolar-s-metil quanto o produto a base de extrato cítrico não diferiram
estatisticamente entre si, e na maior dosagem testada desfavoreceu a germinação dos conídios
(Tabela 3). Resultados semelhantes foram relatados por Querino et al. (2005), que constataram
efeito inibidor do acibenzolar-s-metil sobre a germinação de conídios de Fusarium oxusporum
f.sp. cubense à medida que aumentava a dosagem do indutor in vitro. Nojosa et al., (2009), ao
aplicar 0,02 e 0,20 g/L de acibenzolar-s-metil, inibiu 9,40 e 56,23%, respectivamente, o
crescimento micelial de Phoma costarricensis.
Outros autores estudando o efeito in vitro de Ecolife® sobre o crescimento radial de
Xanthomonas vesicatoria causadora da mancha bacteriana do tomateiro, verificaram que o
indutor inibiu significativamente o crescimento da bactéria em 13,8 ± 0,83mm (Cavalcante et al.,
2006).
Também, Amaral et al. (2008), em seus estudos verificaram que o crescimento micelial de
Cercospora coffeicola foi inversamente proporcional ao aumento das doses do silicato de
potássio.
67
Efeito dos indutores de resistência na severidade da mancha de corinéspora
(Corynespora cassiicola) em pepineiro
No primeiro experimento utilizando as doses 0.025 e 0.050g (Bion ®), 1.0 e 2.5ml
(Ecolife®) e 4.0 e 7.5g (Fertisil®), a severidade da mancha de corinéspora foi significativamente
diferente, de acordo com o teste de Tukey (5%) entre os genótipos Aodai e Tsuyataro em todos
os tratamentos. No genótipo Tsuyataro a nota da severidade variou entre 5,9 na testemunha e 6,7
nos tratamentos com Bion® dose 0,025g e Ecolife® dose 1mL/500mL de água, conforme a escala
de Oliveira et al., (2006). Em Aodai a nota da severidade variou entre 5,8 no tratamento com
Bion® 0,050g a 3,0 no tratamento com Ecolife® 7,5g/500mL (Tabela 4).
Quanto ao efeito dos indutores no híbrido Tsuyataro, foi observado que a severidade em
todos os tratamentos houve um aumento da doença em relação à testemunha, apesar de não
diferirem estatisticamente (Tukey 5%).
No genótipo Aodai, os tratamentos com Bion® nas duas dosagens testadas, resultaram no
aumento da severidade da doença em comparação com a testemunha. Nos tratamentos Ecolife® e
Fertisil® apresentaram menor severidade da doença, porém não diferindo da testemunha pelo
teste Tukey 5%,
Quanto ao número de lesões, houve diferença significativa (Tukey 5%) entre os
genótipos, sendo que Tsuyataro o número de lesões foi maior que Aodai. No entanto, ao avaliar o
efeito dos tratamentos nos genótipos individualmente, foi observado que não houve efeito
significativo (Tukey 5%) dos indutores nas dosagens testadas, no número de lesões no genótipo
Aodai. Apesar dos tratamentos não diferirem entre si, as plantas (Aodai) tratadas com o indutor
Bion® nas duas doses, apresentaram maior número de lesões que os demais tratamentos.
68
Tratamentos
Severidade
Testemunha
BDA
Bion®
0.025g
Bion®
0.050g
Ecolife®
1.0ml
Ecolife®
2.5ml
Fertisil®
4.0g
Fertisil®
7.5g
4.10c
Aodai
Número
de lesões
0.69a
Tsuyataro
Tamanho Severidade Número
Tamanho
das lesões
das lesões das lesões
0.41a
5.90a
6.66a
0.34a
4.90b
2.03a
0.49a
6.70a
9.25b
0.49a
5.80a
3.83a
0.57a
6.50a
8.13b
0.54a
3.00c
0.67a
0.48a
6.70a
8.26b
0.41a
3.60c
0.26a
0.52a
6.60a
6.86a
0.40a
3.80c
0.96a
0.38a
6.50a
6.46a
0.41a
3.50c
0.39ª
0.33a
6.60a
11.19b
0.39a
Tabela 4 - Efeito dos indutores químicos de resistência na severidade, número e tamanho das lesões
causadas por Corynespora cassiicola em pepineiro.
Médias seguidas da mesma letra na coluna não diferem entre si pelo teste de Tukey a 5% de
probabilidade.
Não houve diferença estatística quanto ao tamanho de lesões entre os genótipos e nem
entre os tratamentos, sugerindo que este parâmetro não sofreu efeito do material vegetal nem dos
indutores químicos testados.
Com os dados da severidade da doença foram construídas as curvas de progresso da
doença, que permite analisar o desenvolvimento da doença no tempo (Gráfico 2 A e B).
69
7
TEST
Severidade
6
5
4
3
2
1
0
1
2
3
4
5
Dias de avaliação
A
TEST
8
7
6
Severidade
BION
0.025
BION
0.05
ECO
1.00
ECO
2.50
FERT
4.00
FERT
7.50
5
4
3
2
1
0
1
2
3
4
5
BION
0.025
BION
0.05
ECO
1.00
ECO
2.50
FERT
4.00
FERT
7.50
Dias de avaliação
B
Gráfico 2. Curva de progresso da doença da mancha de corinéspora (Corynespora cassiicola) nos
genótipos Aodai (A) e Tsuyataro (B) de pepineiro no primeiro experimento.
Comparando os gráficos da curva de progresso da doença no genótipo Aodai (Gráfico 2A)
e Tsuyataro (Gráfico 2B) é possível observar que o progresso da doença inicialmente foi mais
lento em Aodai, em todos os tratamentos.
Os valores da AACPD (área abaixo da curva de progresso da doença) semelhante ao
observado quanto à severidade, apresentaram diferença significativa entre os genótipos, tendo os
valores mais elevados registrados no híbrido Tsuyataro (Tabela 5). Estes valores possibilitam
discriminar o efeito dos tratamentos na quantidade de doença observada nos hospedeiros.
Em ambos os genótipos, os tratamentos com Bion® resultaram nos maiores valores de
AACPD, sugerindo um efeito favorável deste produto ao desenvolvimento da mancha de
70
corinéspora em pepineiro. Nos demais tratamentos em Aodai, apesar de ser observado uma
redução nos valores da AACPD em ambos os genótipos, estes não diferiram estatisticamente da
testemunha, revelando que os indutores químicos de resistência Ecolife® e Fertisil® não
apresentaram efeito na redução da severidade da doença em pepineiro nas doses testadas.
No híbrido Tsuyataro foi observado que nas plantas tratadas com os indutores a doença
ocorreu com severidade maior que a observada na testemunha, sugerindo um efeito favorável ao
desenvolvimento da doença, além da suscetibilidade natural deste genótipo ao patógeno.
AACPD
Tratamentos
Testemunha BDA
Bion® 0.025g
Bion® 0.050g
Ecolife® 1.0ml
Ecolife® 2.5ml
Fertisil® 4.0g
Fertisil® 7.5g
Aodai
138.60a
172.80b
207.60b
103.20a
134.40a
131.40a
109.80a
Tsuyataro
219.60a
260.40b
258.60b
248.40b
236.40b
240.60b
253.80b
Tabela 5 - Área abaixo da curva de progresso da doença (AACPD) da mancha de corinéspora
(Corynespora cassiicola) em pepineiro tratados com indutores químicos de resistência.
Médias seguidas da mesma letra nas colunas não diferem entre si pelo teste de Tukey a 5% de
probabilidade.
No segundo experimento, utilizando as doses de 4,0 e 7,5mL de Ecolife® em 500mL de
água destilada, 2,50 e 3,00g de Bion® em 500mL de água e 12 e 22,5g de Fertisil® em 500mL de
água, de forma semelhante ao que foi observado no experimento anterior, houve diferença
estatística quanto à severidade da doença entre os dois genótipos, sendo a maior severidade
observada no genótipo Tsuyataro (Tabela 6 e Figura 8).
71
1
2
3
8
4
5
6
7
15
11
10
12
13
14
16
9
Figura 8 – Reação dos genótipos de pepineiro à mancha de corinéspora com aplicação de indutores de
resistência. 1- testemunha sem indutor e patógeno; 2 - testemunha sem indutor e com patógeno; 3 Fertisil® 22,50g; 4 - Fertisil® 12,00g; 5 - Ecolife® 7,50ml; 6 - Ecolife® 4,00ml; 7 - Bion® 3.00g; 8 - Bion®
2.50g; 9 - testemunha sem indutor e patógeno; 10 - testemunha sem indutor e com patógeno; 11 - Fertisil®
22,50g; 12 - Fertisil® 12,00g; 13 - Ecolife® 7,50ml; 14 - Ecolife® 4,00ml; 15 - Bion® 3.00g; 16 - Bion®
2.50g.
Quanto ao efeito dos indutores no genótipo Aodai a severidade da doença foi maior que
na testemunha em todos os tratamentos. Em Tsuyataro nos tratamentos com Fertisil®, a
severidade da doença foi menor que na testemunha apesar de não ter diferido estatisticamente
(Tabela 6).
Tratamentos
Aodai
Testemunha C/P
Bion® 2.50g
Bion® 3.00g
Ecolife® 4,00ml
Ecolife® 7,50ml
Fertisil® 12,00g
Fertisil® 22,50g
3,70b
6,00a
6,60a
4,50b
6,30a
5,00a
5,00a
Tsuyataro
Severidade
6,90a
7,00a
7,00a
7,00a
6,90a
6,60a
5,60a
Tabela 6 - Efeito dos indutores à severidade da doença em pepineiro.
Médias seguidas da mesma letra nas colunas não diferem entre si pelo teste de Tukey a 5% de
probabilidade.
72
Com relação à curva de progresso da doença neste experimento (Gráfico 3), a doença
comportou-se de forma semelhante ao observado anteriormente, tendo um aumento acelerado nas
primeiras 48 horas após a aplicação dos indutores, continuando a aumentar nos próximos dias,
porém, em um menor progresso da doença.
7
TEST C/P
Severidade (%)
6
BION 0.075
5
BION 0.150
4
ECO 3.000
3
ECO 7.500
2
FERT 12.00
1
FERT 22.50
0
1
2
3
4
5
Dias de avaliação
8
TEST C/P
7
Severidade (%)
A
BION 0.075
6
5
BION 0.150
4
ECO 3.000
3
ECO 7.500
2
FERT 12.00
1
FERT 22.50
0
1
2
3
Dias de avaliação
4
5
B
Gráfico 3. Curva de progresso da doença da mancha de corinéspora (Corynespora cassiicola) nos
genótipos Aodai (A) e Tsuyataro (B) de pepineiro no segundo experimento.
A AACPD no segundo experimento, utilizando as doses 2.50 e 3.0g (Bion®), 4.0 e 7.5ml
(Ecolife®) e 12.0 e 22.5g (Fertisil®), foi significativamente diferente entre os genótipos Aodai e
Tsuyataro. Apesar de não haver diferença significativa com a testemunha, as doses do indutor
Fertisil® a 22,5g e 12,0g em Aodai e Tsuyataro, respectivamente, apresentaram menor AACPD
(Tabela 7).
73
Tratamentos
Aodai
Tsuyataro
AACPD
Testemunha C/P
Bion® 2.50g
Bion® 3.00g
Ecolife® 4,00ml
Ecolife® 7,50ml
Fertisil® 12,00g
Fertisil® 22,50g
873,60 ab
924,00 a
681,60 ab
895,20 ab
722,40 ab
739,20 ab
511,20 b
1034,40 ab
1087,20 a
1005,60 ab
1034,40 ab
1017,60 ab
832,80 b
1010,40 ab
Tabela 7 - Área abaixo da curva de progresso da doença (AACPD) da mancha de corinéspora
(Corynespora cassiicola) em pepineiro tratados com indutores químicos de resistência.
Médias seguidas da mesma letra nas colunas não diferem entre si pelo teste de Tukey a 5% de
probabilidade.
Em relação ao período de incubação (PI) somente o Fertisil® nas dosagens 4 e 7,5g
(Aodai) do primeiro experimento apresentaram PI de 48 e 72 horas, respectivamente, enquanto
que na testemunha o PI foi de 24 horas. Nos demais tratamentos, tanto do primeiro, quanto do
segundo experimento, o período de incubação ficou em torno de 24 horas, demonstrando não
haver efeito dos indutores neste parâmetro.
A diferença na severidade da doença observada entre os genótipos avaliados pode estar
relacionada com fatores intrínsecos de cada material quanto aos mecanismos de defesa que
possuem contra o patógeno, conforme apresentado no capítulo 1, quando foi avaliada a
resistência de dez genótipos de pepineiro à C. cassiicola.
Nos dois experimentos realizados com os indutores em diferentes dosagens foi
demonstrado que não houve efeito dos tratamentos na redução da severidade da doença. Em
alguns tratamentos foi observado o aumento da doença em comparação com a testemunha nos
dois genótipos de pepineiro avaliados. Tanto Aodai quanto Tsuyataro nos dois experimentos
apresentaram fitotoxidez. Possivelmente as substâncias químicas que compõem o extrato de
74
biomassa cítrica (Ecolife®) justifiquem fitotoxidez observado nas plântulas de pepineiro tratadas
com este indutor.
Apesar de existirem inúmeros relatos na literatura sobre o efeito de indutores químicos de
resistência a doença como ativadores de resistência sistêmica em diversos patossistemas, no caso
de C. cassiicola em pepineiro utilizando os produtos Ecolife®, Fertisil® e Bion® não apresentaram
efetividade contra a doença.
Resultados semelhantes foram relatados por Lin et al. (2009), ao avaliarem a eficiência de
ASM no controle da antracnose (Colletotrichum orbiculare), da sarna (Cladosporium
cucumerinun) e da mancha de corinespora em pepineiro, onde o ASM foi eficiente no controle da
antracnose e da sarna, porém falhou em induzir resistência contra C. cassiicola, indicando que
este produto pode induzir resistência contra alguns, mas não para todas as doenças de pepineiro.
Apesar de a resistência sistêmica ser um tipo resistência reconhecidamente de amplo
espectro (GÖRLACH et al., 1996), os mecanismos de defesa das plantas podem variar de acordo
com a interação patógeno-hospedeiro (Agrios, 2005), e com o potencial genético das cultivares,
podendo refletir em uma variedade de respostas aos agentes indutores.
Além disso, o fungo C. cassiicola é um patógeno necrotrófico que possui a capacidade de
sintetizar toxinas hospedeiro-específicas, conforme Otani et al., (1997) e Kurt (2004), que podem
causar danos celulares ao hospedeiro, como clorose durante o processo de patogênese, e ainda
possuir a capacidade de produzir alterações na membrana plasmática vegetal, como reduzir a
permeabilidade ou alterar sítios de receptores ou de ligação com componentes sinalizadores ou
ativadores de respostas de defesa do hospedeiro (OKA et al., 2006). Estas alterações celulares
induzidas pelo patógeno podem explicar a ineficácia dos indutores de resistência contra a doença,
caso a morte celular ocorra antes a ativação das defesas vegetais.
75
O mesmo pode ocorrer com silicato de potássio e Ecolife® que têm sido relatados como
eficientes para o controle de doenças em inúmeros patossistemas, no entanto no caso de pepineiro
x C. cassiicola não foram eficientes. Aquino (2006) avaliou o efeito da aplicação foliar de silicato
de potássio para o controle da mancha de ramulária (Ramularia gossypii) em algodoeiro, foi
observado que o produto não foi eficiente para o controle da doença, sendo menos efetivo que os
fungicidas utilizados para a cultura.
A ativação de uma resposta de defesa da planta devido ao reconhecimento do patógeno é
regulada por uma interação altamente específica, ou seja, ocorre a interação entre os produtos do
gene de avirulência do patógeno com o produto do gene de resistência da planta (DANGL e
JONES, 2001). É possível que neste trabalho, a utilização dos indutores de resistência nas
condições destes experimentos não foram capazes induzir respostas de defesa em tempo hábil
para restringir o desenvolvimento do patógeno, ou ainda que o aumento da suscetibilidade
observada nos tratamentos seja reflexo da alteração no metabolismo das plantas (LABANCA,
2002) favorecendo o desenvolvimento da doença.
Novas pesquisas com o patossistema pepino x C. cassiicola poderão auxiliar na
compreensão dos resultados, como novos testes com outros intervalos de tempo entre a aplicação
dos indutores de resistência e inoculação do patógeno, trazendo com isso novas informações
quanto à eficiência de acibenzolar-s-metil, produto á base de extratos cítricos e silicato de
potássio no controle de C. cassiicola em C. sativus. A princípio, todas as plantas são capazes de
expressar genes de resistência, desde que recebam o estímulo adequado (TUZUM, 2001).
Também, faz-se necessário a realização de estudos similares com plantas adultas no campo, uma
vez que os ensaios foram realizados com plântulas em casa de vegetação.
76
5 CONCLUSÕES
Corynespora cassiicola foi altamente sensível ao silicato de potássio nas concentrações de
0,025 e 0,050g/500, in vitro, o qual apresentou efeito fungitóxico.
A germinação dos conídios foi proporcional ao crescimento micelial nos tratamentos
utilizados acibenzolar-S-metil e composto a base de extrato cítrico (Ecolife®). Quanto maior o
crescimento micelial, maior a quantidade de conídios.
Os indutores acibenzolar-s-metil (Bion®), silicato de potássio (Fertisil®) e compostos a
base de extrato cítrico (Ecolife®) nas diferentes dosagens não foram eficientes para reduzir a
severidade de mancha de corinéspora nos genótipos Aodai e Tsuyataro em casa de vegetação.
77
REFERÊNCIAS
ABREU, S.M. Evidenciação da resistência de progênies de Catimor a Hemileia vastatrix. In:
Anais, 11 Congresso Brasileiro de Pesquisas Cafeeiras (CBPC). Rio de Janeiro. 1984.
AGRIOS, G.N. Plant Pathology. 4 ed. San Diego: Academic Press, 1997. 635p.
AGRIOS, G.N. Plant Pathology. 5 ed. Elsevier Academic Press, 2005. 922p.
ALSTRÖM, S. Induction of disease resistance in common bean susceptible to halo blight
bacterial pathogen after seed bacterization with rhizosphere Pseudomomas. Journal General
Applied Microbiology, 37: 495-501, 1991.
AMARAL, D.R.; RESENDE, M.L.V.; RIBEIRO JÚNIOR, P.M.; BOREL, J.C.; MAC LEOD,
R.E.O.; PÁDUA, M.A. Silicato de potássio na proteção do cafeeiro contra Cercospora coffeicola.
Tropical Plant Pathology. Vol. 33, n. 6 (November - December 2008). – Brasília: Brazilian
Phytopathological Society, 2008 – v.: il.; 28 cm.
AQUINO, L.A. Escala diagramática e controle alternativo da mancha de ramularia do
algodoeiro. 2006. 44f. Dissertação (Mestrado em Fitotecnia) – Departamento de Fitotenia,
Universidade Federal de Viçosa, Viçosa.
ARAGÃO, S.P. et al. Diagnóstico dos Processos de Produção de Hortaliças. Ed. Outubro,
2003.
ARAÚJO, J.S.P.; GONÇALVES, K.S.; OLIVEIRA, B.C.; RIBEIRO, R.; POLIDORO, J.C.
Efeito do acibenzolar-S-methyl sobre murcha bacteriana do tomateiro. Horticultura Brasileira,
23(1):5-8, 2005.
BALADIN, R.S. Fitopatologia. Apostila. 2002. 65p.
BENHAMOU, N., KLOEPPER, J.W.; TUZUN, S. Induction of resistance against Fusarium wilt
of tomato by combination of chitosan with an endophytic bacterial strain: ultrastructure and
cytochemistry of the host response. Plant 204:153-168. 1998.
78
BETTENCOURT, A.J.; RODRIGUES JUNIOR, C.J. Principles and practices of coffee breeding
for resistance to rust and other diseases. In: Clarke, R.J.; Macrae, R. (Eds.) Coffee Agronomy.
London. Elsevier. 1988. pp. 199-234.
BOITEUX, L.; REIS, A. Mancha-alvo (Corynespora cassiicola): Potencial problema para a
tomaticultura na Região Centro-Sul do Brasil. Disponível em: <F:\Mancha de corynespora ou
mancha alvo. htm>. Site visitado em: 07 de agosto de 2007.
BONALDO, S.M.; PASCHOLATI, S.F.; ROMEIRO, R.S. Indução de resistência: noções básicas
e perspectivas. In: CAVALCANTI, L.S.; DI PIERO, R.M.; CIA, P.; ASCHOLATI, S.F.;
RESENDE, M.L.V.; ROMEIRO, R.S. Indução de resistência em plantas a patógenos e
insetos. Piracicaba: FEALQ, 2005. p.11-28.
BONALDO, S.M.; SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R.; TESSMANN, D.J.;
SCAPIM, C.A. Fungitoxicidade, atividade elicitora de fitoalexinas e proteção de pepino contra
Colletotrichum lagenarium, pelo extrato aquoso de Eucalyptus citriodora. Fitopatologia
Brasileira, 29:128-134. 2003.
BOWEN, P., MENZIES, J.; EHRET, D. Soluble silicon spray inhibit powdery mildew
development on grape leaves. Journal of the American Society for Horticultural Sciences,
117:906-912. 1992.
BRAGA, M.R. Fitoalexinas e a defesa das plantas. Instituto de Botânica, SMA, São Paulo.
Disponível em: <www.sbq.org.br/PN-NET/texto 5/defesa.htm>. Site visitado em: 21 de agosto
de 2007.
CAMARGO, L.E.A. Análise genética da resistência e da patogenicidade. In: BERGAMIN
FILHO, A.; KIMATI, H.; AMORIN, L. Manual de fitopatologia: princípios e conceitos. 3.ed.
São Paulo: Ceres, 1: 470-492, 1995.
CAMARGO, L.E.A.; BERGAMIM FILHO. Controle genético. In: BERGAMIN FILHO, A.;
KIMATI, H.; AMORIN, L. Manual de fitopatologia: princípios e conceitos. 3.ed. São Paulo:
Ceres, 1: 729-760, 1995.
CARDOSO, A.I.I. Avaliação de cultivares de pepino tipo caipira sob ambiente protegido em duas
épocas de semeadura. Bragantia, Campinas, 61(1):43-48, 2002.
79
CASTRO, M.E.A. Resistência do tomateiro (Lycopersicon spp.) à ¨pinta-preta¨ (Alternaria
solani (Ellis e Martin) Jones e Grout). Viçosa: UFV, 1997. 118p.: il.
CASTRO, R.M.; AIZAWA, J.; GARCIA, L.D. Protection on tomatoes against bacterial speck
and tomato canker after CGA 245.704 application. BRF243 98a.doc, São Paulo: Novartis
Bioscience in house tests proceedings. 1999. 8 p.
CASTRO, R.M.; PAIVA, S.B.P.; VEIGA, J.S.; SAVINO, A.A. Atividades químicos de
resistência brasileira com BION. In: RODRIGUES, F.Á.; ROMEIRO, RS. Indução de
resistência em plantas a patógenos. Viçosa, MG; 2007. 339p.:il. 21 cm.
CAVALCANTI, F.R., RESENDE, M.L.V., ZACARONI, A.B., RIBEIRO JÚNIOR, P.M.,
COSTA, J.C.B.; SOUZA, R.M. Acibenzolar-S-metil e Ecolife® na indução de respostas de defesa
do tomateiro contra a mancha bacteriana (Xanthomonas vesicatoria). Fitopatologia Brasileira
31:372-380. 2006.
CAVALCANTI, L.S.; RESENDE, M.L.V. Efeito da época de aplicação e dosagem do
acibenzolar-S-metil na indução de resistência à murcha-de-Verticillium em cacaueiro.
Fitopatologia Brasileira. 30(1):67-71, 2005.
CHASAN, R. AS: Source or signal for SAR? The Plant Cell, 7: 1519-1521, october 1995.
CHAVES, G.M. Melhoramento do cafeeiro visando a obtenção cultivares resistentes a Hemileia
vastatrix Berk. et Br. Revista Ceres 23: 321-332. 1976.
COHEN, Y. The BABA story of induced resistance. Phytoparasitica, Bet Dagan, 29(5): 1-4,
2001.
CUTRIM, F.A.; SILVA, G.S. Patogenicidade de Corynespora cassiicola a diferentes espécies de
plantas. Fitopatologia Brasileira 28:193-194. 2003.
DANGL, J.L.; JONES, J.D.G. Plant pathogens and integrated defense responses to infection.
Nature, London, n. 6839, v. 411, p. 826-833, 2001.
DANN, E.K.; DEVERALL, B.J. Activation of systemic disease resistance in peã by na avirulent
bacterium or benzothiadiazole, but not by a fungal leaf spot pathogen. Plant Pathology 49: 324332, 2000.
80
DANTAS, S.A.F.; OLIVEIRA. S.M.A.; BEZERRA NETO, E.; COELHO, R.S.B.; SILVA,
R.L.X. Indutores de resistência na proteção do mamão contra podridões pós-colheita. Summa
Phytopathologica, Botucatu, 30(3):77-87, 2002.
DANTAS, S.A.F.; OLIVEIRA. S.M.A.; BEZERRA NETO, E.; COELHO, R.S.B.; SILVA,
R.L.X. Indutores de resistência a patógenos Pós-colheita de manga. Summa Phytopathologica,
Botucatu, 30: 314-319, 2004.
DURRANT, W.E; DONG, X. Systemic acquired resistance. Ann. Rev. Phytopathol. 42:185209, 2004.
EDREVA, A. A novel strategy for plant protection: Induced resistance. Journal of Cell and
Molecular Biology 3:61-69, 2004.
EPSTEIN, E.; BLOOM, A.J. Nutrição mineral de plantas: princípios e perspectivas. 2 ed.
Londrina: Planta, 2006. 403p.
EPSTEIN, E. Silicon. Annual Review of Plant Physiology and Plant Molecular Biology.
50:641-664. 1999.
FARIA, R. Efeito da acumulação de silício e a tolerância das plantas de arroz do sequeiro ao
déficit hídrico do solo. 2000. 125F. Dissertação (Mestrado) – Departamento do Solos,
Universidade Federal de Lavras, Viçosa.
FILGUEIRA, F.A.R. Novo Manual de Olericultura: agrotecnologia moderna na produção e
comercialização de hortaliças. 2a edição revista e ampliada. Viçosa: UFV, 2003.
GAFFNEY, T.; FRIEDRICH, L.; VERNNOEJ, B.; NEGRETTO, D.; NYE, G.; UKNES, S.;
WARD, E.; KESSMANN, H.; RYALS, J. Requirement of salicylic acid for the induction of
systemic acquired resistance. Science 261:754-756, 1993.
GLAZEBROOK, J. Contrasting mechanisms of defense against biotrophic and necrotrophic
pathogens. Annual Review of Phytopathology, Palo Alto, v.43, p.205-227, 2005.
GÓMEZ- GÓMEZ, L. Plant perception systems for pathogen recognition and defence.
Molecular Immunology, v. 41, p. 1055-1062, 2004.
81
GÖRLACH, J.; VOLRATH, S.; KANAUF-BEITER, G.; HENGY, G.; BECKHOVE, U.;
KOGEL, K.H.; OOSTENDORP, M.; STAUB, T.; KESSMANN, H.; RYALS, J.
Benzothadiazole, a novel class of inducers of sytemic acquired resistance activates gene
expression and disease reduction in wheat. The Plant Cell. Rockville, v.8, n.4, p.629-643, 1996.
GOTO, R. Pepino, crocância e frescor na sua salada. Disponível em:
<www.hortibrasil.org.br/classificacao/pepino/pepino.html.> Site visitado em: 23 de agosto de
2007.
GURGEL, L.M.S.; OLIVEIRA, S.M.A.; COELHO, R.S.B.; SILVA, R.L.X. Proteção a murcha
de fusário do tomateiro com Acibenzolar-S-Metil e Ácido -Aminobutírico, em campo.
Fitopatologia Brasileira, 30(6):655-657, 2005.
GUZZO, S.D. Aspectos bioquímicos e moleculares da resistência sistêmica adquirida em
cafeeiro contra Hemileia vastatrix. 2004. 236 f. Tese (Doutorado) – Escola Superior de
Agricultura “Luiz de Queiroz”, Universidade de São Paulo, Pircicaba, 2004.
HAMMERSCHMIDT, R. Induced disease resistance: how do induced plants stop pathogens?
Physiological and molecular plant pathology, London, 55(2):77-84, 1999.
HERBÁRIO.
Cultivo
do
pepino.
Disponível
<www.herbario.com.br/dataherb12/pepino.htm>. Site visitado em: 01 de agosto de 2007.
em:
HOFFLAND, E.; HAKULINEN, J.; van PELT, J. A. Comparison of systemic resistance induced
by avirulent and nonpathogenic Pseudomonas species. Phytopathology, 86:757-762, 1996.
JAKAB, G.; COTTIER, V.; TOQUIN, V.; RIGOLI, G.; ZIMMERLI, L.; MÉTRAUX, J.P.;
MAUCH-MANI, B. β-aminobutyric acid-induced resistance in plants. Eur J. Plant Pathol.
107:29-37, 2001.
JERBA , V.F.; RODELLA, R.A.; FURTADO, E.L. Relação entre a estrutura foliar de feijoeiro e
a pré-infecção por Glomerella cingulata f.sp. phaseoli. Pesquisa Agropecuária Brasileira,
Brasília, 40(3):217-223, 2005.
JESUS JUNIOR, W.C.; POZZA E.A.; VELE, F.X.R.; AGUILERA, G.M. Análise temporal de
epidemias. In.: VELE, F.X.R.; JESUS JUNIOR, W.C.; ZAMBOLIM , L. – Belo Horizonte:
Editora Perffil, 2004. 531p.
82
KLOEPPER, J.W. Host specificity in microbe-microbe interactions. BioScience, 46: 406-409,
1996.
KLOEPPER, J.W.; TUZUN, S.; ZEHNDER, G.W.; WEI, G. Multiple disease protection by
rhizobacteria that induce systemic resistance – historical precedence. Phytopathology, 87: 136137, 1997.
KORNDÖRFER, G.H.; PEREIRA, H.S.; CAMARGO, M.S. Uberlândia: UFU/ICIAG - (GPSiICIAG-UFU. Boletim técnico; 01). 2002.
KORNDÖRFER, G.H. Importância do silício na agricultura. Batata show. Ano 3, n°8, 2003.
Disponível em: < abbabatatabrasileira.com.br/revista08_005.htm>. Site visitado em: 24 de agosto
de 2007.
KUROZAWA, C.; PAVAN, M.A.; Doenças das cucurbitáceas. In: KIMATI, H.; AMORIM, L.;
BERGAMIN FILHO, A.; CAMARGO, L.E.A.; REZENDE, J.A.M. Manual de Fitopatologia:
doenças das plantas cultivadas. São Paulo: Agronômica Ceres. 2: 325-337, 1997.
KUROZAWA, C.; PAVAN, M.A.; REZENDE, J.A.M. Doenças da cucurbitáceas. In: Kimati,
Hiroshi. Manual de fitopatologia. 4. ed. São Paulo: Agronômica Ceres. 2v.: il. 2005.
KURT, S. Host-specific toxin prodution by the tomato target target leaf spot pathogen
Corynespora cassiicola. Turk J. Agric For. 28:389-395. 2004.
LABANCA, E.R.G. Purificação parcial de elicitores presentes em Saccharomyces cerevisiae:
atividade como indutores de resistência em pepino (Cucumis sativus) contra Colletotrichum
lagenatium e da síntese de gliceolinas em soja (Glycine max). 2002. Dissertação (Mestrado) –
Universidade de São Paulo, Piracicaba, 2002.
LAMB, C.J.; LAWTON, M.A.; DRON, M.; DIXON, R.A. Signals and transduction mechanisms
for activation of plant defenses against microbial attack. Cell, 56: 215-224, 1989.
LAWRENCE, C.B.; JOOSTEN, M.H.A.J.; TUZUN, S. Differential induction of pathogenesis
related proteins in tomato by Alternaria solani and the association of a basic chitinase isozyme
with resistance. Physiological and Molecular Plant Pathology, 48: 361-377, 1996.
83
LEITE; PASCHOLATI. Conceitos e objetivos. In: BERGAMIN FILHO, A.; KIMATI, H.;
AMORIM, L. Manual de fitopatologia: princípios e conceitos. 3.ed. São Paulo: Agronomia
Ceres, v.1, 1995. p.540-553.
LEROUX, P., Recent developments in the mode action of fungicides. Pesticide Science, 47(3):
191-197, 1996.
LICHSTON, J.E.; GODOY, S.A.P. Morfologia e teor de cera de folhas de café após aplicação de
fungicida. Pesquisa Agropecuária Brasileira, Brasília, 41(6):919-926, 2006.
LIN, TSUNG-CHUN; ISHIZAKA, M.; ISHII, H. Acibenzolar-S-metil-Induced resistência
sistêmica contra a antracnose e Doenças oídio em pepino Plantas sem acumulação de
Fitoalexinas. Journal of phytopathology. 2009 Jan., v. 157, no.1.
LIU, L.; KLOEPPER, J. W.; TUZUN, S. Induction of systemic resistance in cucumber against
Fusarium wilt by plant growthpromoting rhizobacteria. Phytopathology, 85: 695-698, 1995.
LOPES, C.A. Manejo integrado de bactérias fitopatogênicas. In: SILVA, L.H.C.P.; CAMPOS,
J.R.; NOJOSA, G.B.A. (Ed.). Manejo integrado: doenças e pragas em hortaliças. Lavras:
UFLA, 2001. 105-124 p.
LOPES, C.A.; REIS, A.; BOITEUX, L.S. Doenças fúngicas. In: LOPES, C.A.; ÁVILA, A.C.
(Org.). Doenças do tomateiro. Brasília, DF: Embrapa Hortaliças, 2005. p.17-51.
LOPES, C.A.; SANTOS, J.R.M. dos. Doenças do tomateiro. Brasília: Embrapa- CNPH:
Embrapa-SPI, 1994. 61p.
LOPES, J.F. I Simpósio Brasileiro sobre cucurbitáceas: Palestra de Abertura. Horticultura
Brasileira, Brasília, 9(2):98-99, 1991.
LOURD, M.; NODA, H.; ALVES, M.L.B. Principais fungos e bactérias patogênicos das plantas
olerícolas na região de Manaus. Fitopatologia Brasileira 13: 25-27, 1988.
LOUWS, F.J.; WILSON, M.; CAMPBELL H.L. Field control of bacterial spot and bacterial
speck of tomato using a plant activator. Plant Disease, 85(5): 481-488, 2001.
84
MADAMANCHI, N.R.; KUC, J. Induced sistemic resistance in plants. In: COLE, G.T.; HOCH,
H. (Eds) The fungal spore and disease initiation in plants. New York: Plenum Press, 1991.
347-362p.
MARSCHNER, H. Mineral nutrition of higher plants. 2ed. London: Academic Press, 1995.
889p.
MÉTRAUX, J.P. Induced defenses in plants. In: RODRIGUES, F.Á.; ROMEIRO, R.S. Indução
de resistência em plantas a patógenos. Viçosa, MG; 2007. 339p.: il.; 21cm.
MORAES, M.G. Mecanismos da resistência sistêmico adquirida em plantas. RAPP. 6:261-285,
1998.
MORAES, S.R.G.; POZZA, E.A.; ALVES, E.; POZZA, A.A.A.; CARVALHO, J.G.; LIMA,
P.H.; BOTELHO, A.O. Efeito de fontes de silício na incidência e na severidade da antracnose do
feijoeiro. Fitopatologia Brasileira 31(1):069-075, 2006.
MOTOYAMA, M.M.; SCHWAN-ESTRADA, K.R.F.; STANGARLIN, J.R.; FIORI-TUTIDA,
A.C.G.; SCAPIM, C.A. Indução de fitoalexinas em soja e em sorgo e efeito fungitóxico de
extratos cítricos sobre Colletotrichum lagenarium e Fisarium semitectum. Acta Scientiarum
Agronomy, 25:491-496, 2003.
NOJOSA, G.B.A.; RESENDE, M.L.V.; BARGUIL, B.M.; MORAES, S.R.G.; VILAS BOAS,
C.H. Efeito de indutores de resistência em cafeeiro contra a mancha de Phoma. Summa
Phytopathologica, v.35, n.1, p.60-62, 2003.
NOJOSA, G.B.A.; RESENDE, M.L.V.; BARGUIL, B.M.; MORAES, S.R.G.; VILAS BOAS,
C.H. Efeito de indutores de resistência em cafeeiro contra a mancha de Phoma. Summa
Phytopathologica, v.35, n.1, p.60-62, 2009.
OBRADOVIC, A.; JONES, J.B.; MOMOL, M.T.; OLSON, S.M.; JACKSON, L.E.; BALOGH,
B.; GUVEN, K.; IRIARTE, F.B. Integration of biological control agents and systemic acquired
resistance inducers against bacterial spot on tomato. Plant Disease, St. Paul, 89(7): 712-716,
2005.
OKA K, OKUBO A, KODAMA M, OTANI H. Detoxification of a-tomatine by tomato
pathogens Alternaria alternata tomato pathotype and Corynespora cassiicola and its role in
infection. J Gen Plant Pathol 72:152–158. 2006.
85
OLIVEIRA, R.R.; VIDA, J.B.; TESSMANN, C. J.; AGUIAR, B.M.; CAIXETA, M.P. Reação de
híbridos de pepino para cultivo protegidos de Corynespora cassicola. Fitopatologia Brasileira,
31(5): - 2006.
OOSTENDORP, M.; KUNZ, W.; DIETRICH, B.; STAUB, T. Induced disease resistance in
plants by chemicals. European Journal of Plant Pathology, 107(1): 19-28, 2001.
OTANI, H.; NAKAJIMA, H.; KODAMA, M.; KOHMOTO, K. Chlorosis toxin produced by
Corynespora cassiicola, the cause of Corynespora leaf spot of cucumber. Ann Phytopathol Soc
Jpn 63:509.1997.
PASCHOLATI, S.F.; LEITE, B. Hospedeiros: mecanismos de resistência. In: BERGAMIN
FILHO, A.; KIMATI, H.; AMORIN, L. Manual de fitopatologia: princípios e conceitos. 3.ed.
São Paulo: Ceres, 1: 417-453, 1995.
PASCHOLATI, S.F. Resultados com resistência induzida no Brasil. In: SIMPÓSIO DE
BIOLOGIA MOLECULAR DA RESISTÊNCIA DE PLANTAS A PATÓGENOS:
APLICAÇÕES NO MANEJO INTEGRADO DE FITODOENÇAS, 1, 2002, Lavras. Resumos...
Lavras: Ufla, p. 120, 2002.
PERES, A.P.; SILVA-MANN, R.; VIEIRA, M.G.G.C.; MACHADO, J.C. Variabilidade
morfocultural e genética de fungos associados à podridão peduncular do mamão. Ciências
Agrotécnica, Lavras. v.27, n.5, p.1053-1062, set./out., 2003.
PIETERSE, C.M.J.; VAN PELT, J.A.; VAN WESS, S.C.M.; TON, J.; VERHAGEN, B.N.M.;
LÉON-KLOOSTERZIEB, K.; HASE, S.; DE VOS, M.; VAN OOSTEN, V.; POZO, M.;
SPOEL,S.; VAN der ENT, S.; KOORNNEEF, A.; CHALFUN-JUNIOR, A.; RESENDE,
M.L.V.; VAN LOON, L.C. Indução de resistência sistêmica por rizobactéria e comunicação
na rota de sinalização para uma defesa refinada. RAPP. 13:277-295, 2005.
PRESTES, A.M. Transferência de resistência a doenças de espécies silvestres para espécies
cultivares. Revisão Anual de Patologia de Plantas- RAPP. Vol.3. 1995. p 315-353.
QUERINO, C.M.B., LARANJEIRA, D., COELHO, R.S.B.; MATOS. A.P. Efeito de dois
indutores de resistência sobre a severidade do mal-do-Panamá. Fitopatologia Brsileira 30:239243. 2005.
86
QUEZADO-DUVAL, A.M.A; LOPES, C.A.O; JUNQUEIRA, N.T.V. Avaliação de produtos
alternativos para o controle da mancha-bacteriana em tomateiro para processamento industrial.
Brasília: Embrapa Hortaliças, 5 p., (Embrapa Hortaliças. Boletim de Pesquisa e
Desenvolvimento, 14), 2005.
RÊGO, A.M.O; CARRIJO, I.V. Doenças das cucurbitáceas. In: ZAMBOLIM, LAÉRCIO,
VALE, FRANCISCO XAVIER RIBEIRO; COSTA, HÉLCIO. Controle de doenças de plantashortaliças. Viçosa. 2v.: il. 2000.
RESENDE, M.L.V.; AVES, E.; CAMPOS, M.A.; ROZWALCA, L.C.; BOTELHO, L.S.;
UCHÔA, C.N.; FREIRE, E.S.; KOSHIKUMO, É.S.M. Mecanismos de defesa de plantas contra
doenças. In.: LUZ, W.C. Revisão Anual de Patologia de Plantas – RAPP. Vol. 16, 2008.
RIOUX, D.; BIGGS, A. Cell wall changes in host and nonhost systems: microscopic aspects. In:
Petrini, Orlando & Ouellette, Guillemond B. Host wall alterations by parasitic fungi. The
American Phytopathological Society. St. Paul, Minnesota. 1994.p. 31-44.
RODRIGUES, A.A.C.; BEZERRA NETO, E.; COELHO, R.S.B. Indução de resistência a
Fusarium oxysporum f. sp.tracheiphilum em caupi: eficiência de indutores abióticos e atividade
enzimática elicitada. Fitopatologia Brasileira 31:492-499, 2006.
RODRIGUES, F.Á.; DATNOFF, L.E. Silicon-mediated restence in monocots: the riceMagnaporthe grisea model. In: RODRIGUES, F.Á.; ROMEIRO, R.S. Indução de resistência
em plantas a patógenos. Viçosa, MG; 2007. 339p.: il.; 21cm
ROMEIRO, R.S. Indução de resistência em plantas a patógenos. Viçosa: UFV, 1999. 45p.: il.
(Caderno didádico, 56).
ROSS, A.F. Sistemic acquired resistance induced by localized vírus infections in plant.
Virology, 14(3):340-358, 1961.
RYALS, J.A., NEUENSCHWANDER, U.H.; WILLITS, M.G.; MOLINA, A.; STEINER, H.Y.;
HUNT, M.D. Systemic acquired resistance. The plant cell, Rockville, 8(10):1809-1819, 1996.
SAMUELS, A.L.; GLASS, A.D.M.; EHRET, D.L.; MENZIES, J.G. Distribution of silicon leaves
during infection by powdery mildew fungus (Sphaerotheca fuliginea). Canadian Journal
Botanical. 69:140-146. 1991a.
87
SAMUELS, A.L., GLASS, A.D.M., EHRET, D.L.; MENZIES, J.G. Mobility and deposition of
silicon in cucumber plants. Plant, Cell and Environment 4:485-492. 1991b.
SANTOS, I.P.; CARDOSO, S.S.; POLTRONIERI, L.S.; VERZIGNASSI, J.R.; BENCHIMOL,
R.L. Ocorrência de mancha alvo, causada por Corynespora cassiicola, em alface cultivado em
hidroponia no Brasil. Summa Phytopathologica, Botucatu, v.33, n.4, p.419, 2007.
SILVA, L.H.C.P.; RESENDE, M.L.V.; MARTINS JUNIOR, H.; CAMPOS, J.R.; SOUZA,
R.M.; CASTRO, R.M. Épocas e modo de aplicação do ativador de plantas benzothiadiazole
(BHT) na proteção contra a mancha bacteriana do tomateiro. Horticultura Brasileira,
suplemento. 18:375-376, 2000.
SILVA, L.H.C.P.; RESENDE, M.L.V. Resistência induzida em plantas contra patógenos. In:
SILVA, L.H.C.P.; CAMPOS, J.R.; NOJOSA, G.B.A. Manejo integrado de doenças e pragas
em hortaliças. Lavras: Ufla, p.221-239, 2001.
SMITH-BECKER, J.; KEEN, N.T.; BECKER, J.O. Disease management in melons with BTH,
and synthetic inducer of systemic acquired resistance. Phytopathology, St. Paul, 88(9):583,
1998.
SOBRINHO, C.A.; FERREIRA, P.T.O.; CAVALCANTI, L.S. Indutores bióticos. In:
CAVALCANTI, L.S.; DI PIERO, R.M.; CIA, P.; PASCHOLATI, S.F.; RESENDE, M.L.V.;
ROMEIRO, R.S. Indução de resistência em plantas a patógenos e insetos. Piracicaba:
FEALQ, 2005. p.51-80.
SOUZA, I.; MATA, S.G. Cultura de Pepino para Conserva. Disponível em:
<http://www.emater.mg.gov.br/site_emater/Serv_Prod/Livraria/Olericultura/Pepino.htm>.
S ite
visitado em: 06 de Agosto de 2007.
STEINER, U.; SCHÖNBECK, F. Induced disease resistance in monocots. In: Hammerschmidt,
R.; Kuc, J (Ed.). Induced Resistance to Disease in Plants (Developments in Plant Pathology,
Vol 4). Kluwer Academic Pub., Dordrech. 1995. p.86-110.
STICHER, L.; MAUCH MANI, B.; METRAUX. J.P. Systemic acquired resistance. Annual
Review of Phytopathology, 35: 235-270, 1997.
TAIZ, L.; ZEIGER, E. Fisiologia Vegetal. 3ed. – Porto Alegre: Artmed, 2004. 719p.
88
TAKAHASHI, E. Uptake mode and physiological finctions of silica. In: SCIENCE OF THE
RICE PLANT: Physilogy. Food and Agric. Policy Res. Center, Tokyo, 2: 420-433, 1996.
TÖFOLI, J.G.; DOMINGUES, R.J. Controle da pinta preta do tomateiro com o uso de
acibenzolar-S-metil isolado, em mistura com fungicidas e em programas de aplicação. Arq.
Instituto Biológico, 72:481-487, 2005.
TUZUM, S. The relationship between pathogen-induced systemic resistance (ISR) and
multigenic (horizontal) resistance in plants. European Journal of Plant Pathology, 107:85-93,
2001.
VALLAD, G.; PERNEZNY, K.; SIMONE, G.W. Target spot of several vegetable crops.
University of Florida. Revised August. 2008.
VANDERPLANTK, J.E. Plant Disease: Epidemics and Control. New York. Academic Press.
1963. 349p.
van LOON, L.C. Induced resistance in plant and the role of pathogenesis-related proteins.
European Journal Plant Pathology, 103: 753-765, 1997.
van LOON, L.C., van KAMMEN, A. Polyacrylamide disc electrophoresis of the soluble leaf
proteins from Nicotiana tabacum var. “Samsun” and “Samsun NN”. Virology, 40: 199-211,
1970.
van LOON, L.C., PIERPOINT, W.S., BOLLER, T., CONEJERO, V. Recommendations for
naming plant pathogenesis – related proteins. Plant Molecular Biology Reporter, v.12, p.245264, 1994.
VERZIGNASSI, J.R., VIDA, J.B.; TESSMANN D.J. Epidemia de mancha de corinespora em
pepino “tipo japonês” sob cultivo protegido na Região Norte de Estado do Paraná. Fitopatologia
Brasileira, 28:570, 2003.
VIDA, J.B.; OLIVEIRA, R.R.; TESSMAM, D.J.; VERZIGNASSI, J.R.; COSTA, H. A
agricultura protegida: Plasticultura-Hortaliças-Manejo de doenças. In: Aguiar, L.R., Darezzo,
R.J., Rozane, D.E., Aguilera, G.A.H. & Silva, D.J.H. (Eds.) Cultivo em ambiente protegido Histórico, Tecnologia e Perspectivas. Viçosa MG. 225-240pp. 2004.
89
WHITAKER, T.W.; BEMIS, W.P. Cucurbits. In: SIMMONDS, N.W. Evolution of Crop Plants.
New York, Longman, 1976, 278p.
YAMAGUCHI, I. Activators for sistemic acquired
MYAMAMOTO, J. Fungicidal Activity, p. 193-219, 1998.
resistance.
In:
HUTSON,
D.;
YOSHIDA, S. Chemical aspects of the role of silicon in physiology of the rice plant. Bulletin
national institute of agriculture and science, Ser. B. 15:(1-58), 1975.