Papel dos Ácidos Graxos Voláteis na Deposição de Tecido Adiposo Intramuscular – Revisão
1
2
2
Angelo Polizel Neto , Renata Helena Branco , Sarah Figueiredo Martins Bonilha ,
3
1
Helen Fernanda Barros Gomes , Tatiana Lucila Sobrinho Corvino
RESUMO: A deposição de tecido adiposo basicamente ocorre em quatro sítios distintos: gordura interna (abdominal,
renal-inguinal e pélvica), intermuscular (entre os grupos musculares), subcutânea (de cobertura) e intramuscular
(marmoreio), seguindo esta mesma seqüência, o que classifica a deposição intramuscular como tardia, por ser a última
gordura corporal depositada. Contudo, mecanismos nutricionais podem propiciar maior e antecipada deposição de
gordura intramuscular, uma vez que o acetato contribui com 70 a 80 % das unidades de carbono provenientes de acetilCoA depositadas no tecido adiposo subcutâneo e com apenas 10 a 26 % das depositadas no intramuscular. O lactato
contribui de forma similar nos sítios de depósito de gordura corporal, com valores entre 15 e 30 % das unidades de
carbono incorporadas. A glicose contribui com 50 a 60 % das unidades incorporadas, sendo fonte doadora de acetilCoA para a deposição de tecido adiposo intramuscular. Assim, sistemas de produção voltados à produção de maiores
teores de gordura intramuscular no músculo Longissimus dorsi, devem fornecer aos animais dietas capazes de elevar
os teores de ácidos graxos voláteis gliconeogênicos.
Palavras-chave: bovino de corte, glicose, gordura, marmoreio, metabolismo
Functions of Volatiles Fatty Acids on Intramuscular Fat Deposition – Review
ABSTRACT: Adipose tissue deposition happens in four different sites: internal fat (abdominal, perirenal, and pelvic),
inter muscle groups, subcutaneous and intramuscular (marbling), following this same sequence, being intramuscular
deposition considered like later. However, nutrition mechanisms are able to propitiate greater and earlier intramuscular
fat deposition, once acetate provides 70 to 80% of carbon, originated from acetyl-CoA, units deposited in subcutaneous
fat and only 10 to 26% of units deposited in intramuscular adipose tissue. Lactate contributes similarly among deposition
fat sites, corresponding to 15 to 30% of carbon-incorporated units. Glucose contributes with 50 to 60% of incorporated
units, being donator of acetyl-CoA to intramuscular fat deposition. Thus, production systems that objectives increasing
marbling on Longissimus dorsi muscle, should feed animals with diets that are able to increase gluconeogenic volatiles
fatty acids.
Keywords: beef cattle, fatness, glucose, marbling, metabolism
INTRODUÇÃO
A síntese de tecido adiposo aumenta a medida que a de tecido muscular diminui, ou seja, após a puberdade ou
maturidade, quando o crescimento/desenvolvimento muscular é muito pequeno, chega-se ao ponto onde o ganho de
peso é composto, basicamente, por tecido adiposo (OWENS et al., 1995).
1
Programa de pós-graduação da Faculdade de Medicina Veterinária e Zootecnia da UNESP, Botucatu/SP.
Centro Avançado de Pesquisa Tecnológica de Bovinos de Corte do Instituto de Zootecnia, Sertãozinho/ SP.
3
Programa de pós-graduação da Faculdade de Ciências Agrárias e Veterinárias da UNESP, Jaboticabal/ SP.
2
Além disso, a deposição de tecido adiposo não é uniforme, havendo basicamente quatro distintos sítios nos
animais: gordura interna (abdominal, renal-inguinal e pélvica), intermuscular (entre os grupos musculares), subcutânea
(de cobertura) e intramuscular (marmoreio). (PETHICK et al., 2004) afirmaram que a deposição de tecido adiposo segue
a seqüência supracitada, isto é, primeiramente gordura interna, seguida da intermuscular, subseqüentemente da
subcutânea e por fim a gordura intramuscular, que é o alvo de discussão desta revisão.
Os teores de gordura intramuscular tendem a ser pequenos ou moderados, principalmente em ruminantes, que
parecem seguir a seqüência de deposição citada. THOMPSON e BUTTERFIELD (1987), avaliando cordeiros Merino,
encontraram 7% de gordura intramuscular frente a 33% de interna, 24% de intermuscular e 20% de subcutânea.
Segundo CIANZIO et al. (1982), a deposição de gordura intramuscular não é tardia, mas sim sua "expressão",
em outras palavras, parece não haver grandes alterações nas taxas de deposição de gordura nos diferentes pontos
corporais dos animais. PETHICK et al. (2004), compararam características de carcaça de bovinos Angus no início e final
do período de confinamento e verificaram que a relação entre gordura intramuscular no Longissimus dorsi e a gordura
total manteve-se constante apesar do aumento significativo da gordura corporal total entre animais abatidos antes e
depois do confinamento.
A deposição de gordura intramuscular é diferente entre raças, bem como dentro de raças. Raças de origem
britânica apresentam reconhecidamente maior capacidade de deposição de gordura de marmoreio que raças zebuínas
e continentais. E, mesmo dentro de uma mesma origem racial, animais podem apresentar maior ou menor deposição de
gordura intramuscular. Como exemplo, dentro de raças continentais, a Piemontesa, que possui mutação no gene GDF8,
desenvolve fenótipo de musculatura dupla e apresenta apenas traços de marmoreio. Por outro lado, a raça japonesa
Waghy, também continental, tende a apresentar o maior escore de marmorização entre os bovinos.
As discussões aqui apresentadas são isentas de efeito genético ou idade do animal, ficando apenas restritas a
amplitude de fatores dietéticos, com enfoque em vias bioquímicas - metabólicas de deposição de gordura (lipogênese),
em destaque da gordura intramuscular, tendo como precursores os ácidos graxos voláteis (AGVs).
LIPOGÊNESE COM BASE EM AGVs
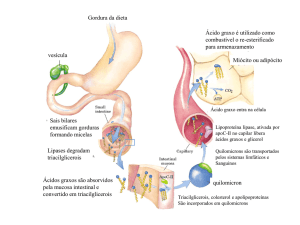
A deposição de gordura ocorre principalmente por dois processos: incorporação dos ácidos graxos pré-formados
transportados pelas lipoproteínas do plasma e por meio da síntese de ácidos graxos. Em ruminantes voltados a
produção de carne a síntese de ácidos graxos ocorre principalmente (90%) no tecido adiposo (VERNON, 1981),
diferentemente dos não-ruminantes, onde o fígado é o grande responsável.
1. Acetato
O acetato é o principal precursor da síntese de ácidos graxos a serem depositados nos ruminantes. Para que o
acetato seja incorporado aos ácidos graxos, deve ser convertido em acetil-CoA pela ação da acetil-CoA sintetase, que
apresenta baixa atividade no fígado dos ruminantes, sendo o tecido adiposo o maior responsável pela conversão de
acetato em acetil-CoA, e, por conseqüência, o maior sintetizador de ácidos graxos em ruminantes.
Para a síntese de ácidos graxos, a primeira reação é a conversão do acetil-CoA em malonil-CoA pela atividade
da acetil-CoA carboxilase (enzima chave). Nesta reação, catalisada pela biotina, o CO2 é fixado ao carbono metílico do
acetato. A enzima carboxilase é ativada por desfosforilação, em resposta a insulina, e estimulada pelo aumento de
citrato; ao passo que o aumento na concentração de derivados de acil-CoA de cadeia longa, como palmitoil-CoA e
glucagon provoca sua inibição (PALMQUIST e MATTOS, 2006).
Em seqüência, o malonil-CoA une-se a uma molécula de acetil-CoA, formando um composto de 4 carbonos,
beta-hidroxibutiril-ACP (transportadora de Acil), com perda de CO2 e redução de NADPH. Em seguida, o grupamento
beta é desidratado e reduzido a butiril-ACP, pela ação da enol-ACP redutase, utilizando um NADPH como doador de
elétrons. O butiril-ACP entra novamente no ciclo utilizando o complexo enzimático AGS – Ácido Graxo Sintetase, e,
depois de completados sete ciclos de oxidação e redução, produz o palmitil-ACP de 16 carbonos, que desliga-se da
molécula ACP e torna-se ácido palmítico livre (LEHNINGER et al., 2000).
O palmitato, assim como os ácidos graxos de origem dietética, podem ser elongados no citoplasma por meio da
ativação de ésteres-CoA, seguida da condensação com malonil-CoA e redução de NAPDH. Já na mitocôndria, o acetilCoA é o maior substrato utilizado para o elongamento (PALMQUIST e MATTOS, 2006).
2. Butirato
De forma muito semelhante à via bioquímica do acetato, o tecido adiposo pode utilizar o butirato (butiril-CoA) e o
corpo cetônico beta-hibroxibutirato (beta-hidroxibutiril-CoA) como substitutos de acetil-CoA, principalmente para síntese
de ácidos graxos de cadeia longa (PALMQUIST e MATTOS, 2006). Contudo, estes parecem ser metabolizados de
forma preferencial na glândula mamária, quando em animais lactantes (VERNON, 1981).
3. Propionato e lactato
O uso de propionato e lactato para a síntese de ácidos graxos segue uma via não preferencial, por serem ácidos
graxos voláteis gluconeogênicos (formadores de glicose), e serem, quase que na totalidade, captados pelo fígado,
devido a alta atividade da enzima propionil-CoA sintetase ali apresentada, diferentemente da baixa atividade da acetilCoA sintetase, conforme discutido anteriormente.
Contudo, quando o propionato é captado pelos tecidos adiposo ou hepático (com excesso de energia) é ativada a
propionil-CoA sintetase e seguem os ciclos supracitados, dando origem a cadeia de ácido graxos de número impar de
carbonos ou sendo importante na síntese da cadeia ramificada de ácido graxo (CHRISTIE, 1981).
Já o lactato, é desidrogenado pela lactato desidrogenase, no ciclo de Cori, e convertido em via inversa a piruvato.
O piruvato, tanto oriundo da desidrogenase sofrida pelo lactato, como da quebra da glicose, é um doador de acetil-CoA
para síntese de ácido graxo de deposição, resultando em síntese de ácido graxo via glicose.
O piruvato também pode ser oriundo do propionato via metilmalonil-CoA, que entra no ciclo de Krebs como
succinil-CoA e é convertido a malato, que na via gliconeogênica sai da mitocôndria e é convertido a oxaloacetato e
fosfoenolpiruvato e segue para formação da glicose (KOZLOSKI, 2002).
Uma vez piruvato, é transportado para o interior da mitocôndria e perde CO2, e por ação do complexo piruvatodesidrogenase, é transformado a acetil-CoA, que se une ao oxaloacetato e pela ação da citrato sintetase, torna-se uma
molécula de citrato, que é transportada para fora da mitocôndria pela proteína transportadora de tricarboxilatos.
No citoplasma o citrato sofre ação da citrato liase, reação que consome um ATP, une-se a uma coenzima-A e
libera o acetil-CoA para a síntese de ácidos graxos descrita anteriormente. O citrato, com a quebra promovida pela
citrato liase, volta a ser oxaloacetato, que será re-transportado para a mitocôndria via malato. Sendo assim, o transporte
de acetil-CoA para fora das mitocôndrias é via citrato.
DEPOSIÇÃO DE GORDURA INTRAMUSCULAR
Em situação dietética favorecida, onde as células têm disponibilidade de combustível metabólico maior que as
exigências, o excedente é convertido em ácidos graxos. A reação controle desta conversão é catalisada pela acetil-CoA
carboxilase (responsável pela conversão inicial do acetil-CoA em malonil-CoA). VERNON (1981) discute que esta
enzima está fortemente correlacionada à velocidade de síntese de ácido graxo, principalmente na engorda ou após
jejum.
É de se notar que a cada ciclo completado para a formação do acido palmítico, há necessidade de redução de
dois NADPH à NADP, e que o alto uso deste composto é sustentado pelo ciclo das pentoses, que supre em torno da
metade dos NADPH requeridos. O restante fornecido pelo desvio do citrato citoplasmático a isocitrato, que é convertido
a alfa-cetoglutarato pela ação da isocitrato desidrogenase, com o fornecimento de NADPH, sendo que o alfacetoglutarato retorna ao interior da mitocôndria e entra no ciclo de Krebs (PALMQUIST e MATTOS, 2006).
O desvio do citrato para isocitrato tem importância ainda maior em ruminantes, pois estes apresentam baixa
atividade da enzima citrato liase, propositalmente, de forma a poupar o desvio de glicose para formação de ácido graxo
de reserva e propiciar a formação de redutores (NADPH) (VERNON, 1981). Contudo a citrato liase, assim como o
complexo da piruvato desidrogenase, são enzimas reguladoras da produção de acetil-CoA, sendo fortemente
estimuladas pela insulina e inibidas pelo glucagon (LEHNINGER et al., 2000).
A regulação da síntese de ácidos graxos, de forma geral, é muito variada, podendo sofrer interferência de
diversos compostos e moléculas. O maior nível de acetato plasmático propicia a formação de ácido graxo nos
adipócitos, utilizando-o como precursor, poupando lactato. A acetil-CoA viria do piruvato (VERNON, 1981), deslocando
este demais à formação de glicose.
Já a glicose, apesar de menos usada como fonte de carbono para síntese de ácidos graxos de reserva, tem alto
poder de influenciar a formação de adipócitos. Segundo VERNON (1981), houve elevação da taxa de síntese de ácido
graxo tendo como percursor o acetato de 3 a 10 vezes em ovinos e bovinos, e de 20 a 50 vezes em caprinos, quando
estes foram infundidos com glicose. E este mesmo autor detectou também o estímulo ao uso de beta-hidroxibutirato
para a síntese de ácido graxo, mas não ao uso de piruvato e lactato.
SMITH e CROUSE (1984), avaliando novilhos Angus em crescimento, com dois níveis de energia na dieta,
encontraram que a deposição de gordura intramuscular foi alterada em função do nível de energia na dieta e tampouco
em função da idade ao abate. Os autores ainda observaram, usando U14C (isótopos estáveis), que acetato e lactato
foram mais incorporados ao tecido adiposo subcutâneo que no intramuscular; e que o maior nível de energia na dieta
propiciou maiores incorporações destes ácidos graxos voláteis, indicando que a deposição de gordura corporal está
diretamente relacionada a oferta de energia líquida.
Além disso, os mesmos autores observaram que a glicose é o único composto carbônico com maior
concentração de seus carbonos no tecido adiposo intramuscular em relação ao subcutâneo; sendo assim, a glicose é a
melhor precursora para síntese de ácidos graxos no tecido adiposo intramuscular. Tal afirmação é fundamentada pela
análise das contribuições percentuais de cada precursor de ácidos graxos na gordura de marmoreio. Notou-se também
menor incorporação da glicose nos animais mais velhos (18 meses), fato que parece ser devido a alta incorporação de
acetato e lactato nestes animais, havendo concorrência por coenzima A.
WHITEHURST et al. (1981), baseados na atividade da ATP-citrato liase, sugeriram que o lactato seria o mais
importante precursor da síntese de ácidos graxos no tecido adiposo intramuscular. Estes resultados contrastam-se com
os encontrados por SMITH e CROUSE (1984).
Em análise geral da contribuição dos diversos precursores discutidos para a formação dos ácidos graxos a serem
depositados, SMITH e CROUSE (1984) concluíram que o acetato contribui com 70 a 80% das unidades de carbono
provenientes da acetil-CoA depositadas no tecido subcutâneo e com apenas 10 a 26% das unidades de carbono
depositadas no tecido adiposo intramuscular. Já o lactato contribui de forma similar entre os sítios de depósito de
gordura corporal, com valores entre 15 a 30 % das unidades incorporadas. A glicose contribui com 50 a 60 % das
unidades incorporadas, sendo fonte doadora de acetil-CoA para a deposição de tecido adiposo intramuscular.
A elevação do nível de proteína na dieta dos animais pode incrementar a deposição de gordura intramuscular.
LOPEZ et al. (2001), alimentando novilhas com diferentes níveis de farelo soja de forma a propiciar dietas com 12, 14,
16 ou 18% de proteína bruta, observaram maiores níveis de insulina plasmática no grupo que recebeu 16%, enquanto
maiores teores de glicemia foram observados no grupo que recebeu 18%. Estes autores propuseram que maiores níveis
de proteína bruta na dieta elevaram a digestão e a absorção intestinal do amido, principalmente em dietas com grãos
inteiros, e promoveram a elevação plasmática de insulina e glicose, o que, por conseqüência, aumentou a deposição de
tecido adiposo intramuscular, por favorecer precursores dos ácidos graxos.
CONSIDERAÇÕES FINAIS
Sistemas de produção voltados à produção de maiores teores de gordura intramuscular no músculo Longissimus
dorsi (contra-filé) devem fornecer aos animais dietas que possibilitem elevar os teores de ácidos graxos voláteis
gliconeogênicos, ou seja, fornecer dietas com altos teores de grãos, de forma a elevar propionato e glicose sangüínea.
Pesquisas aprofundadas são necessárias para confirmar estas vias metabólicas.
O marmoreio é altamente influenciado por fatores genéticos, portanto a opção por grupos genéticos com
potencial para deposição de gordura intramuscular, associada ao uso da nutrição podem trazer resultados satisfatórios
neste quesito.
LITERATURA CITADA
CHRISTIE, W.W. The effects of diet and other factors on the lipid composition of ruminant tissues and milk. In:
CHRISTIE, W. W. (ed.) Lipid metabolism in ruminant animals. Oxford: Pergamon Press Ltd. 1981. p. 329-375.
CIANZIO, D.S. et al. Adipose tissue growth in cattle representing two frame sizes: Distribution among depots. Journal of
Animal Science, v.55, p.305-312, 1982.
KOZLOSKI, G.V. Bioquímica dos ruminantes. Santa Maria: Editora UFSM, 2002. 140p.
LEHNINGER, A.L. et al. Princípios de bioquímicas. São Paulo: SARVER. 2000. 839p.
LOPEZ, R. et al. Effect of increasing level of dietary protein on serum concentrations of metabolic hormones and
mammary development in Holstein heifers consuming a moderate-energy diet. Journal of Dairy Science, v.84, p.161172, 2001. (suplemento 1)
OWENS, F.N. et al. Review of some aspects of growth and development of feedlot cattle. Journal of Animal Science,
v.73, p.3152-3172, 1995.
PASLMQUIST, D.L.; MATTOS, W.R.S. Metabolismo de lipídeos. In: BERCHIELLI, T.T. et al. Nutrição de Ruminantes.
Jaboticabal: FUNEP. 2006. p.287-310.
PETHICK, D.W. et al. Growth, development and nutritional manipulation of marbling in cattle: A review. Australian
Journal of Experimental Agriculture, v.44, p.705-715, 2004.
SMITH, S.B.; CROUSE, D.J. Relative contributions of acetate, lactate and glucose to lipogenesis in bovine intramuscular
and subcutaneous adipose tissue. The Journal of Nutrition. v.114, p.792-800, 1984.
THOMPSON, J.M.; BUTTERFIELD, R.M. Food intake, growth and body composition in Australian Merino sheep selected
for high and low weaning weight. Animal Production, v.45, p.49-60, 1987.
VERNON, R.G. Lipid metabolism in adipose tissue of ruminants. In: CHRISTIE, W. W. Lipid metabolism in ruminant
animals. Oxford: Pergamon Press Ltd. 1981. p.296-329.
WHITEHURST, G.B. et al. Fatty acid synthesis from lactate in growing cattle. The Journal of Nutrition. v.111, p.1454–
1461,1981.