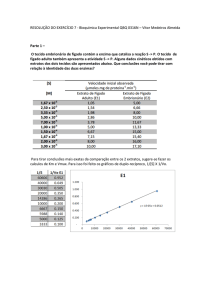
Enzimas – revisões
k1
+
E
vo =
S k2
k3
ES
+
E
P
Vmax [S]
Km + [S]
Equação de Michaelis-Menten
Vmax é o valor para o qual tende a velocidade à medida que se aumenta a
concentração de substrato; corresponde ao ponto em que todos os centros
activos das moléculas de enzima estão saturados de substrato.
V
Km é o valor de [S] para o qual vo= max
2
e é uma medida da afinidade do enzima por um determinado substrato.
k1
+
E
S k2
k3
ES
+
P
E
- Significado de Vmax
Vmax= k3 [E]
O que quer dizer que é constante para uma determinada
reacção, condições reaccionais e concentração de enzima.
Vmax k
= cat
[E]
medida da “eficiência” do enzima: µmoles de produto
produzido por minuto por molécula de enzima
k1
+
E
- Significado de Km
S k2
k3
ES
+
E
P
É uma medida da afinidade de um substrato para se ligar a um determinado
enzima:
S1: maior afinidade
S2: menor afinidade
Km1 Km2
↑↑ afinidade ⇒ menor dificuldade
de ligação de E a S ⇒ ↓↓ Km ⇒
aproximação mais rápida a Vmax
↓↓afinidade ⇒ maior dificuldade
de ligação de E a S ⇒ ↑↑Km ⇒
aproximação mais lenta a Vmax
Regulação da
actividade enzimática
Regulação da actividade enzimática
1. pH, [S], concentrações de iões e/ou coenzimas
no microambiente celular
2. Modificação covalente reversível
enzimas reguladoras
de vias metabólicas
3. Alosteria
4. Zimogénios
5. Repressão/desrepressão genética
- via metabólica ramificada
- importante: regulação de enzimas situados
em pontos-chave das vias metabólicas (
)
ex: na primeira reacção da glicólise
Glucose + ATP
hexocinase
Glucose 6-P + ADP
hexocinase inibida pela Glucose 6-P e activada pelo Pi
Vias metabólicas
A
E1
E2
B
C
E3
D
E4
E
- vias metabólicas normalmente irreversíveis (direccionalidade) (ver
- reacção fortemente irreversível no início da via metabólica
termodinâmica!!!)
- vias catabólicas e metabólicas diferentes (melhor controlo):
A
E1
E4
B
D
E2
C
E3
Compartimentação: diferentes vias em diferentes compartimentos celulares
Organelo
Função
Citosol
glicólise, via das pentoses fosfato, síntese de ácidos
gordos, muitas reacções da gluconeogénese
Mitocôndrias
ciclo de Krebs, fosforilação oxidativa, oxidação dos
ácidos gordos, degradação de aminoácidos
Lisossomas
digestão enzimática de componentes celulares e
matérias ingeridas
Núcleo
replicação e transcrição do DNA, processamento do RNA
Aparelho de Golgi
processamento pós-translaccional de proteínas
secretoras e membranares; formação de membrana
plasmática e vesículas secretoras
Retículo
endoplásmico
rugoso
síntese de proteínas secretoras e proteínas ligadas à
membrana
Retículo
endoplásmico liso
biossíntese de lípidos e de esteróides
Peroxissomas
(glioxissomas nas
plantas)
reacções oxidativas catalisadas por aminoácido oxidases
e catalase; ciclo do glioxilato nas plantas
Modificação covalente reversível
- mudança de actividade do enzima devido à ligação (ou libertação) de
um grupo a uma ou mais cadeias laterais de aminoácidos:
E-tyr-OH
E-ser-OH
ATP
ATP
ADP
PPi
E-ser-O-PO32-
(Glucose)n + Pi
R
O
E-glu-C =
OCH3
E-tyr-O-AMP
fosforilação
Ex:
E-glu-COOR-CH3
carboximetilação
adenilação
glicogénio fosforilase
(Glucose)n-1 + glucose-1-fosfato
glicogénio fosforilase cinase
E CH2OH
glicogénio
fosforilase B
(menos activa)
+ fosfato
CH2OPO32-
E
- fosfato
glicogénio fosforilase fosfatase
glicogénio
fosforilase A
(mais activa)
Associação-dissociação
- muitas vezes
desencadeada por
modificação covalente
ligação não covalente de um ligando
dissociação
dissociação
+
associação
oligómero
activo
menos activos
ou inactivos
+
associação
geralmente
inactivos
novamente o mesmo enzima:
glicogénio fosforilase
fosfatase
2-
4H2O
CH2OPO32-
(PO32 -) OH2C
E
E
E
E
4Pi
HOH2C
(PO3 ) OH2C
CH2OPO32-
glicogénio fosforilase A
(mais activa)
E E
CH2OH
4ATP
4ADP
glicogénio fosforilase
cinase
glicogénio fosforilase B
(menos activa)
por sua vez:
glicogénio fosforilase
cinase fosfatase
4H2O
4Pi
glicogénio fosforilase
glicogénio fosforilase
cinase
cinase-PO324ATP
4ADP
(forma
inactiva)
(forma activa)
glicogénio fosforilase
cinase cinase
⇒“cascata” de activação:
ATP
“mensagem”: necessária energia (ATP)
degradação
aeróbia
adrenalina
AMPc
glicogénio fosforilase
cinase
(inactiva)
glucose 1-P
+
glicogénio (+ curto)
glicogénio fosforilase
cinase cinase
(glicogénio fosforilase
cinase fosfatase)
(glucose)n-1 + Pi
glicogénio fosforilase
cinase-P
(activa)
glicogénio fosforilase
(inactiva)
E
E + E
E
glicogénio fosforilase
fosfatase
glicogénio fosforilase-P
(activa)
P
P
P
E
E
E
E
P
glicogénio
(glucose)n + Pi
Enzimas alostéricas
(“allo-”, outro + “-sterismo”, conformação espacial)
- constituídas por várias subunidades
- regulação das actividade por efectores, metabolitos específicos que se
ligam a um sítio da proteína enzimática diferente do centro activo,
alterando-lhe a conformação
activadores (+)
efectores
inibidores (-)
- activação pelo
substrato inicial:
- inibição pelo produto
final (“feedback” ou
retroinibição)
Enzimas
éricas
Alost
Enzimas Alosté
Alostéricas
NÃO OBEDECEM À CINÉ
CINÉTICA DE MICHAELISMICHAELIS-MENTEN
1.
A molécula de enzima é formada por subunidades
2.
A ligação do substrato a um local activo afecta as propriedades de
ligação do outro local activo na mesma molécula de enzima
3.
A interacção entre as subunidades torna a ligação E-S uma ligaç
ligação
cooperativa (homoalosteria)
⇓
A curva de saturação da enzima pelo
substrato é uma SIGMÓIDE
4.
A actividade de uma enzima alostérica pode ser modificada por
molé
moléculas reguladoras (heteroalosteria), que se ligam a locais
diferentes dos locais catalíticos
⇓
Inibidores/Activadores alosté
alostéricos
Enzimas alostéricas
vo
vo
[S]
cinética de Michaelis-Menten
(hiperbólica)
[S]
cinética alostérica
(sigmóide)
⇒ em presença de efectores:
vo
- Enzimas com várias subunidades
- em pontos-chave de vias metabólicas,
sujeitos a regulação por acção de efectores
+ activador
+ inibidor
activadores: efectores (+)
inibidores: efectores (-)
- efectores (+) e (-) alteram Km mas não
alteram Vmax
↑↑[activador]:↓↓Km
Km(+)
Km
↑↑[inibidor]: ↑↑ Km
Km(-)
Animação sobre alosteria:
http://bcs.whfreeman.com/thelifewire/content/chp06/0602002.html
Interconversão entre forma inactiva (T) e activa
(R) das enzimas alosté
alostéricas
Dois modelos explicam a interacção cooperativa (curva sigmóide):
1. Modelo simé
simétrico
- Existe equilíbrio entre a conformação R e T na presença de S
- Todas as subunidades estão na mesma conformação
(T ou R)
•
T
Modelo sequencial
(Baixa ligação)
R
(Alta ligação)
- Existe equilíbrio entre a conformação R e T na presença de S
- A transição de conformação T→
→ R é induzida pela ligação de S
- A alteração da conformação T→
→ R em diferentes subunidades da
molécula de enzima é sequencial (espécies híbridas RT são
proeminentes)
- As subunidades podem interagir mesmo que estejam em diferentes
estadios conformacionais
T
R
Efeito
Efeitoda
daligação
ligaçãode
deum
umsubstrato
substratocooperativo
cooperativona
nacinética
cinética
enzimática
enzimática
Os inibidores alostérios desviam
para a forma T
Os activadores alostéricos desviam
para a forma R
Glucose
- piruvato cinase, enzima
reguladora do metabolismo
energético:
(2 reacções)
Frutose 6-fosfato
Fosfofrutocinase
Frutose
1.6-bisfosfato
Frutose 1.6-bisfosfato
(5 reacções)
(+)
Fosfoenolpiruvato (PEP) + ADP
piruvato
cinase
Piruvato
cinase
Piruvato + ATP
(-)
(-)
(gluconeogénese)
(gluconeogénese)
Alanina
Acetil-CoA
alanina
Oxaloacetato
Oxaloacetato
O
Fig. 1. Reacção catalisada
pela piruvato cinase
(adaptado de Taber et al., 1998)
Ciclo de Krebs
ATP
Zimogénios
mecanismo
activador
+
(modificação
estrutural)
ZIMOGÉNIO
(pro-enzima)
ENZIMA
ACTIVA
oligopéptido
Exemplo 1: proteases
pepsinogénio
sintetizado no estômago
tripsinogénio
quimotripsinogénio sintetizados no pâncreas
procarboxipeptidase
(a) no estômago:
pepsinogénio
H+
pepsina + 42 aa da ext. N
(b) no intestino delgado:
tripsinogénio
enterocinase
enterocinase segregada em pequenas
quantidades pela mucosa intestinal
tripsina + 6 aa
quimotripsinogénio tripsina
quimotripsina + aa
procarboxipeptidase tripsina
carboxipeptidase + aa
grânulos de zimogénio
em células do pâncreas
libertação dos zimogénios
para o lúmen intestinal
grânulo de
zimogénio
duodeno
ducto pancreático
ducto biliar
abertura dos ductos
pancreático e biliar
complexo
de Golgi
ribossomas ligados
ao retículo endoplásmico
- no lúmen intestinal:
(resto da sequência de aminoácidos)
Tripsinogénio
(resto da sequência de aminoácidos)
Tripsina
o centro activo, que estava bloqueado
por esta interacção, fica livre para a
actividade catalítica
- e ainda:
Quimotripsinogénio (inactivo)
tripsina
Quimotripsina π (activa)
quimotripsina
Quimotripsina α (activa)
cadeia A
cadeia B
cadeia C
ligadas entre si por pontes S-S
passa a ser possível esta
interacção indispensável
à actividade catalítica
Exemplo 2: coagulação do sangue
protrombina
(inactiva)
fibrinogénio
Ca2+
várias proteínas
trombina
trombina + aa
(activa)
fibrina + fibrinopéptidos A e B
(solúvel)
tendência para
agregação
coágulo de
fibrina
entrecruzada
Exemplo 3: hormonas
proinsulina
arg 63
gly 64
N
S
S
S
S S
tripsina
insulina + aa
arg 63
84 C
S
31 arg
30 ala
31 arg
N
S
N
84 aa, inactiva
S
C
S
S S
S
C
51 aa, hormona activa
Repressão/desrepressão genética
ex: curva de crescimento de Escherichia coli num meio
com glucose e lactose
crescimento
1. outras fontes de
energia: a proteína
repressora está ligada e
não deixa o gene
“fabricar” β-galactosidase
2. lactose presente: a
proteína repressora está
inactiva e o gene
“fabrica” β-galactosidase
1. outras fontes de
energia: a proteína
repressora está ligada e
não deixa o gene
“fabricar” β-galactosidase
2. lactose presente: a
proteína repressora está
inactiva e o gene
“fabrica” β-galactosidase