CINÉTICA QUÍMICA – FATORES DE INFLUÊNCIA - TEORIA
Introdução
A Cinética Química estuda a velocidade com a qual as reações acontecem e os fatores que são capazes de realizar
influência sobre ela. A medida mais comum de velocidade dentro das reações químicas é a variação de concentração ou
variação de quantidade de mols de uma espécie em um intervalo de tempo definido. Observe:
Para uma reação A → B temos que a velocidade de cada composto participante é:
v =
n −n
∆n
→ v = final inicial
∆t
∆t
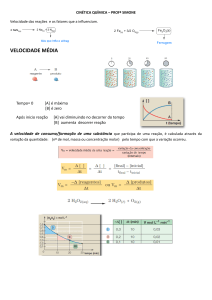
Toda reação química envolve o consumo de reagentes e a formação dos produtos. Sendo assim, a velocidade
calculada para um reagente é negativa, enquanto para um determinado produto ela é positiva.
Isso também pode ser interpretado quando pensamos no módulo da velocidade. Nesse caso, o reagente tem a
chamada velocidade de consumo, enquanto o produto tem velocidade de formação. Imagine a situação descrita na tabela
abaixo:
Reação: A → 2B
Número
de mols
Início
(t = 0s)
Fim
(t = 1s)
A
B
5 mols
0 mols
3 mols
4 mols
Para o reagente A:
vA=
n −n
3−5
∆n
→ vA = -2 mol/s ou velocidade de consumo de A = 2 mol/s.
→ v A = final inicial → vA =
∆t
∆t
1− 0
Para o produto B:
vB=
n −n
4−0
∆n
→ v B = final inicial → vB =
→ vB = 4 mol/s ou velocidade de formação de B = 4 mol/s.
∆t
∆t
1− 0
Teoria das Colisões
A Teoria das Colisões é utilizada para descrever como e quando uma determinada reação química ocorre. De acordo
com ela, para que uma reação aconteça é necessário:
a) a ocorrência de colisões entre as moléculas participantes;
b) colisões devidamente orientadas (colisões efetivas); e
c) moléculas adquiram energia suficiente para a reação ocorrer, ou seja, que atinjam a chamada Energia de
Ativação.
Definindo melhor, temos que a Energia de Ativação (EAt) é a mínima energia necessária para que o complexo
ativado seja formado e para que a reação efetivamente ocorra. O complexo ativado é um ponto intermediário na reação,
situado entre os reagentes e produtos no qual ainda existem ligações presentes nos reagentes (que estão em processo de
quebra) e já aparecem as ligações que vão formar os produtos (que estão em processo de formação) e no qual a energia é
máxima. Observe a seguinte reação:
A2 + B2 → 2AB
Num momento inicial, no qual temos apenas os reagentes, as moléculas estão com as ligações abaixo:
O complexo ativado da reação é:
Até que num momento final teríamos apenas o produto da reação química:
A energia de ativação seria então a energia necessária para que o complexo ativado seja atingido partindo dos
reagentes, ou seja, a energia entre o patamar dos reagentes e o máximo de energia da reação e está representada no gráfico
abaixo (EA):
Fatores de Influência
a) Natureza dos reagentes
Para que as reações químicas aconteçam sempre é necessário que os reagentes possuam algum tipo de afinidade que
permita a quebra das ligações previamente existentes e a formação de novas ligações relativas aos produtos da reação.
Sendo assim, quanto maior for a afinidade entre as espécies mais rapidamente ocorrerá a reação.
b) Temperatura
A temperatura de qualquer sistema pode ser definida como o grau de agitação das moléculas presentes no mesmo.
A elevação da temperatura produz aumento tanto na quantidade de colisões entre as partículas reagentes, quanto na energia
cinética das partículas, aumentando a freqüência e as chances de choques produtivos, implicando aumento da velocidade da
reação.
Uma observação importante é que a velocidade da reação sempre aumenta com o aumento da temperatura
(diretamente proporcionais), independente se estamos tratando uma reação endotérmica ou uma reação exotérmica.
c) Concentração dos Reagentes
O aumento na concentração dos reagentes provoca um aumento na quantidade de choques e na freqüência dos
mesmos, ou seja, é responsável por acelerar a reação.
d) Estado Físico dos Reagentes
O estado físico dos reagentes também é um fator influente na velocidade de uma reação. Em fase gasosa e em fase
líquida as reações são bem mais rápidas do que em fase sólida, por haver maior contato entre os reagentes, com aumento da
freqüência de colisões. Por sua vez, em fase sólida a reação será tanto mais rápida quanto maior for a superfície de contato
disponível.
e) Superfície de contato
Quanto maior for a superfície de contato, maior será a quantidade de choques efetivos realizados num dado
intervalo de tempo, ou seja, maior será a velocidade da reação. Sendo assim, por exemplo, quando reagimos um sólido
pulverizado ao invés de uma placa do mesmo sólido, a superfície de contato é maior e conseqüentemente a velocidade da
reação aumenta.
f) Catalisador
Catalisador de uma reação é uma substância que tem as seguintes propriedades:
- Não é consumido na reação global
- Aumenta a velocidade da reação
- Não influencia o equilíbrio da reação
O catalisador geralmente provoca alteração no mecanismo da reação, e, sendo assim, o aumento da velocidade da
reação é provocado pela redução da energia de ativação. Além disso, determinados compostos podem funcionar como
inibidores, reduzindo a velocidade da reação a partir do aumento da energia de ativação. Observe o gráfico:
No gráfico acima, a reação normal é representada na curva de energia de ativação EA. A inserção de um
catalisador aumenta essa velocidade através da diminuição da energia de ativação que passa a ser Ea1, enquanto que a
inserção de um inibidor provocaria a redução da velocidade da reação através do aumento da energia de ativação que
passa a ser Ea2.
Ex:
2 H2O2 → 2 H2O + O2 (g) ; velocidade = v
MnO 2 (s)
2 H2O + O2 (g) ; velocidade = v1
2 H2O2
2 H2O2
ace tan ilida
2 H2O + O2 (g) ; velocidade = v2
Como v1 > v > v2 , temos que o dióxido de manganês é um catalisador e a acetanilida é um inibidor para a decomposição
da “água oxigenada” (peróxido de hidrogênio).
Observações
(1) O conceito de catalisador está diretamente relacionado com a reação específica. Nenhuma substância pode ser
chamada isoladamente de catalisador, já que ela só é catalisadora de uma determinada reação e precisa da mesma para ser
assim classificada.
(2) Promotor de catálise é uma substância que melhora o desempenho do catalisador. Veneno catalítico é uma substância
que prejudica o desempenho do catalisador.
(3) A catálise pode ser classificada em homogênea (quando o catalisador e o meio reacional formam uma só fase) ou
heterogênea (quando o catalisador e o meio reacional estão em fases diferentes).
Exercícios Resolvidos
1) (Fuvest 94) NaHSO4 + CH3COONa → CH3COOH + Na2SO4
A reação representada pela equação acima é realizada segundo dois procedimentos:
I. Triturando reagentes sólidos.
II. Misturando soluções aquosas concentradas dos reagentes.
Utilizando mesma quantidade de NaHSO4
temperatura, a formação do ácido acético:
e mesma quantidade de CH3COONa nesses procedimentos, à mesma
a) é mais rápida em II porque em solução a freqüência de colisões entre os reagentes é maior.
b) é mais rápida em I porque no estado sólido a concentração dos reagentes é maior.
c) ocorre em I e II com igual velocidade porque os reagentes são os mesmos.
d) é mais rápida em I porque o ácido acético é liberado na forma de vapor.
e) é mais rápida em II porque o ácido acético se dissolve na água.
Solução:
Com relação aos estados físicos, o estado gasoso tem velocidade maior que o estado líquido que tem velocidade maior
do que o estado sólido. Sendo assim, em II, onde a reação se processa em solução aquosa a freqüência de colisões é
maior e consequentemente é maior a velocidade. Logo, o gabarito é letra A.
2. (Ita 2001) Considere as seguintes afirmações relativas a reações químicas ocorrendo sob as mesmas temperatura e pressão
e mantidas constantes.
I. Uma reação química realizada com a adição de um catalisador é denominada heterogênea se existir uma superfície de
contato visível entre os reagentes e o catalisador.
II. A ordem de qualquer reação química em relação à concentração do catalisador é igual a zero.
III. A constante de equilíbrio de uma reação química realizada com a adição de um catalisador tem valor numérico maior do
que o da reação não catalisada.
IV. A lei de velocidade de uma reação química realizada com a adição de um catalisador, mantidas constantes as
concentrações dos demais reagentes, é igual àquela da mesma reação não catalisada.
V. Um dos produtos de uma reação química pode ser o catalisador desta mesma reação.
Das afirmações feitas, estão CORRETAS
a) apenas I e III.
b) apenas I e V.
c) apenas I, II e IV.
d) apenas II, IV e V.
e) apenas III, IV e V.
Solução: B
I) Verdadeiro. A catálise heterogênea ocorre quando existe mais de uma fase entre reagentes e catalisador.
II) Falso. O catalisador não possui necessariamente ordem zero no que se refere à velocidade da reação.
III) Falso. O catalisador não altera o equilíbrio.
IV) Falso. O catalisador geralmente altera o mecanismo da reação, e, sendo assim, altera a lei de velocidade da
reação.
V) Verdadeiro. O produto da reação pode ser seu catalisador, e, como isso, a reação aumentaria de velocidade até
que os reagentes se esgotassem.
3. (Ufjf 2006) Considere o diagrama de energia da reação de decomposição do H2O2 representado.
Assinale a alternativa INCORRETA:
a) A reação de decomposição do H2O2 é exotérmica.
b) A curva "A" apresenta maior energia de ativação que a curva "B".
c) A presença de um catalisador afeta o ∆H da reação.
d) A curva "B" representa a reação com a presença de um catalisador.
e) A letra "Z" representa o ∆H da reação de decomposição do H2O2
Solução: C
A) Verdadeiro. O nível de energia dos produtos é menor do que o dos reagentes, sendo assim, a reação é exotérmica.
B) Verdadeiro. A curva representada bem A está acima da curva representada em B, e, sendo assim, ela tem maior
energia de ativação.
C) Falso. O catalisador não influencia em entalpia de reação, ele apenas aumenta a velocidade da mesma.
D) Verdadeiro. A curva B apresenta menor energia de ativação, sendo assim, é a reação catalisada.
E) Verdadeiro. O ∆H é a diferença da energia entre produtos e reagentes conforme mostrado na figura.